降解不同牧草的瘤胃细菌群落多样性研究
2018-10-17陈庆隆胡丽芳侯玉洁赵国琦孙建勇吴斯骏周瑶敏
徐 俊 邬 磊 陈庆隆 胡丽芳 侯玉洁 赵国琦 孙建勇 吴斯骏* 周瑶敏*
(1.江西省农业科学院,南昌330200;2.扬州大学动物科学与技术学院,扬州225009;3.南昌市农业科学院,南昌330008;4.新疆阿勒泰市第一牧场畜牧兽医站,阿勒泰836500)
反刍动物瘤胃中栖息着大量细菌、真菌和原虫等微生物,牧草纤维可在瘤胃微生物作用下降解为挥发性脂肪酸进而为机体供能,因此,深入研究纤维降解的微生物机制对于反刍动物高效利用牧草资源具有十分重要的意义。不同牧草的组织结构存在差异,其中豆科牧草(如苜蓿)主要由易降解的厚角组织、绿色组织和韧皮部组成,而禾本科牧草(如燕麦草和羊草)和稻草秸秆主要由厚壁组织、薄壁组织、维管束和韧皮部等组成,研究发现,微生物对细胞壁的吸附和降解与牧草组织结构及其类型密切相关[1]。在降解纤维的瘤胃微生物中,细菌在纤维降解过程中起决定性作用,尤其是与牧草紧密吸附的细菌[2]。黄色瘤胃球菌(Ruminococcusflavefaciens,R.flavefaciens)、白色瘤胃球菌(Ruminococcusalbus,R.albus)和产琥珀酸丝状杆菌(Fibrobactersuccinogenes,F.succinogenes)是3种主要纤维降解菌[3-5],有研究表明,细菌可以快速附着于黑麦草表面,且在薄壁组织和韧皮部中的细菌吸附量最多,尤其是黄色瘤胃球菌[6]。Akin等[7]通过电子显微镜技术发现降解羊茅草和鸭茅草的纤维降解菌中有70%是F.succinogenes和R.flavefaciens。Koike等[8]通过竞争性PCR研究了绵羊中3种主要纤维降解菌对鸭茅茎秆的吸附和降解情况,培养5 min后发现,F.succinogenes和其他2种球菌(R.flavefaciens和R.albus)的数量可达茎秆干物质(DM)含量的105和104个/g,24 h时F.succinogenes和R.flavefaciens的数量达到峰值,分别为茎秆DM含量的109和107个/g,而R.albus在48 h达到峰值,为茎秆DM含量的106个/g。然而,前人多集中在对几种主要纤维降解菌数量变化的研究[9],且研究手段多为显微镜技术和荧光定量PCR技术等,有关高通量测序手段对嵌在牧草细胞壁内部的细菌群落结构多样性的研究鲜有报道。因此,本文选择我国奶牛场常用的苜蓿、燕麦草、羊草和稻草为研究对象,通过尼龙袋试验,借助Miseq高通量测序技术从微生物群落结构多样性的角度探究不同牧草中纤维降解菌的差异,为进一步深入探索饲草降解率差异形成的原因和饲粮对瘤胃菌群的形成机理提供一定的理论基础。
1 材料与方法
1.1 试验动物和饲养管理
选取3头安装有永久性瘤胃瘘管的健康、干奶期荷斯坦奶牛[(600±15) kg],根据NRC(2001)3倍维持需要的营养标准,饲喂主要由玉米、豆粕、玉米青贮和稻草秸秆组成的全混合日粮(TMR),采集饲料样品放入65 ℃烘箱中烘干48 h,测定初水分,然后过40目筛,测定样品粗蛋白质(CP)、粗脂肪(EE)、有机物(OM)[10]、粗灰分(Ash)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)[11]含量,非纤维性碳水化合物(NFC)含量可通过计算[非纤维性碳水化合物(%)=100-(粗蛋白质+中性洗涤纤维+粗脂肪+粗灰分)]得出。钙(Ca)和磷(P)含量采用电感耦合等离子体原子发射光谱法测定[10],饲粮组成及营养水平如表1所示,采用拴系式饲养,日喂2次,自由饮水。
1.2 试验材料
试验选用试验基地种植的长势和株高相近的初花期紫花苜蓿、抽穗初期燕麦草和羊草以及收割后的稻草,从根部切割后去掉叶子和叶鞘,剥离出茎秆作为试验材料。
1.3 试验方法
将4种牧草样品放入65 ℃烘箱中烘48 h,测定初水分,然后过40目筛,测定样品粗蛋白质、粗脂肪、有机物、中性洗涤纤维和酸性洗涤纤维含量,计算非纤维性碳水化合物含量。然后分别称取3.0 g粉碎好的苜蓿、燕麦草、羊草和稻草样品(2 mm筛)放入尼龙袋(8 cm×12 cm,网孔孔径300目)中,每种牧草称取6份,每头牛2个重复,于晨饲前将24个尼龙袋分别投放到3头奶牛瘤胃中,同时将尼龙绳栓在瘘管盖上固定,降解24 h后取出所有尼龙袋,放入冰水中停止发酵,分别将相同牧草的2个重复样品混合均匀,然后用冷水冲洗直到流出的水澄清为止,放入-80 ℃低温冰箱(BCD-208K ACJN,青岛海尔股份有限公司)保存。

表1 饲粮组成及营养水平(干物质基础)
1)每千克预混料含有 One kilogram of premix contained the following: VA 400 000 IU,VD 80 000 IU,VE 2 000 IU,Zn 5 000 mg,Se 40 mg,Mn 2 000 mg,Fe 2 000 mg,Co 20 mg,Cu 1 200 mg,I 50 mg。
2)营养水平为实测值。Nutrient levels were measured values.
测样时将牧草在冰上解冻,利用OMEGA试剂盒(M2327-02)提取总DNA,取经液氮粉碎的植物组织放入1.5 mL灭菌离心管中,立即加入己内酰胺(CPL)缓冲液涡旋,然后放入65 ℃水浴孵育15 min,加入氯仿∶异戊醇(24∶1)混合液,高速涡旋后高速离心,吸取上清液,依次加入核糖核酸酶、CXD缓冲液、无水乙醇,涡旋15 s后转入吸附柱中离心,然后丢弃收集管和收集液,将吸附柱转入第2个新的收集管中,加入无水乙醇稀释、离心,再加入无水乙醇冲洗缓冲液、离心,将吸附柱转入一个新的1.5 mL离心管中,加入预先预热的双蒸水孵育,离心3 min,将DNA洗脱后收集。对提取好的DNA样品用核酸蛋白分析仪(DU640,美国Backman公司)测定260和280 nm处的吸光度值以及DNA浓度,用1%的琼脂糖凝胶通过电泳仪(DYY-6C电泳仪,北京六一仪器厂)进行DNA质量检测。
根据细菌16S rDNA的V3区保守序列,设计通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和533R(5′-TTACCGCGGCTGCTGGCAC-3′),PCR扩增采用25 μL反应体系:2.5 μL10×PCR Buffer,各1 μL引物(各10 μmol/L),2 μL dNTP Mix(2.5 mmol/L),0.125 μL DNA聚合酶(5.0 U/μL),20 ng DNA模板,ddH2O补齐。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,进行21个循环,最后72 ℃延伸5 min,结束后4 ℃保存。PCR扩增产物用1.5%琼脂糖凝胶电泳进行检测,然后使用Axygen DNA胶回收纯化试剂盒(Axy Prep DNA Gel Extration kit,AP-GX-500)对V3区扩增产物进行切胶回收纯化,经Biotek酶标仪(FLX800,美国伯腾仪器有限公司)对纯化好的PCR产物进行定量,为防止多样品混合测序容易产生不均一现象,需按测序要求将每一个待测样品进行等量混匀形成均一混合物,PCR混合物经质量控制后,采用标准的Illumina TruSeq DNA文库制备流程构建Illumina测序文库,最后按照Illumina Miseq平台上机进行Barcoded Illumina Miseq测序。
1.4 数据处理与分析
对原始序列数据进行质量控制得到有效序列,丢弃长度短于120 bp、含有模糊碱基、引物碱基含2个以上的错配信息、单个碱基重复数超过6个的序列,获得优质序列。根据序列相似度为97%的原则,将序列归为多个操作分类单元(operational taxonomic unit,OTU),并对序列进行聚类分析。
对生成的OTU信息进行细菌群落丰富度和多样性分析,其中丰富度指数用Chao1指数和Ace指数表示,多样性指数用Shannon指数和Simpson指数表示,Shannon指数值越大,说明群落多样性越高,Simpson指数值越大,说明群落多样性越低。在属水平上做聚类Heatmap图,同时对微生物群落进行UniFrac分析,比较不同牧草间的群落差异性。
1.5 统计分析
数据采用Excel 2007进行整理,结果采用SAS 9.0统计软件的PDIFF模块进行方差分析和显著性检验,以P<0.05和P<0.01作为差异显著和极显著判断标准。
2 结果与分析
2.1 牧草营养水平
表2所示为4种牧草的营养水平,结果表明不同牧草的营养水平存在一定的差异,4种牧草的干物质和有机物含量相当,但是苜蓿的粗蛋白质含量则远远高于燕麦草、羊草和稻草,而苜蓿的中性洗涤纤维和粗纤维含量则比禾本科的燕麦草、羊草和稻草要低。

表2 牧草营养水平(干物质基础)
2.2 菌群结构丰富度和多样性
测序后,本研究12个测试样品共产生591 378条有效序列,经质量控制后得到562 727条高质量序列,平均序列长度为161 bp。不同牧草降解过程中的菌群结构丰富度和多样性结果如表3所示。物种丰富度指数Chao指数为5 603~729 3,Ace指数为7 455~9 792,各组间Chao指数和Ace指数均差异不显著(P>0.05)。不同牧草对物种多样性指数Simpson指数有极显著影响(P<0.01),且苜蓿的Simpson指数最高,极显著高于其他牧草(P<0.01);羊草的Simpson指数最低,极显著低于其他牧草(P<0.01)。这表明附着在不同牧草上的细菌多样性不同,且羊草物种多样性最高,苜蓿最低。各组文库覆盖率均在94%以上,说明每个样品测序量合理,可以很好地反映牧草中细菌群落种类和结构多样性。

表3 不同牧草降解过程中的菌群结构丰富度和多样性结果
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.3 细菌组成和群落结构
在属水平上,序列比对得到的91个菌属中共有11个菌属的相对含量大于0.1%(表4),而其他鉴定出的菌属相对含量均较低,这表明吸附在牧草中的细菌含有很多相对丰度较低的菌属。在相对含量大于0.1%的菌属中,不同牧草中均以丁酸弧菌属(Butyrivibrio)、普雷沃氏菌属(Prevotella)、纤维杆菌属(Fibrobacter)和密螺旋体属(Treponema)为优势菌属,且Butyrivibrio和Prevotella所占比例较高,分别占总序列的8.88%~12.30%和7.01%~9.29%,不同牧草对上述菌属相对含量存在极显著影响(P<0.01)。

表4 基于细菌属水平相对含量大于0.1%(序列所占比例)的不同牧草比较分析
2.4 组间的相似性分析
通过颜色梯度及相似程度来反映不同牧草组在各分类水平上群落组成的相似性和差异性,图例不同颜色代表不同牧草组OTU的相对丰度比例,由图1可知,12个样品共分成了2大簇,每个大簇下面又有4小簇,每小簇均为同一牧草的3个样品,这说明相同牧草3个平行样附着的细菌群落结构十分相似,可以很好地聚在一起,而不同牧草间群落结构存在明显差异。

WA:苜蓿 Alfalfa;WB:燕麦草 Oat hay;WC:羊草 Leymus chinensis;WD:稻草 Rice straw。
图1属水平下12个牧草样品聚类分析热图
Fig.1 Cluster analysis heat map under genus level of 12 forage samples
在本研究中,我们利用UniFrac的加权主坐标分析(PCoA)对降解不同牧草的细菌群落结构差异进行了研究,它是通过系统进化距离来衡量样品间距离,用于表征细菌群落结构的差异大小,PCoA可以将这种差异显示在二维或三维空间的PCoA图上,因此,图中距离越近的点表示2个样品的菌群结构越相似。由图2可知,基于UniFrac的PCoA其第一主成分和第二主成分的贡献率分别为52.89%和19.43%,不同牧草间细菌群落结构差异明显,但相同牧草的3个样品可以很好地聚在一起,菌群相似度很高。
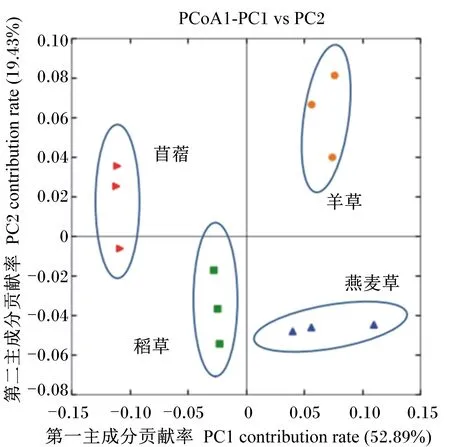
图2 97%相似性水平下12个牧草样品菌群结构Unifrac的加权主坐标分析图
通过统计不同牧草组中共有和独有的OTU数目,在97%相似性水平下,4个组共产生8 997个OTU,如图3所示,其中苜蓿、燕麦草、羊草和稻草中OTU数目分别为5 778、6 984、5 220和6 018,4种牧草共享了2 913个OTU,占细菌总OTU数目的32.38%,苜蓿、燕麦草、羊草和稻草中独有的OTU数目分别为6.07%、10.61%、4.85%和6.88%,其顺序为燕麦草>稻草>苜蓿>羊草。由此可见,吸附在不同牧草上的细菌共享了约1/3的OTU,且不同牧草中存在一定比例独有的OTU。
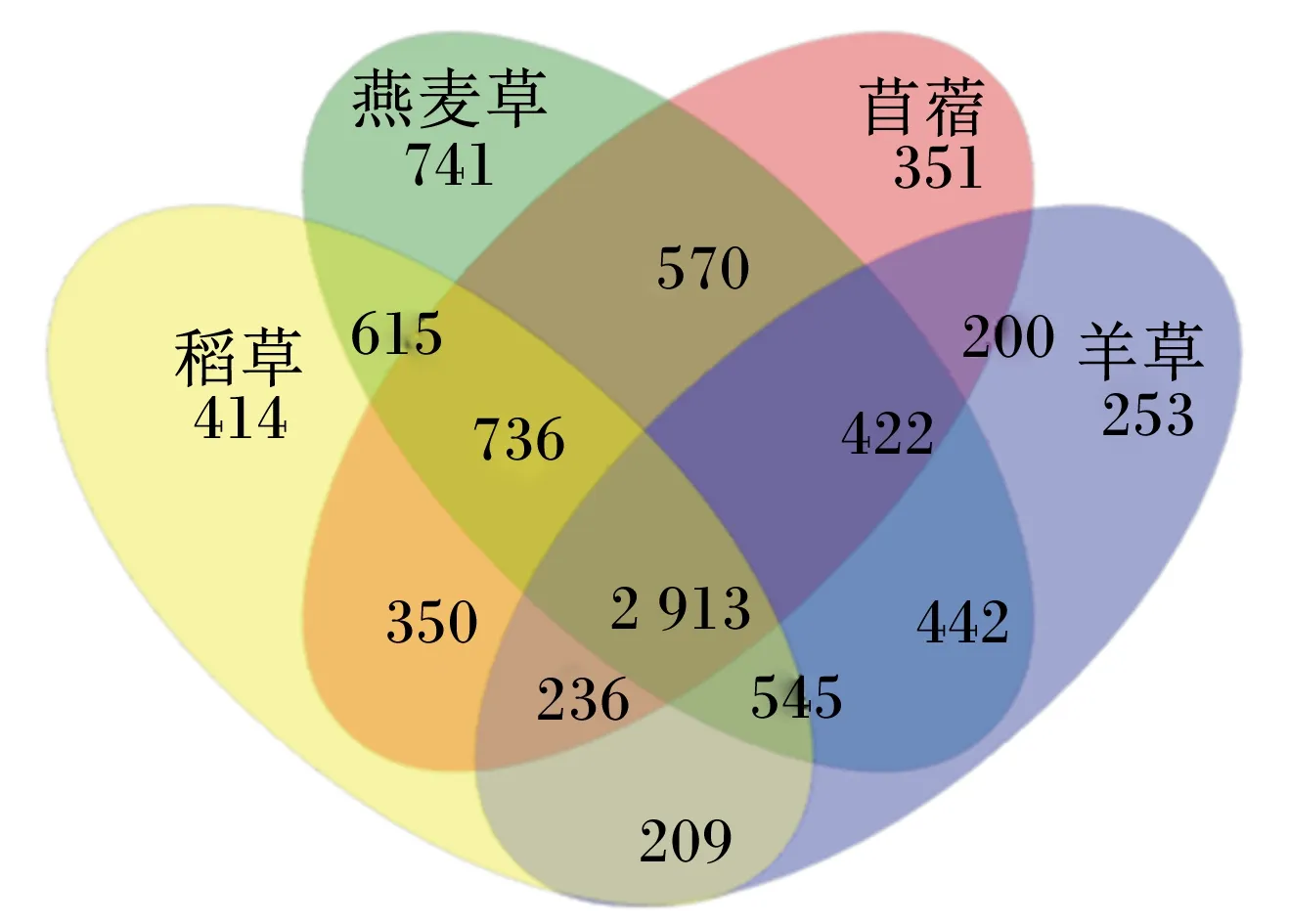
图3 不同牧草组细菌群落共享和独有的OUT数目的Venn图分析
3 讨 论
序列比对后发现,Butyrivibrio、Prevotella、Treponema和Fibrobacter是牧草中的优势菌属,这与饲喂上述4种牧草的奶牛其瘤胃液中的优势菌属种类相一致[12]。尽管不同牧草的优势菌属在种类上没有差异,但不同牧草组间细菌相对含量存在显著或极显著差异,这主要是因为不同牧草的营养组分、组织结构和吸附的微生物种类不同造成的,不同微生物会对不同底物产生不同的响应[12-13]。Butyrivibrio是厚壁菌门(Firmicutes)中主要的纤维分解菌属,它们在纤维分解中发挥了重要作用,研究表明Butyrivibrio可以利用纤维素、淀粉和其他多聚糖为发酵底物,且苜蓿显著高于其他3种牧草,这可能与苜蓿中可发酵碳水化合物含量高于禾本科的燕麦草、羊草和稻草密切相关。Prevotella中拥有高活性的半纤维素分解菌[14],并对植物非纤维多糖和蛋白质的降解至关重要[15],Butyrivibrio加上Prevotella在苜蓿(21.59%)中所占的比例明显高于燕麦草(16.45%)、羊草(18.05%)和稻草(18.96%),这可能与苜蓿中的蛋白质和可发酵碳水化合物含量高有关,但这有待于进一步开展研究证实。尽管Ruminococcus和Fibrobacter在瘤胃中丰度低于Butyrivibrio和Prevotella,但它们在牧草纤维的降解中也发挥了重要作用。除此之外,本研究中还发现多达80种低丰度菌属,尽管丰度较低,但分泌的纤维素酶活或许很高,如真杆菌属(Eubacterium)、假丁酸弧菌属(Pseudobutyrivibrio)和颤螺旋菌属(Oscillibacter)等菌属,它们在纤维降解过程中发挥着重要作用[16]。
微生物可以快速吸附于细胞壁表面,但细胞壁降解速率及其程度受微生物与底物黏附程度、饲料理化特性和瘤胃消化动力学等因素的影响[17]。对不同底物(黑麦草叶、黑麦草茎和稻草秸秆)在山羊瘤胃24 h内微生物吸附的研究表明,吸附在不同纤维底物上的微生物在瘤胃降解前6 h无显著差异,细菌总数在6 h后逐渐稳定;变性梯度凝胶电泳(DGGE)图谱表明,底物在降解12和24 h后的微生物群落结构与降解6 h后的微生物群落结构存在显著差异,这充分说明不同底物吸附的微生物会随时间的不同发生改变[18]。对吸附的微生物进行克隆文库的研究还发现Treponema只在苜蓿样品中发现,在果园草中未发现[8],然而,本研究中苜蓿等4种牧草中均能发现存在Treponema,该结果与果园草中的结论存在差异,这可能与本试验中使用的牧草品种、试验动物和饲喂饲粮等因素不同有关。研究发现细菌可在15 min内快速吸附于黑麦草细胞壁中,且黄色瘤胃球菌更喜欢吸附在黑麦草叶的表皮、薄壁组织和韧皮部边缘[19]。以羊茅草和鸭茅草为底物的研究表明,吸附在牧草中的微生物大多是产琥珀酸丝状杆菌和黄色瘤胃球菌[7, 20],它们占细菌总数的0.1%~6.6%和1.3%~2.9%[21-23],上述结果与本研究中禾本科草(燕麦、羊草和稻草)的瘤胃球菌属含量均高于豆科草(苜蓿)的结果相一致,这可能与禾本科草中的纤维素含量高于苜蓿有关,研究发现瘤胃球菌属可发酵纤维素及其水解产物纤维二糖,而苜蓿草中的纤维素含量仅占22.65%,均低于燕麦草、羊草和稻草。定植不同底物中的微生物细菌形态相似,但微生物数量显著不同,微生物数量在24 h时达到峰值,其中以杆球菌(Rodcocci),双球菌(Diplococci)和螺旋体门(Spirochaetes)含量最多[24],这也是本研究中选择牧草降解24 h后取出进行微生物群落结构研究分析的原因。
从不同牧草细菌群落结构相似性的研究结果表明,12个样品在聚类分析热图中分为两大簇,4组不同牧草的3个样品又聚成小簇,由此可见,相同牧草的3个重复样品之间的微生物降解菌的群落结构十分相似,而不同牧草之间存在明显差异,这与细菌在属水平上各组间存在显著或极显著差异的结果相一致。与此同时,同为禾本科草的燕麦草和羊草最终聚成一大簇,这说明降解禾本科草的细菌群落结构更相似,这可能与燕麦草和羊草的细胞壁结构组成和营养成分相似有密切关系[25-26],由表2中可以发现,燕麦草和羊草的粗蛋白质(5.89% vs. 5.54%)、中性洗涤纤维(67.58% vs. 69.25%)和粗纤维(28.14% vs. 29.36%)含量均相近,营养组分和细胞壁结构的相近可能是导致燕麦草和羊草中细菌群落结构相似的主要原因[12]。苜蓿和稻草聚成了一大簇,它们之间的细菌群落结构更相似,这与先前通过扫描电镜和干物质降解率的研究发现苜蓿和稻草的降解存在相似性的结论相吻合[1,27]。在考虑物种丰度的UniFrac的PCoA图中,4组牧草样品能够很好地分隔开,这与聚类分析热图的结果相一致。
4 小 结
通过高通量测序技术对降解4种牧草中的细菌群落结构差异性研究表明,4种不同牧草在相同降解时间下附着的微生物群落结构多样性存在明显差异。在属水平上,降解纤维的优势菌属主要是Butyrivibrio、Prevotella、Fibrobacter和Treponema。
