α-酮戊二酸的生理功能及其在动物生产中的应用
2018-10-17陈家顺苏文璇符晨星
陈家顺 苏文璇 符晨星 姚 康*
(1.湖南农业大学动物科学技术学院,长沙410128;2.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,长沙410125;3.衡阳师范学院生命科学与环境学院,衡阳421002;4.湖南农业大学,湖南省植物功能成分利用协同创新中心,长沙410128)
一直以来,对于可能影响代谢过程中关键营养素的研究是有限的,目前主要是集中在脂肪酸、维生素、微量元素、核酸和特定氨基酸等方面。此外,针对动物营养的研究,已经开始通过探讨调节代谢过程来发挥组织器官特异性效应,而不是简单地改善营养。α-酮戊二酸(alpha-ketoglutarate,AKG)是三羧酸(tricarboxylic acid,TCA)循环的中心物质,且在细胞能量代谢中具有关键作用。在细胞代谢中,AKG的产生和分解涉及各种代谢途径。在TCA循环中,异柠檬酸在异柠檬酸脱氢酶作用下氧化脱羧生成AKG,也可以通过AKG脱氢酶(TCA循环关键酶)脱羧基化为AKG、琥珀酰辅酶A和二氧化碳(CO2)。而谷氨酸可以通过谷氨酸脱氢酶脱氨作用或者转氨基作用生成AKG。另外,AKG在溶液中具有良好稳定性和溶解性,不会显示出有毒的特性。

1 AKG的生理功能
1.1 促进蛋白质合成
AKG及相关复合物谷氨酰胺、谷氨酸及鸟氨酸-AKG,已经在老年病及术后运动恢复所需营养等方面推广应用;AKG有利于改善烧伤病人的负氮平衡和短暂性局部缺血及放疗病人受损小肠的恢复,还能影响透析病人的氨基酸代谢[8]。在细胞代谢中,AKG是谷氨酰胺和谷氨酸的重要来源,它能刺激肌肉蛋白质合成,抑制蛋白质降解,而且还是胃肠道细胞的重要代谢燃料;在手术后膳食补充AKG能改善负氮平衡,增加肌肉中蛋白质的合成[9]。谷氨酰胺是生物体内所有类型细胞的能量来源,占总氨基酸池的60%以上,因此,AKG作为谷氨酰胺的前体,是肠道细胞能量的主要来源,也是肠道细胞和其他快速分裂细胞的优选底物。另外,从骨组织中神经纤维释放的谷氨酸,是由肝静脉周围干细胞中AKG还原胺化合成[10],并且能够促进脯氨酸的合成,其在胶原蛋白的合成中起着关键作用[11]。在肝脏中,谷氨酰胺作为尿素合成、糖异生和急性期蛋白质合成的前体,在组织器官之间氮和碳的交流中起重要作用。谷氨酰胺一直被认为是非必需氨基酸,但在分解代谢状态和压力下,它是胃肠道细胞的重要燃料来源,可以迅速分裂免疫系统中的白细胞和巨噬细胞,尽管在肌肉组织有明显的释放,但是可迅速耗尽[12]。研究表明,AKG能够增加Fe2+的吸收,因此,AKG及其衍生物对于缺乏Fe2+快速生长的动物和人类促进Fe2+的吸收发挥重要作用[2]。而且AKG、抗坏血酸和Fe2+还可以通过脯氨酰水解酶将肽结合的脯氨酸羟化为羟脯氨酸,增加了胶原蛋白向胶原和骨基质的转化[13]。此外,Yao等[14]研究表明,AKG可以抑制猪肠道上皮细胞谷氨酰胺降解,并通过激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,促进蛋白质合成。因此,AKG在细胞和生物体蛋白质合成过程中具有重要作用。
1.2 促进骨骼发育
前期研究表明,AKG通过各种机制参与胶原蛋白代谢,其主要机制如图1所示。首先,AKG是脯氨酰-4-羟化酶(prolyl-4-hydroxylase,P4H)的一个辅因子。P4H位于内质网(endoplasmic reticulum,ER)内,并催化4-羟脯氨酸的生成,其对胶原蛋白三螺旋的产生至关重要。由于没有羟基化的脯氨酸具有重复氨基酸基序列,因此,导致胶原蛋白三螺旋形成不完全。而错误折叠的三螺旋蛋白不能够分泌到细胞质中,随后在ER中降解[15]。其次,AKG可通过谷氨酸增加脯氨酸残基池促进胶原蛋白合成[16-17],而且约25%的膳食AKG在肠上皮细胞中转化为脯氨酸[11]。脯氨酸是胶原蛋白合成的主要底物,在胶原蛋白代谢中起着核心作用。如图1所示,脯氨酸是通过吡咯啉5-羧酸酯(pyrroline 5-carboxylate,P5C)的转化而形成的,P5C是脯氨酸、鸟氨酸和谷氨酸之间相互转化的中间体。据报道,P5C除了通过P5C途径成为脯氨酸残基的来源之外,还可以通过脯氨酸肽酶激活胶原蛋白产生[6]。事实上,P5C途径是在胶原蛋白合成期间脯氨酸池的一个小贡献者,脯氨酸的主要来源是从胶原蛋白降解产物中得到的[18]。因此,作为P5C前体的AKG也与细胞和生物体中的脯氨酸代谢密切相关。
在对生长猪进行的一项研究中,与对照组相比,经肠内AKG施用使门静脉和动脉血液中的脯氨酸水平分别提高45%和20%。因此,肠内AKG被认为可以增加骨组织的形成[11,19]。此外,AKG对骨组织的影响,可能与其对生物体内分泌系统的影响有关。谷氨酰胺和谷氨酸转化为鸟氨酸,进一步合成精氨酸,鸟氨酸和精氨酸均能够刺激GH和IGF-1的分泌[20-21]。众所周知,GH-IGF-1轴是促进动物骨骼生长和发育的主要调控因素[22]。AKG也可能通过谷氨酸-谷氨酸受体(glutamate-glutamate receptors,GluR)的相互作用影响骨骼结构。在成骨细胞[23]和破骨细胞[24]中已经证明了GluR的存在,且Spencer等[25]证实了其在骨骼系统代谢中的意义。此外,有初步证据表明膳食AKG可以消除大鼠卵巢切除和睾丸切除术诱导的骨基质减少[26-27]。根据以上的研究,我们可以推测AKG可能在胶原蛋白代谢中发挥重要作用,然而AKG是否直接对胶原蛋白的合成产生影响尚待探究。
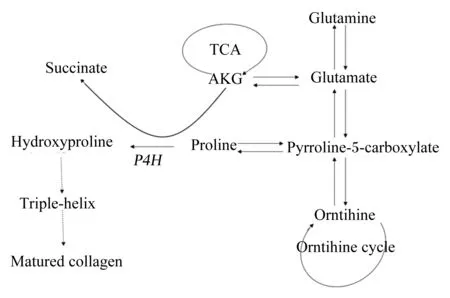
Succinate:琥珀酸盐;TCA:三羧酸 tricarboxylic acid;AKG:α-酮戊二酸 alpha-ketoglutarate;Glutamine:谷氨酰胺;Glutamate:谷氨酸;Pyrroline-5-carboxylate:吡咯啉5-羧酸酯;Orntihine:鸟氨酸;Orntihine cycle:鸟氨酸循环;Proline:脯氨酸;P4H:脯氨酰-4-羟化酶 prolyl-4-hydroxylase;Hydroxyproline:羟脯氨酸;Triple-helix:三螺旋;Matured collagen:成熟胶原蛋白。
图1AKG在胶原蛋白产生过程中的机制
Fig.1 Mechanism of AKG in collagen production
1.3 调节免疫系统
AKG也被称为免疫营养因子,其在免疫代谢中发挥重要作用[28]。夏利宁等[29]对断奶大鼠的研究表明,中草药与AKG联合使用可以明显升高T淋巴细胞数量,并且提高断奶大鼠的脾脏系数,促进脾脏增生,增强脾脏的免疫功能。AKG作为饲料添加剂可以增加小肠上皮淋巴结面积和增加肠道免疫球蛋白A的分泌,而且AKG结合中草药还可以提高机体的体液免疫、细胞免疫和非特异性免疫[30]。此外,正如前面所述,AKG是提供谷氨酰胺和谷氨酸的重要来源,被认为是谷氨酰胺的同源物和衍生物[31]。谷氨酰胺是淋巴细胞和巨噬细胞的重要燃料。巨噬细胞和嗜中性粒细胞参与早期的非特异性宿主防御反应[32]。膳食补充谷氨酰胺增加了烧伤或手术后患者中性粒细胞的体外杀菌活性[33-34]。因此,AKG作为谷氨酰胺同源物,能够增强免疫特性,提高免疫细胞和嗜中性粒细胞的活性和吞噬作用。
1.4 调节衰老
最近的一项研究表明,AKG可以通过抑制ATP合成酶和mTOR延缓衰老并延长线虫寿命约50%(图2)[1]。同时,也发现AKG不仅延长了寿命,而且延缓了与年龄相关的表型,例如协调肢体运动迅速下降,这提示AKG在机体衰老中具有潜在应用价值。然而,迄今为止,AKG是如何抑制ATP合成酶和mTOR以达到延长生物体寿命的机制尚未见报道。
线粒体ATP合成酶是一种生物体内能量代谢的关键酶,是天然存在的分子旋转马达,为细胞生命活动提供所需能量,在生命体中具有重要作用[35]。Chin等[1]研究发现,通过AKG延长寿命,则需要ATP合成酶亚基β,并且依赖于mTOR下游的靶标。Lomenick等[36]利用一种小分子目标识别策略,称为药物亲和反应稳定的靶标,发现ATP合成酶亚基β是AKG的新型结合蛋白。AKG抑制ATP合成酶,导致线粒体和哺乳动物细胞中ATP含量降低,耗氧量减少和自噬增加,类似于ATP合成酶2的失活。据推测,AKG可能主要通过靶向ATP合成酶2延长寿命。此外,前期的研究还表明,线粒体功能的完全丧失是有害的,但也证明了电子传递链的部分抑制延长了线虫的寿命[37-38]。因此,AKG可能通过抑制ATP合成酶,从而达到延长寿命是完全可能的。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,属于磷酸肌醇相关激酶家族成员,是雷帕毒素的靶分子,调节所有真核细胞的生长和代谢。之前的研究已经证明,抑制mTOR活性可以延缓衰老过程,如酵母[39]、蠕虫[40]、果蝇[41]和基因突变的小鼠[42]。AKG不能直接与mTOR相互作用,而是主要通过抑制ATP合成酶来降低mTOR途径的活性(图2)。AKG调节寿命部分依赖于AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)和叉头状转录因子(FoxO)[43]。AMPK是一种进化上保守的细胞能量传感器,在机体衰老和寿命中具有关键作用[44]。
当AMP/ATP值升高时,AMPK被激活,随后,活化的AMPK通过激活mTOR抑制因子TSC2磷酸化而抑制mTOR信号传导,从而调节细胞的能量代谢[45]。FoxO蛋白是叉头转录因子家族的亚基,其介导胰岛素和生长因子对机体的多种生理功能(包括细胞增殖、凋亡和代谢)具有关键作用[46-48]。所以,与在AKG调节寿命中mTOR的意义一样,FoxO是一种通过对降低mTOR信号的响应延长寿命所必需的转录因子[49],这对于AKG调节的寿命同样重要。此外,通过抑制mTOR活性[50-51]和饮食限制[52],在用AKG处理的蠕虫中自噬显著增加。所以,AKG处理和mTOR失活延长寿命即通过相同的途径(AKG的作用或通过mTOR上游)也通过独立机制或集中于下游效应器平行途径[1]。
此外,通过对饥饿的酵母和细菌[53]以及饥饿的鸽子肝脏[54]和运动后的人体[55]进行研究发现,AKG的生理水平提高。这种AKG水平提高的生化基础可以解释为基于饥饿的补缺糖异生作用,从而激活肝脏中谷氨酸连接转氨酶以产生来自氨基酸分解代谢的碳。Chin等[1]研究表明,饥饿的线虫中AKG水平升高,且AKG不延长饮食限制动物的寿命。这些研究结果提示,AKG是一种通过饥饿或者饮食限制介导寿命延长的关键代谢调节物(图2)。这也表明了一般代谢物,一般的细胞能量发生器和调节机体寿命的饮食限制之间新的分子联系,从而为我们提供了一个预防和治疗老年疾病的新策略。

AKG:α-酮戊二酸 alpha-ketoglutarate;ATP synthase:ATP合成酶;mTOR:雷帕霉素靶蛋白 mammalian target of rapamycin;Other targets:其他靶标;Dietary restriction (eat-2):饮食限制(线虫);Other pathways:其他路径;Long, healthy life:长寿、健康生命。
图2AKG调节寿命模型
Fig.2 Model of AKG-mediated longevity
1.5 其他功能
目前,关于AKG的研究主要集中在动物机体蛋白质合成,骨骼发育以及医学上(如创伤、手术后病人和臀部替换病人等)。近年来,随着人们对其研究的深入,也发现了一些新的特殊功能。在一项关于大鼠毒理的研究中,Bhattacharya等[56]研究发现,用AKG处理氰化物可以明显消除氰的毒性,这个结果提示AKG可以作为氰的解毒剂。Bayliak等[57]研究表明,AKG可以通过提高黑腹果蝇的抗氧化能力和氨基酸合成来提高耐寒性。Yang等[58]研究发现,AKG能够调节PR结构域蛋白16启动子的DNA脱甲基化。此外,AKG在缓解氧化应激损伤方面具有重要作用[59]。AKG还能促进人类多潜能干细胞和胚胎干细胞的增殖分化[60-61]。
2 AKG在动物生产中的应用
大量研究表明,AKG在维持总氮平衡、降低氮损失及促进蛋白质合成中起重要作用。以大鼠为研究对象,在饲粮中补充215 μmol AKG可显著降低氮损失,增加氮沉积[62]。此研究结果被Piva等[63]进一步证实,其发现无氮饲粮中添加AKG(3和6 g/kg)可使尿氮含量减少18%。Prandini等[64]研究发现,饲粮中添加AKG(3~6 g/kg)可显著降低内源性尿氮的损失,且有降低内源性粪氮的趋势。Chen等[65]研究表明,饲粮中添加1%AKG可以改善生长猪生长性能,提高氮的利用率,且降低氮的排放。Wang等[66]研究表明,饲料中添加1%AKG可以改善杂交鲟鱼生长性能,促进谷氨酰胺合成和氨基酸代谢。位莹莹等[67]研究发现,低蛋白质饲料中添加AKG(7.5和15.0 g/kg)有利于促进松浦镜鲤肝脏和胰脏氨基酸代谢,提高蛋白质利用率,促进蛋白质合成。在断奶前和断奶后,AKG的添加有效地促进了仔猪胶原蛋白的合成[68]。另外,膳食AKG(2 g/kg)可以有效改善手术后及烧伤病人体内的负氮平衡,促进肌肉中蛋白质的合成[69]。
AKG在机体骨骼发育和骨矿物质沉积等生理过程有重要作用。羔羊出生2周后口服AKG[0.1 g/(kg BW·d)]可以提高骨骼矿化及小梁骨和皮质骨的骨密度[20]。新生公羊羔长期(146 d)饲喂AKG[0.1 g/(kg BW·d)],结果显示,胫骨重量和长度以及皮质骨矿物质密度增加,胫骨最大弹性强度和极限强度分别提高10%和8%[70]。而仔猪在出生后,饲喂AKG[0.4 g/(kg BW·d)]增加了皮质骨密度以及股骨几何和机械性能[71]。Andersen等[72]研究表明,出生21~24 d的仔猪长期饲喂AKG[0.1 g/(kg BW·d)],其股骨矿物质密度和血浆雌激素水平显著提高。另外,在饲粮中联合添加AKG和β-羟基-β-甲基丁酸可显著提高仔猪生长性能,改善血液氨基酸水平,增加骨重量和皮质骨矿物质密度[73]。在对火鸡的研究中,Tatara等[74]研究表明,长期(14周)饲喂AKG[0.4 g/(kg BW·d)]显著增加了股骨和胫骨骨矿物质密度、横截面积、最大弹性强度和极限强度。进一步研究发现,饲喂AKG[0.4 g/(kg BW·d)]也显著增加了桡骨重量、骨长度、骨矿物质密度、横截面积、最大弹性强度和极限强度,同时提高了血液谷氨酰胺、脯氨酸和亮氨酸的水平[75]。在对人进行的研究中,膳食AKG对骨组织也有类似影响[13,21]。膳食AKG在维持绝经后妇女骨量和降低骨转换方面有潜在的益处[13]。以上这些研究表明AKG对骨骼代谢的调节有积极作用,提示其可能用于治疗骨质疏松。
此外,Schlegel等[76]研究表明,膳食补充AKG可以限制大鼠损伤后的细菌传播和代谢变化,因此可用于保护肠道黏膜。Hou等[77]研究表明,饲粮中添加1%AKG可以缓解脂多糖诱导仔猪肠道黏膜损伤,并促进小肠吸收。胡泉舟[78]报道指出,饲粮中添加1%AKG能提高仔猪的平均日增重。王金泉等[79]研究发现,中草药和AKG共同作为饲料添加剂比单独使用对断奶仔猪的促生长效果更明显,饲料回报率更高。刘少娟等[80]研究也表明,无抗饲粮中联合添加1%AKG和1%大蒜素可通过改善肠道形态结构,提高猪对粗蛋白质、钙和磷等养分的消化吸收能力,促进肠道健康,进而改善生长猪的生长性能。Chen等[81]研究发现,饲粮中添加1%AKG能够促进生长猪肠道有益菌的生长,改善肠道微生物菌群,调节挥发性脂肪酸产生,降低肠道氨水平,从而提高生长性能。以肉仔鸡为研究对象,余亲平等[82]研究发现,饲粮中添加0.7%AKG可显著提高2周龄肉仔鸡的体重及1~2周龄的平均日增重,其促生长效果比添加0.7%谷氨酰胺好。饲粮中添加0.5%AKG可促进热应激肉鸡肠道黏膜细胞生长,提高肠道抗氧化能力,并改善肠道能量代谢状况[83]。因此,众多研究表明AKG在维持动物和人类健康中具有重要作用。
迄今为止,AKG在动物生产上的应用仍然处在初步探索阶段,若想取得理想的效果,有必要进行深入研究,可以从以下几个方面进行研究:1)AKG在动物肠道内的吸收以及代谢情况;2)外源性AKG对机体组织内AKG以及氨基酸代谢的影响;3)AKG对其他物质(中草药提取物、有机酸、植酸酶、益生素和维生素等)协同作用效果及机制;4)AKG作为一种酸化剂,评价其作为一种抗生素替代物的应用潜力。
3 小 结
综上所述,AKG的生理意义是多方面的,并不是所有的代谢途径都已经确立。AKG促进骨骼系统发育的机制与谷氨酸受体激活、脯氨酸产生骨胶原蛋白和17β-雌二醇可能的抗分解代谢和合成代谢作用有关[70],而这种影响可能是多因素的。此外,AKG的积极影响可能有望改善早产和低出生体重新生儿的胸部功能和内脏器官保护[20]。根据目前的研究表明,AKG可能在预防和治疗人类和动物代谢性骨疾病中发挥重要作用。因此,需要进一步研究AKG的功能,阐明AKG的作用机制,探索其在人类社会或其他领域的应用潜力。在衰老方面,一些令人振奋的发现表明,雷帕霉素受体复合体1参与包括糖尿病、肥胖、心脏病和癌症等在内的大量人类疾病[84-85]。衰老是这些疾病的共同威胁因素,并且已经揭示了细胞衰老、疾病和机体衰老之间的联系机制是通过mTOR[41,86]。因此,AKG代谢可抑制mTOR信号的功能,表明AKG可能在抑制肿瘤中发挥重要作用。
