重庆某猪场大肠杆菌血清型鉴定及耐药性监测
2018-10-17徐小明钟航葛良鹏孙静
徐小明 ,钟航 ,葛良鹏 ,孙静 *
(1.重庆市畜牧科学院,农业部养猪科学重点实验室,重庆市养猪科学重点实验室,重庆 荣昌402460;2.广西大学动物科学技术学院,广西 南宁 530005)
根据发病机制和毒力因子差异,大肠杆菌可大体分为 ETEC、EIEC、UPEC、EPEC、EHEC 5 种血清型[1]。血清型还可以根据不同表面特异性抗原进行分型,优势大肠杆菌抗原种类主要有鞭毛(H)、菌体(O)、表面L型(K)三种抗原[2]。抗原排列不同,大肠杆菌血清型亦复杂多变,可以多达几千种,但致病性大肠杆菌血清型仍分布在有限范围内。本试验从猪只粪便中分离大肠杆菌,进行血清型鉴定、耐药性监测,并建立耐药谱,以期降低该病的发病率,提高治愈率。
1 材料和方法
1.1 样品采集 于重庆某规模化猪场(共12栋猪舍)采集不同年龄段不同猪只的粪便样品49个,并依次编号。其中,哺乳期仔猪1~4号为雄性,5~7号为雌性;保育期小猪8~10号为雄性,11~14号为雌性;生长育肥期中猪15~19号为雄性,20~21号为雌性;妊娠期母猪编号22~28号;哺乳期母猪编号29~35号;空怀期母猪编号36~42号;成熟公猪编号43~49号。采集范围覆盖所有猪舍。
1.2 方法
1.2.1 样品处理 用无菌拭子伸入猪只肛门内采集粪便[3],冰盒运输,于-20℃保存。随机抽取不同日龄段的粪便样品各三个,抽样结果:哺乳期仔猪2、3、6号,保育期小猪 8、13、14 号,生长育肥期中猪 15、17、18 号,妊娠期母猪 22、26、27 号,哺乳期母猪 29、31、34 号,空怀期母猪 36、40、41 号,成熟公猪 43、45、48号,共计21个样品。
1.2.2 细菌分离培养 在无菌操作台将粪便样品涂抹于麦康凯培养基,37℃培养18~24h,选取单个可疑菌落交替接种于营养琼脂和麦康凯培养基[4],重复培养至无其他形态的菌落出现。挑取单个典型菌落进行革兰氏染色、镜检,用营养肉汤培养纯化菌株,与甘油1∶1混合后-20℃保存备用。
1.2.3 生化鉴定 将纯培养物接种于营养琼脂培养基,37℃培养18h后挑取单个菌落接种于硫化氢、甘露醇、尿素、山梨醇、葡萄糖、乳糖生化管,37℃培养24h,观察并记录结果,参考第八版伯杰氏细菌手册进行比对。
1.2.4 耐药性监测 采用药敏纸片法监测21株菌对13种抗生素的敏感程度。方法:吸取200μL菌液均匀涂抹于营养琼脂表面,待菌液完全吸收后,贴上药敏纸片,纸片之间的间隔不少于2.5 cm(避免抑菌圈重叠),37℃培养24h后,用游标卡尺测量抑菌圈直径(测3组数据取平均值)[5]。敏感程度判断标准:无抑菌圈为耐药;抑菌圈直径<10mm为低度敏感;10mm<抑菌圈直径<15mm为中度敏感;抑菌圈直径>15mm为敏感。
1.2.5 血清型鉴定 采用玻片凝集试验鉴定21株菌是否是致病性血清型。用专用滴管在洁净的玻片上滴1~2滴血清,取被检菌少许与血清混匀,轻轻摇动玻片,1min内肉眼判断是否凝集,且以生理盐水为对照。结果呈阳性时再与该多价血清对应的单价血清做凝集试验,确定血清型。
1.2.6 DNA提取、16S rRNA区PCR扩增 菌株DNA提取参照酶消化法[6],具体步骤参照DNA提取试剂盒说明书,提取3、17、34、40号的菌株 DNA(本试验采用抗原分型法对分离的21株菌进行血清型分型,选其中4个样品以确定该猪场大肠杆菌的同源性)。引物采用 16S rRNA通用引物,上游引物:5,-AGAGTTTGATCCTGGCTCAG-3,,下游引物:5,-TACGGCTACCTTGTTACGACTT-3,[7],产物长度约 1500bp。PCR 反应体系:1 μL DNA 模板,2.5 μL 上游引物(10mM),2.5μL下游引物(10mM),5μL dNTP,5μL 10×Buffer,1μL rTaq,33μL ddH2O。PCR 反应条件:94℃预变性 5min;94℃变性 45s,56℃退火 30s,72℃延伸90s,循环35次;最后72℃延伸10min。
PCR扩增产物用1%琼脂糖凝胶电泳检测,并寄送苏州金唯智生物科技有限公司进行双向测序。最后,利用 Blast软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)将测序所得的序列与GenBank中已登录的基因序列进行比对,分析其同源性[8]。
2 结果
2.1 培养、分离、镜检结果 所选21个样品的猪源大肠杆菌分离率为100%。培养基培养结果显示:在营养琼脂培养基上形成圆形、中等大小、四周整齐、光滑湿润、半透明的菌落;在麦康凯培养基上形成圆形隆起、中等大小、四周整齐、桃红色且中间颜色较深、光滑湿润的菌落。镜检观察到两端钝圆,大多数成对存在、少数分散的短杆状红色细菌。
2.2 生化鉴定结果 21株菌的生化特性表现为:甘露醇、乳糖、葡萄糖试验均呈阳性,尿素试验均呈阴性,山梨醇试验大多数呈阴性、少数呈阳性,硫化氢试验多数呈阴性、少数呈阳性。
2.3 耐药性监测 用药敏纸片法监测耐药性,培养出的抑菌圈形状规则、界限明显。分离的21株菌对13种抗生素的敏感程度详见表1。分析可知,该猪场大肠杆菌耐药率分别为:头孢曲松、头孢哌酮、恩诺沙星、环丙沙星0%,新霉素4.76%,诺氟沙星、头孢噻肟9.52%,头孢唑林、阿奇霉素19.05%,四环素71.43%,复方新诺明76.19%,阿莫西林、青霉素100%。

表1 21株细菌对抗生素的敏感程度
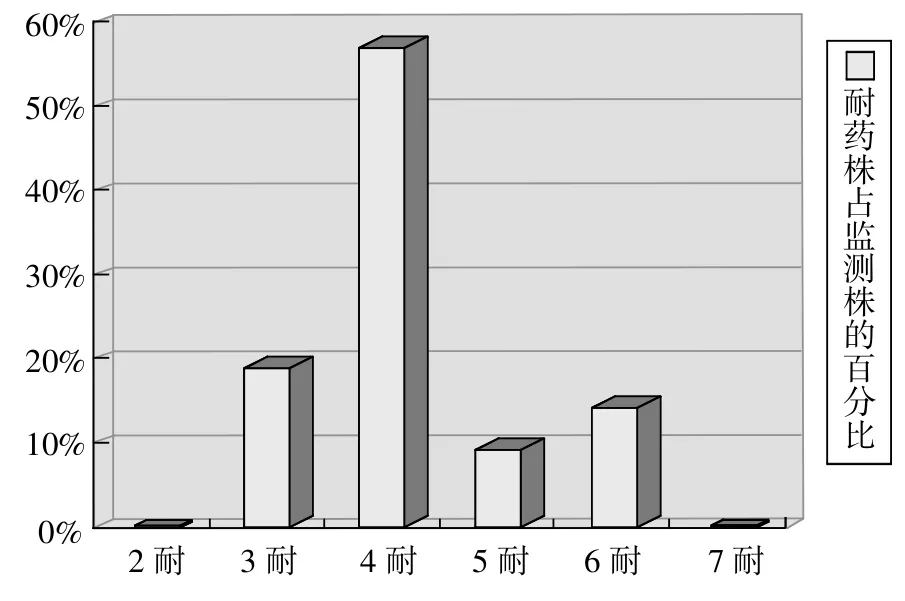
图1 21株被检菌的耐药图谱
分离菌株的多重耐药性如图1所示。可见被检菌株均表现出多重耐药性,最少为3耐、最多为6耐,其中4耐最为严重。多重耐药性具体比例为:3耐占 19.05%,4耐占 57.14%,5耐占 9.2%,6耐占14.29%。
2.4 血清型鉴定 血清玻片凝集试验显示:左侧生理盐水无凝集现象,右侧发生凝集,表明该株菌携带致病性血清。所测21个样品中,致病性血清型表现为:3 号哺乳仔猪为肠道致病性 O126∶K71(B16)型血清,48号妊娠母猪为肠道侵袭性O112∶K66型血清,其余均为非致病性血清型。
2.5 电泳成像及Blast比对结果 对16S rRNA通用引物的扩增产物进行电泳检测,结果如图2所示。M为DL2000,可在约1500bp处观察到明显的清晰、无尾条带。
4株菌PCR产物的碱基序列相似度达99%。同源性比对结果表明,所检测序列与Swine fecal bacterium RF1A-Cel5 16s ribosomal RNA partial sequence(FJ753832.1)的大肠杆菌序列相似度达99%,进一步证明所分离菌株为大肠杆菌。

图2 DNA电泳结果
3 讨论
3.1 培养形态和镜检特征 本试验所分离的21株菌均能在麦康凯和营养琼脂培养基上形成单个菌落,形态与林振华等[9]报道的一致。革兰氏染色镜检结果与郭剑英等[10]报道的一致,符合大肠杆菌特性。
3.2 生化特性分析 所分离的21株菌的生化鉴定结果符合大肠杆菌特性。但样品中有少量菌株的硫化氢检测呈阳性,这似乎与其生化特性不符,根据之前也有大肠杆菌硫化氢试验呈阳性反应的报道[11],并结合镜检结果、DNA序列同源性比对等分析,仍可确认为大肠杆菌。
3.3 耐药性分析 该猪场被检21株菌均表现为多重耐药,以4耐(占57.14%)最为严重。其中对头孢曲松、头孢哌酮、恩诺沙星、环丙沙星无耐药性,建议临床治疗大肠杆菌病使用这些药物;对阿莫西林、青霉素表现为完全耐药,该猪场可以弃用;其余7种药物虽然能在一定程度上治疗大肠杆菌病,但某些菌株已产生耐药性,建议不再使用。在使用药物治疗该病时,建议交叉用药,切记避免持续使用同种药物,以免产生耐药性[12]。
不同地区的大肠杆菌耐药性存在一定的差异,且比较后发现各个地区的大肠杆菌对药物的耐药性都较为严重,因此不同猪场都应常年监测大肠杆菌耐药性,以便及时有效地控制和治疗该疾病。
3.4 血清型鉴定 所测的21个样品中,3号、48号猪只携带致病性血清,已将猪只无害化处理以免扩散。但需要强调的是,大肠杆菌为条件性致病菌,正常菌株在一定条件下也可衍变为致病性菌株。因此,日常养殖中一定要加强饲养管理,采取定期消毒、接种疫苗等方式预防和减少大肠杆菌病的发生和蔓延,确保猪场收益。
4 结论
本试验所分离菌株均为大肠杆菌,且多重耐药性明显,建议使用头孢曲松、头孢哌酮、恩诺沙星、环丙沙星治疗,用药过程中还应避免长时间使用同种药物。其中有两头猪携带大肠杆菌致病性血清,已进行无害化处理。
