冠突散囊菌和植物乳杆菌联合发酵对绿茶液态饮料品质的影响
2018-10-17涂政梅慧玲李欢刘馨秋EmmanuelArkorful张彩丽陈暄孙康黎星辉
涂政,梅慧玲,李欢,刘馨秋,Emmanuel Arkorful,张彩丽,陈暄,孙康,黎星辉*
冠突散囊菌和植物乳杆菌联合发酵对绿茶液态饮料品质的影响
涂政1,梅慧玲2,李欢1,刘馨秋1,Emmanuel Arkorful1,张彩丽1,陈暄1,孙康1,黎星辉1*
1. 南京农业大学茶叶科学研究所,江苏 南京 210095;2. 江苏省固体有机废弃物资源化高技术研究重点实验室,江苏 南京 210095
为了抑制冠突散囊菌发酵绿茶液态饮料中儿茶素的降解,本研究采用植物乳杆菌和冠突散囊菌对绿茶液态饮料进行联合发酵,试验通过响应面法优化了联合发酵绿茶液态饮料工艺,并采用高效液相色谱(HPLC)法和顶空固相微萃取串联气质联用(HS-SPME/GS-MS)法分别检测了联合发酵绿茶液态饮料中儿茶素含量和香气成分。结果表明,在干茶添加量10 g·L-1、冠突散囊菌添加量10 mL·L-1的前提下,联合发酵绿茶液态饮料的最佳工艺条件为植物乳杆菌添加量20 mL·L-1、蔗糖添加量75 g·L-1、30℃下静置发酵3 d。在此工艺下联合发酵绿茶液态饮料中总儿茶素含量为1 419.94 μg·mL-1,与冠突散囊菌发酵绿茶液态饮料(848.72 μg·mL-1)相比,显著增加(<0.05);且醇类化合物(30.27%)、醛类化合物(15.25%)、烃类化合物(11.35%)、酯类化合物(9.86%)和酮类化合物(9.01%)含量与未发酵绿茶液态饮料相比均显著增加(<0.05)。
植物乳杆菌;冠突散囊菌;香气成分;儿茶素;绿茶液态饮料
微生物发酵茶饮料是微生物以茶叶为底物,通过自身的生理代谢作用从而改善了茶叶的风味与品质[1]。微生物发酵茶饮料不仅能提供一个中低档茶叶的产品出路,而且还可满足现代人们对健康功能饮料的需求。冠突散囊菌俗称“金花菌”,它具有改善茶叶香气及增加茶叶降脂减肥功能等作用[2],也是茯砖茶菌花香气产生的主要因素。随着冠突散囊菌的生物活性和健康功能被不断发现[3-4],人们开始从茯砖茶中分离提取冠突散囊菌进行液态茶饮料发酵,进而缩短生产周期。研究发现经冠突散囊菌发酵后的茶饮料具有独特的滋味和香气[5],但是冠突散囊菌发酵使茶饮料中儿茶素含量大量减少[6]。儿茶素是一类天然的多酚类物质,最近几十年来,许多研究表明儿茶素是使茶叶具有降血压[7]、抗菌[8]、消炎[9]、抗氧化[10]和抗癌[11]等功效的主要物质,是茶叶中主要的功能物质。其中绿茶中含量最高,儿茶素也被认为是绿茶中最具活性的多酚物质[12]。有研究表明,乳酸菌能提高茶浸提液多酚物质的含量及品质[13]。此外,乳酸菌作为益生菌在发酵食品和饮料的生产中具有长期和安全的应用和消费历史,对改善食品风味和营养也有很大帮助。针对冠突散囊菌发酵生产绿茶饮料中儿茶素降解的关键技术问题,本试验采用冠突散囊菌和植物乳杆菌联合发酵方法生产绿茶液态饮料,利用响应面法优化该饮料工艺,并通过高效液相色谱(HPLC)法和顶空固相微萃取串联气质联用(HS-SPME/GS-MS)法分别检测该绿茶液态饮料中的儿茶素含量和香气成分,为机采夏秋茶在茶叶深加工开发利用方面提供科学依据。
1 材料与方法
1.1 材料
都匀毛尖秋茶,购自贵州都匀毛尖茶集团有限公司;植物乳杆菌(BNCC187897)购于北纳生物菌种保藏中心;冠突散囊菌(BNCC196246)购于北纳生物菌种保藏中心。
1.2 仪器与试剂
1.2.1 主要仪器
LC-20A高效液相色谱仪,日本岛津仪器有限公司;Bruker 32-MS气相色谱/质谱联用仪,德国bruker仪器有限公司;手动固相微萃取装置,美国Supelco科技有限公司,65 μm PDMS/DVB。
1.2.2 主要试剂
冰醋酸、甲醇、乙腈为色谱纯;表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、儿茶素、没食子儿茶素、儿茶素没食子酸酯、没食子儿茶素没食子酸酯标准品,皆为HPLC专用纯度,购于原叶生物试剂有限公司;MRS肉汤(南京寿德生物科技有限公司);PDA培养基(青岛爱迪生生物科技有限公司)。
1.3 试验方法
1.3.1 工艺流程及操作要点
茶汤浸提→过滤,加入蔗糖→分装,灭菌并急速冷却→加入植物乳杆菌和冠突散囊菌悬液→发酵→离心,取上清液→成品。
植物乳杆菌、冠突散囊菌种活化和菌悬液制备:取冠突散囊菌于PDA斜面培养基上活化2次后,倒入无菌水刮取斜面上的冠突散囊菌于带无菌玻璃球的锥形瓶中充分振荡至孢子分散均匀,再用灭菌的纱布过滤去菌液中的菌丝,并调节悬液的浓度至每毫升107个孢子,备用。
取植物乳杆菌于MRS肉汤中活化2次后,4 000 r·min-1离心10 min,去掉上清液,加入无菌水充分振荡使沉淀溶解均匀,并调植物乳杆菌的浓度至109CFU·mL-1,备用。
绿茶发酵原液的制备:取10 g·L-1都匀毛尖干茶于100℃水浴中浸提30 min,纱布过滤除去茶渣后,加入30~110 g·L-1蔗糖充分溶解,分装于100 mL锥形瓶中。采用巴氏灭菌法80℃热水浴灭菌15 min,并急速冷却至室温,获得绿茶发酵原液。
发酵:吸取10 mL·L-1冠突散囊菌[5]和10~40 mL·L-1植物乳杆菌悬液于绿茶发酵原液中,于30℃下恒温培养3~7 d,将发酵液于5 000 r·min-1下离心10 min,取上清液分装,得到绿茶液态饮料。
1.3.2 冠突散囊菌发酵绿茶液态饮料工艺优化单因素试验
分别选取植物乳杆菌添加量(0、10、20、30、40 mL·L-1)、发酵时间(1、3、5、7、9 d)、蔗糖添加量(30、50、70、90、110 g·L-1)进行单因素试验,以pH值和综合感官得分为评价标准,确定各因素对绿茶液态饮料风味的影响。
1.3.3 冠突散囊菌发酵绿茶液态饮料工艺优化响应面试验
在单因素试验的基础上以干茶添加量A、发酵时间B、蔗糖添加量C作为因素,依据Box-Benhnken中心组合实验设计原理,设计三因素三水平的响应面试验进一步优化绿茶液态饮料发酵工艺条件,试验因素水平见表1。
1.3.4 感官评定
请20位专业审评人员组成评分小组,分别从色泽、香气和滋味3个方面进行感官评分,以综合得分为响应值,评分标准见表2。
1.3.5 HS-SPME/GC-MS法检测绿茶液态饮料香气成分

表1 响应面试验因素水平表
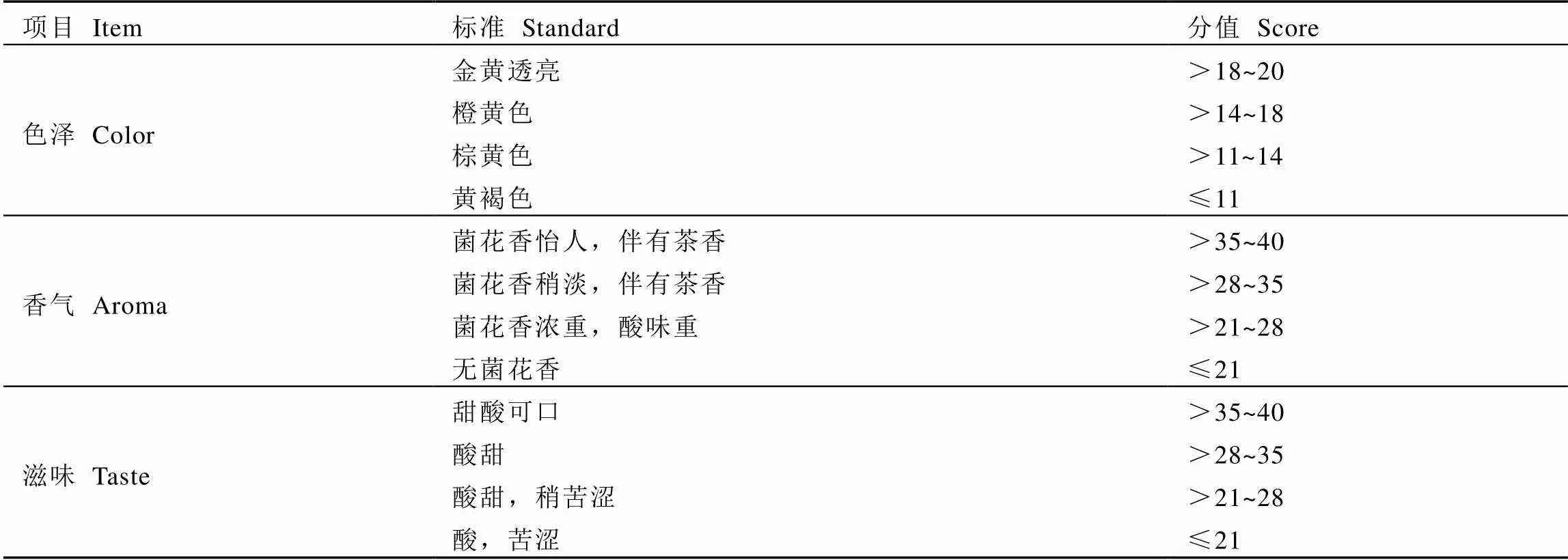
表2 感官评分标准[14]
香气成分提取:取12 mL冠突散囊菌和植物乳杆菌联合发酵绿茶饮料(M组),并以冠突散囊菌单独发酵绿茶液态饮料(C组)、植物乳杆菌单独发酵绿茶液态饮料(L组)和未发酵绿茶液态饮料(T组)作为对照,分别装入20 mL萃取瓶中,将手动固相微萃取装置插入萃取瓶的顶空部分,在磁力搅拌条件下于70℃吸附60 min,然后迅速插入GC/MS进样口,250℃解吸5 min。
香气成分检测:气相色谱条件:色谱柱:BR-5MS;进样口温度:250℃;检测器温度:250℃;载气:高纯氦气(纯度>99.999%);流速1 mL·min-1;升温程序:起始柱温50℃,保持3 min,以5℃·min-1升至180℃,保持2 min,以3℃·min-1升至210℃,保持3 min,再以10℃·min-1升至250 min,保持5 min;不分流进样。
质谱条件:转接口温度250℃;进样口温度250℃;离子源温度:230℃;电子能量70 eV;四极杆温度150℃;离子化方式EI;质量扫描范围为40~500 amu。
1.3.6 绿茶液态饮料中儿茶素含量检测
参照《GB/T 8313—2008茶叶中茶多酚和儿茶素类含量的检测方法》测定绿茶液态饮料儿茶素含量,并以冠突散囊菌单独发酵绿茶液态饮料、植物乳杆菌单独发酵绿茶液态饮料和未发酵绿茶液态饮料作为对照。
1.3.7 数据分析
响应面试验数据通过Design expert 8.0.6软件处理。GC-MS分析得到的质谱数据通过计算机在NIST标准谱库的检索及参照已发表的相关文献中香气成分[15-19],以峰面积归一化法算出各成分的相对含量,并通过SIMCA-P 13.0软件进行主成分分析。其他数据通过GraphPad Prism和Excel软件进行整合分析。
2 结果与分析
2.1 冠突散囊菌发酵绿茶液态饮料工艺优化单因素试验结果
2.1.1 植物乳杆菌添加量对绿茶液态饮料风味的影响
图1显示,植物乳杆菌添加量为0~20 mL·L-1时,随着植物乳杆菌接种量的增加,pH值呈现下降趋势,而综合感官得分逐渐升高,植物乳杆菌添加量为20 mL·L-1时,pH值为3.53,综合感官得分最高,为88.7分,饮料口感最佳。之后,随着植物乳杆菌的接种量的继续增加,pH值继续下降,综合感官得分也呈下降趋势。因此,选择植物乳杆菌添加量为20 mL·L-1。
2.1.2 发酵时间对绿茶液态饮料风味的影响
由图2可知,随着发酵时间的增加,pH呈逐渐降低的趋势。发酵时间在1~3 d时综合感官得分逐渐上升,在发酵第3天时达到最高分89.0分,pH值为3.64,随后逐渐下降。随着发酵时间的增加,茶饮料苦涩程度逐渐增高,口感变差,并且植物乳杆菌产酸量不断积累,一方面引起饮料口感过酸,影响滋味,另一方面酸气过重覆盖了菌花香,影响了香气构成。因此,发酵时间为3 d为最优条件。
2.1.3 蔗糖添加量对绿茶液态饮料风味的影响
蔗糖作为植物乳杆菌和冠突散囊菌发酵的主要碳源,其添加量会间接影响到茶饮料的品质。由图3可知,蔗糖添加量为30~70 g·L-1时,随着蔗糖添加量的增加,饮料pH值不断降低,当蔗糖添加量为7%时,蔗糖添加量达到饱和,pH变化开始呈平缓趋势,此时综合感官得分最高,为87.7分,之后随着蔗糖添加量继续增加,综合感官得分呈下降趣势。蔗糖添加过少时,冠突散囊菌生长缓慢,饮料菌花香气不足;蔗糖添加过多时,口感太过甜腻。因此,最佳蔗糖添加量为70 g·L-1。
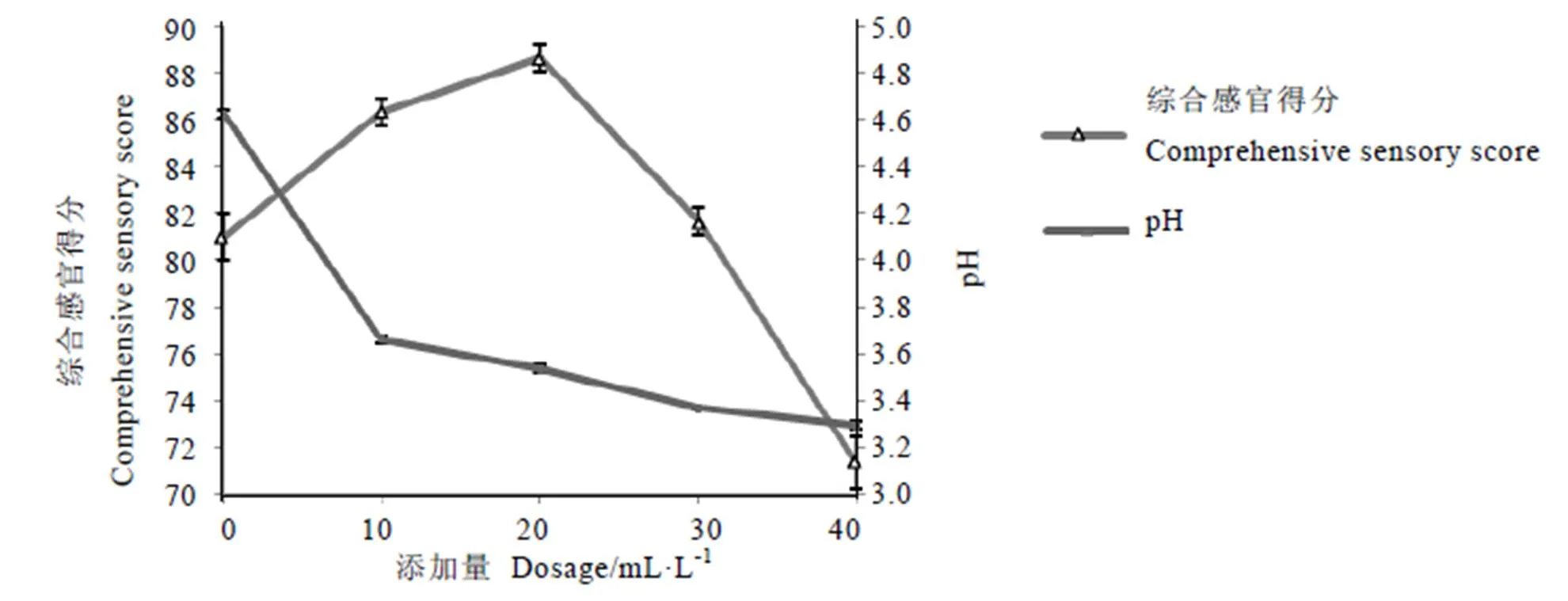
图1 植物乳杆菌添加量对发酵绿茶饮料口感的影响

图2 发酵时间对发酵绿茶饮料口感的影响

图3 蔗糖添加量对发酵绿茶饮料口感的影响
2.2 绿茶液态饮料发酵工艺优化响应面试验
以植物乳杆菌添加量A、发酵时间B、蔗糖添加量C作为因素,以综合感官得分(Y)为评定指标,在单因素试验的基础上,通过响应面法得到绿茶液态饮料工艺的Box-Behnken试验结果(表3)。利用Design expert 8.0.6软件对试验结果进行显著性和回归分析,得到二次多项回归方程模型:=92.26+1.90-2.67+1.22+1.63-0.68-0.075-5.742-7.842-3.342。
由表4回归模型的方差分析可知,该回归模型的效果达到极显著水平(<0.0001)。失拟项(=0.1709>0.05)不显著,表明预测值与实际测定值拟合效果较好,试验误差较小。模型复相关系数的平方2为0.9947,说明该方程回归效果较好。变异系数CV为0.8%,说明该模型置信度较高。因此该模型可以用于分析和预测绿茶液态饮料的综合感官评分。由表5对各项F值检验可知,植物乳杆菌添加量(A)、发酵时间(B)和蔗糖添加量(C)的一次项<0.01,对饮料的综合感官评分影响极显著,二次项A2、B2、C2也对饮料的综合感官评分的影响达到极显著水平(<0.01);由图1可以直观反映出任意两个交互项之间对响应值的影响,响应面坡度大表明因素对响应值的影响大,等高线呈椭圆形表示因素之间的交互作用显著,而坡度缓、等高线呈圆形则相反。由图4可知,植物乳杆菌添加量和发酵时间的交互作用对综合感官得分有显著影响,而植物乳杆菌添加量和蔗糖添加量、发酵时间和蔗糖添加量的交互作用试验结果无显著影响。模型的相关系数2=0.9947,表明植物乳杆菌添加量、发酵时间和蔗糖添加量之间呈显著相关性,模型调整系数2Adj=0.9878,表明该模型能解释98.78%的绿茶液态饮料的综合感官评分变化,表明试验可靠程度较高。
经分析,得出发酵绿茶饮料的最佳优化条件为:植物乳杆菌添加量21.3 mL·L-1、发酵时间2.68 d、蔗糖添加量73.4 g·L-1。在此条件下得到的液态饮料感官品质最佳,综合感官得分为92.7分。考虑到实际操作及生产的便利,最终确定发酵绿茶液态饮料的最佳工艺条件为:植物乳杆菌添加量20 mL·L-1、发酵时间3 d、蔗糖添加量75 g·L-1。经3组平行试验验证,在此最优条件下发酵的绿饮液态料综合感官得分为92.5分,相对误差为0.2%,证明该模型可用于实际生产中进行预测。
2.3 发酵绿茶液态饮料香气成分检测
如图5所示,T、L、C、M 4组样品在保留时间上具有高度相似性,而峰值丰度不同。共测定出了60种主要香气化合物。利用相对保留值与每个样品中保留时间和色谱峰的质谱回收结果,确认52种为共同香气化合物。
T、L、C、M 4个组的香气化合物以总峰面积的百分比表示,比较结果如表5所示。所有样品中GC-MS鉴定的香气成分涵盖了7类有机化合物,这些化合物包括醇类、烃类、酯类、醛类、酮类和含氮化合物等。在M组中主要芳香成分为醇类化合物(30.27%)、烃类化合物(15.25%)、醛类化合物(11.35%)、酯类化合物(9.86%)和酮类化合物(9.01%),与未经发酵的绿茶饮料T组相比,M组中醇类化合物、醛类化合物、烃类化合物、酯类化合物和酮类化合物含量均显著增加(<0.05),说明绿茶液态饮料香气成分在微生物的作用下经历了复杂的转化。在乳酸菌单独发酵的L组中除了酯类化合物含量显著增高外,醇类、烃类、醛类和酮类化合物的含量都显著低于T组(<0.05),而冠突散囊菌单独发酵的C组各类香气化合物均显著高于T组(<0.05),说明在发酵过程中,冠突散囊菌有益于绿茶液态饮料香气成分的提高。

表3 响应面方案设计及结果

表4 回归模型方差分析
注:2=0.9947;2Adj=0.9878;CV=0.8%;*代表<0.05,表示有显著影响;**代表<0.01,表示有极显著影响。
Note:2=0.9947.2Adj=0.9878. CV=0.8%. *means significant difference,<0.05. ** means extremely significant difference,<0.01.

图4 两因素交互对综合感官得分影响的响应面图
绿茶液态饮料中所含的醇类有12种,包括芳樟醇及其氧化物、青叶醇、香叶醇和植醇等,这些化合物具有典型的花香和甜味,经冠突散囊菌发酵后,这些醇类物质含量显著增加(<0.05),是构成绿茶液态饮料花香和甜香的重要因子。饱和碳氢化合物对饮料风味影响不大,而不饱和碳氢化合物在香气中起着非常重要的作用[20],在所有样品检测到的碳氢化合物中,共检测到6种不饱和碳氢化合物,其中M组和C组柠檬烯、月桂烯和-荜澄茄油烯含量都显著提高(<0.05)。在发现的7种酯类化合物中,苯乙酸甲酯和具有冬青油草香味的水杨酸甲酯在M组和C组中显著减少(<0.05),邻苯二甲酸二丁酯变化不明显,其他酯类化合物含量都显著提高(<0.05)。绿茶饮料共检测出7种酮类化合物,其中6-甲基-3,5-庚二烯-2-酮,3-戊烯-2-酮和香叶基丙酮等经冠突散囊菌发酵后才检测出的化合物对饮料独特菌花香的形成具有重大贡献。醛类物质中除苯乙醛和壬醛两种物质经冠突散囊菌和植物乳杆菌发酵后均显著减少(<0.05),但该类物质总量却显著增加(<0.05),这也是构成发酵前后香气差异的重要原因。

注:T:未发酵绿茶液态饮料;L:植物乳杆菌发酵绿茶液态饮料;C:冠突散囊菌发酵绿茶液态饮料;M:植物乳杆菌和冠突散囊菌联合发酵绿茶液态饮料。下图同。
主成分分析可将多个变量线性变换成一个低维空间,保留有关变量的最大信息量,可以更直观地比较色谱图。因此,被检测的样品所有香气化合物的相对含量被用于主成分分析(图6),第一主成分和第二主成分共同占总方差的75.4%。由图可知,未经冠突散囊菌发酵的T、L组和经冠突散囊菌发酵后的M、C组绿茶液态饮料之间香气成分差异明显,表明冠突散囊菌发酵对绿茶液态饮料香气物质变化起主导作用。另外,T组与L组之间、M组与C组之间差异较小,说明植物乳杆菌发酵对绿茶液态饮料香气影响较小。
2.4 发酵绿茶液态饮料儿茶素含量检测
由图7可知,最优发酵工艺下C组总儿茶素含量(848.72 μg·mL-1)比T组(1 467.36 μg·mL-1)显著降低(<0.05),减少了42.16%;L组(1 519.47 μg·mL-1)与M组(1 419.94 μg·mL-1)相比,变化不显著;M组总儿茶素含量相对于C组显著增高(<0.05),增加了67.30%;其中在非酯型儿茶素含量上(图7-B),T组为433.79 μg·mL-1,M组(483.27 μg·mL-1)和C组(714.22 μg·mL-1)均显著增高(<0.05),分别增加了11.15%和64.26%;L组(370.56 μg·mL-1)显著降低(<0.05),减少了14.77%;在酯型儿茶素含量上(图7-C)T组为1 033.8 μg·mL-1,M组(936.67 μg·mL-1)、C组(134.50 μg·mL-1)显著降低(<0.05),分别减少了9.29%和86.97%,L组(1 148.91 μg·mL-1)显著增多(<0.05),增加了9.08%,且相对于C组,M组显著增加了596.41%(<0.05)。结果表明,冠突散囊菌发酵会使绿茶浸提液中的儿茶素大量减少,而添加植物乳杆菌后能有效减缓儿茶素的降解,证明在该工艺下获得的绿茶液态饮料儿茶素含量能得到较好的保持。在发酵过程中,冠突散囊菌能产生水解酶水解酯型儿茶素形成非酯型儿茶素和没食子酸[21],使得发酵液中酯型儿茶素含量减少,非酯型儿茶素增多,总儿茶素含量减少;有研究推测酯型儿茶素可能由非酯型儿茶素没食子酯化得到[22],因此,植物乳杆菌发酵产生的酸性条件有助于非酯型儿茶素酯化反应的进行,导致发酵液酯型儿茶素增多,非酯型儿茶素减少,总儿茶素变化不显著。儿茶素是茶叶中重要的功能性成分,是茶叶中抗氧化的主要生物活性物质[23]。儿茶素含量的保持对绿茶饮料的保健功能有重大贡献。
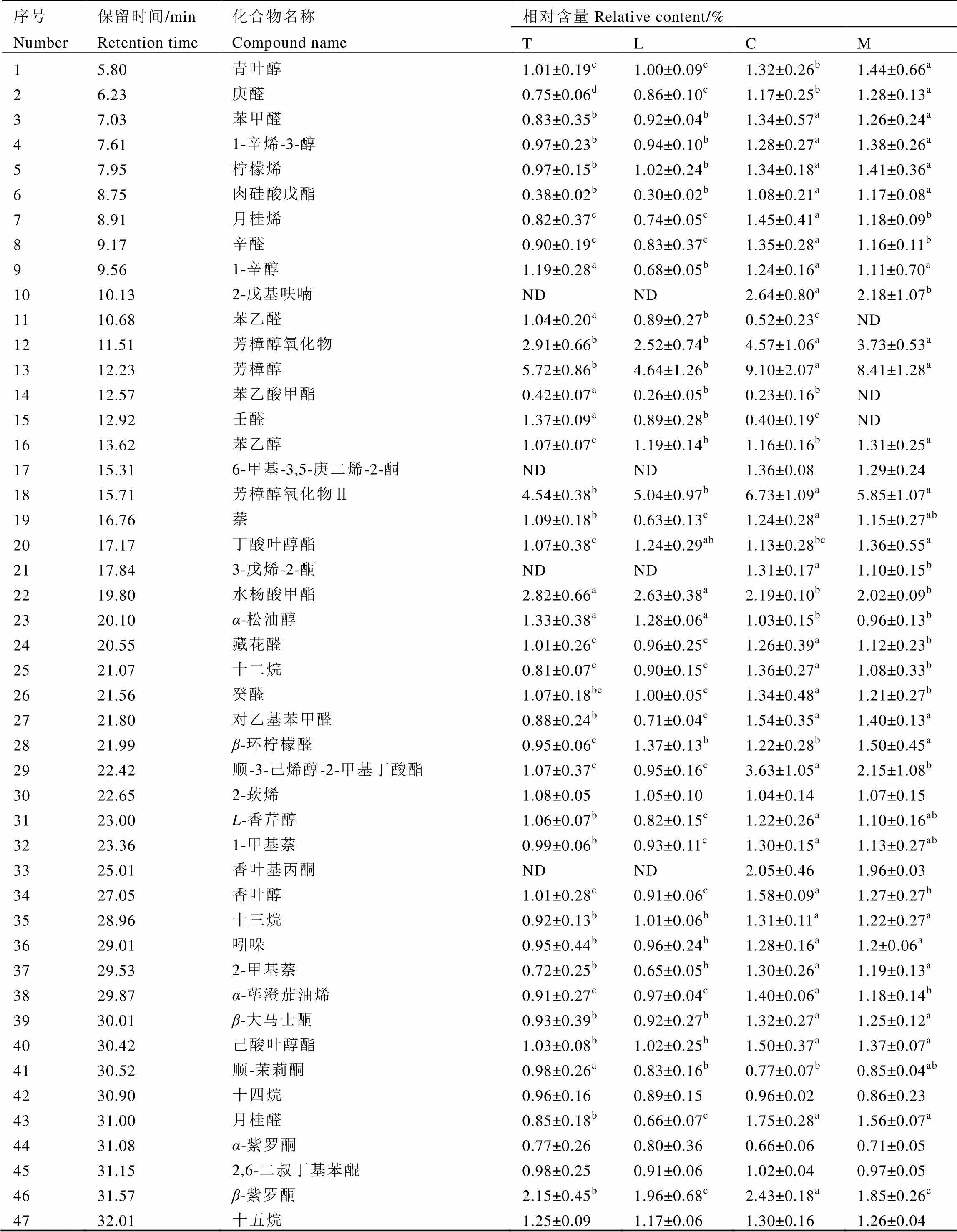
表5 绿茶液态饮料香气结果分析
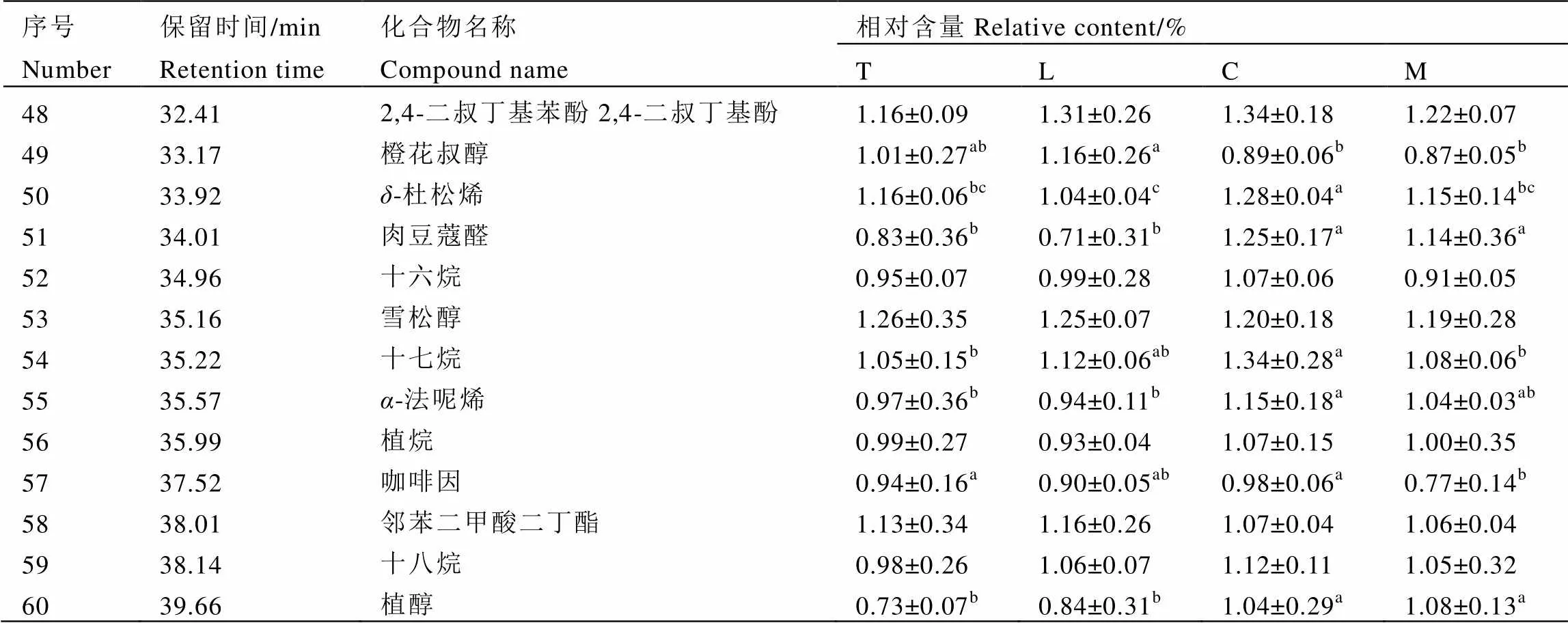
续表5
注:T:未发酵绿茶液态饮料;L:植物乳杆菌发酵绿茶液态饮料;C:冠突散囊菌发酵绿茶液态饮料;M:植物乳杆菌和冠突散囊菌联合发酵绿茶液态饮料;ND:物质未检测出或相对含量低于0.1%;同一行不同字母表示差异显著,<0.05。
Note: T: unfermented green tea liquid beverage. L:fermented green tea liquid beverage. C:fermented green tea liquid beverage. M:andco-fermented green tea liquid beverage. ND: substance not detected or relative content below 0.1%. Different letters on the same line indicate significant differences,<0.05.

注:字母后数字代表各个重复。Note: Numbers after letters represent each repetition.

注:不同字母表示差异显著,P<0.05。Note: Different letters indicate significant differences, P<0.05.
3 结论与讨论
本研究通过单因素试验和响应面法建立了植物乳杆菌对冠突散囊菌发酵绿茶液态饮料的优化条件:在干茶添加量1 g·L-1、冠突散囊菌添加量10 mL·L-1的前提下,植物乳杆菌添加量20 mL·L-1、蔗糖添加量75 g·L-1、30℃下静置发酵3 d。在此工艺下获得的绿茶液态饮料在感官审评上色泽金黄透亮,菌花香气怡人,滋味甜酸可口。
本研究表明,植物乳杆菌添加后能保留冠突散囊菌发酵绿茶液态饮料的菌花香气,经检测其醇类化合物、醛类化合物、烃类化合物、酯类化合物和酮类化合物等主要香气成分含量较发酵前均显著增加(<0.05),接近于冠突散囊菌发酵绿茶液态饮料。植物乳杆菌能有效防止冠突散囊菌发酵绿茶液态饮料中儿茶素的大量减少,其原因可能有以下两点:第一,儿茶素为黄烷醇类化合物,乳酸菌可以保护黄烷醇类化合物免于化学降解,有效提高茶浸提液的抗氧化能力[13];第二,冠突散囊菌生长的最适pH为4.0~6.0[24],可能由于植物乳杆菌添加后随着发酵的进行产生了大量的酸性物质导致后期发酵液中酸度偏高,一定程度上抑制了冠突散囊菌的正常生长,进而减少了冠突散囊菌产生相关酯型儿茶素水解酶,因此减缓了酯型儿茶素被降解成非酯型儿茶素和没食子酸的速率。对于植物乳杆菌抑制冠突散囊菌发酵绿茶液态饮料中儿茶素降解的作用机制还有待进一步研究。
[1] 邹礼根, 丁玉庭, 陈艳. 微生物在发酵茶饮料中的应用[J]. 食品工业科技, 2004(1): 23-24.
[2] Fu D, Ryan E P, Huang J, et al. Fermented, Fuzhuan tea, regulates hyperlipidemia and transcription factors involved in lipid catabolism [J]. Food Research International, 2011, 44(9): 2999-3005.
[3] Ling T J, Wan X C, Ling W W, et al. New triterpenoids and other constituents from a special microbial-fermented tea-Fuzhuan brick tea [J]. Journal of Agricultural & Food Chemistry, 2010, 58(8): 4945-4950.
[4] Xu A, Wang Y, Wen J, et al. Fungal community associated with fermentation and storage of Fuzhuan brick-tea [J]. International Journal of Food Microbiology, 2011, 146(1): 14-22.
[5] 田鸿, 齐桂年, 尹旭敏. 冠突散囊菌发酵型茶饮料的研究[J]. 食品与发酵工业, 2008, 34(1): 164-167.
[6] 黄秋桂, 张灵枝, 龚雪梅, 等. 黑茶优势菌对绿茶浸提液发酵过程多酚类化合物的影响[J]. 食品科学, 2014, 35(11): 164-167.
[7] Melgarejo E, Medina M Á, Sánchez-Jiménez F, et al. Targeting of histamine producing cells by EGCG: a green dart against inflammation? [J]. Journal of Physiology and Biochemistry, 2010, 66(3): 265-270.
[8] Fathima A, Rao J R. Selective toxicity of catechin—a natural flavonoid towards bacteria [J]. Applied Microbiology and Biotechnology, 2016, 100(14): 6395-6402.
[9] Sánchez-Fidalgo S, Da S M, Cárdeno A, et al. Abaremacochliacarpos reduces LPS-induced inflammatory response in murine peritoneal macrophages regulating ROS-MAPK signal pathway [J]. Journal of Ethnopharmacology, 2013, 149(1): 140-147.
[10] Akiyama S, Nesumi A, Maeda-Yamamoto M, et al. Effects of anthocyanin-rich tea "Sunrouge" on dextran sodium sulfate-induced colitis in mice [J]. Biofactors, 2012, 38(3): 226-233.
[11] Guan F, Liu A B, Li G, et al. Deleterious effects of high concentrations of (-)-epigallocatechin-3-gallate and atorvastatin in mice with colon inflammation [J]. Nutrition & Cancer-an International Journal, 2012, 64(6): 847-855.
[12]Biasi F, Astegiano M, Maina M, et al. Polyphenol supplementation as a complementary medicinal approach to treating inflammatory bowel disease [J]. Current Medicinal Chemistry, 2011, 18(31): 4851-4865.
[13] Zhao D, Shah N P. Lactic acid bacterial fermentation modified phenolic composition in tea extracts and enhanced their antioxidant activity and cellular uptake of phenolic compounds following, digestion [J]. Journal of Functional Foods, 2016, 20: 182-194.
[14] 刘佳奇, 熊涛, 李军波, 等. 乳酸菌发酵茶饮料的工艺优化及其发酵前后香气成分分析[J]. 食品与发酵工业, 2016, 42(8): 109-114.
[15] Tontul I, Torun M, Dincer C, et al. Comparative study on volatile compounds in Turkish green tea powder: Impact of tea clone, shading level and shooting period [J]. Food Research International, 2013, 53(2): 744-750.
[16] Lee J. Green tea: Flavor characteristics of a wide range of teas including brewing, processing, and storage variations and consumer acceptance of teas in three countries [D]. Manhattan Kansas: Kansas State University, 2009.
[17] Wang LF, Lee JY, Chung JO, et al. Discrimination of teas with different degrees of fermentation by SPME-GC analysis of the characteristic volatile flavourcompounds [J]. Food Chem, 2008, 109(1): 196-206.
[18] Qin P, Ma T, Wu L, et al. Identification of tartary buckwheat tea aroma compounds with gas chromatography-mass spectrometry [J]. Journal of Food Science, 2011, 76(6): S401-S407.
[19] Lv S D, Wu Y S, Zhou J S, et al. Analysis of aroma components of dark teas from five different production regions by fully automatic headspace solid-phase microextraction coupled with gas chromatography-mass spectrometry [J]. Journal of Chemical & Pharmaceutical Research, 2014, 6(1): 246-253.
[20] Anselmi C, Centini M, Fedeli P, et al. Unsaturated hydrocarbons with fruity and floral odors [J]. Journal of Agricultural & Food Chemistry, 2000, 48(4): 1285-1289.
[21] Zhong K, Zhao S Y,Jönsson Leif J, et al. Enzymatic conversion of epigallocatechin gallate to epigallocatechin with an inducible hydrolase from Aspergillus niger [J]. Biocatalysis, 2009, 26(4): 306-312.
[22] Liu Y, Gao L, Liu L, et al. Purification and characterization of a novel galloyltransferase involved in catechin galloylation in the tea plant () [J]. Journal of Biological Chemistry, 2011, 287(53): 44406-44417.
[23] 王苗苗, 韩杰, 娄海燕. 表没食子儿茶素没食子酸酯对心脑血管缺血再灌注损伤保护作用机制的研究进展[J]. 中草药, 2014, 45(18): 2732-2736.
[24] 黄群, 李彦坡, 陈林杰, 等. 冠突散囊菌液态发酵过程中黑茶活性成分变化研究[J]. 食品科学, 2007, 28(12): 231-234.
Effects of Co-fermentation byandon the Quality of Green Tea Liquid Beverage
TU Zheng1, MEI Huiling2, LI Huan1, LIU Xinqiu1, Emmanuel Arkorful1, ZHANG Caili1, CHEN Xuan1, SUN Kang1, LI Xinghui1*
1. Tea Research Institute, Nanjing Agricultural University, Nanjing 210095, China; 2. Jiangsu Key Laboratory of Solid Organic Waste Utilization, Nanjing 210095, China
In order to inhibit the degradation of catechins in fermented green tea liquid beverage fermented by, the co-fermentation ofandto green tea liquid beverage was conducted. The processing technology was optimized by response surface methodology. Besides, high performance liquid chromatography (HPLC) and headspace solid-phase microextraction tandem mass spectrometry (HS-SPME/GS-MS) method were used to detect the catechin contents and aroma components in the combined fermented green tea liquid beverage. The results showed that under the premise of 10 g·L-1of dry tea and 10 mL·L-1of, the optimal technological conditions for the combined fermentation of green tea liquid beverage were20 mL·L-1, sucrose 75 g·L-1, and stationary fermentation at 30℃ for 3 days. The total catechin concentration in the joint fermented green tea liquid beverage under this process was 1 419.94 μg·mL-1, which was significantly higher than unfermented green tea liquid beverage (848.72 μg·mL-1) (<0.05). And the contents of alcohol compounds (30.27%), aldehyde compounds (15.25%), hydrocarbon compounds (11.35%), ester compounds (9.86%) and ketone compounds (9.01%) were significantly increased (<0.05) compared with unfermented green tea liquid beverage.
,, aroma component, catechin, green tea liquid beverage
TS275.2
A
1000-369X(2018)05-496-12
2018-02-26
2018-04-02
现代农业产业技术体系建设专项资金(CARS-19)、江苏高校优势学科建设工程资助项目
涂政,男,硕士研究生,主要从事茶树资源综合利用研究。
lxh@njau.edu.cn
