粉唑醇在小麦田中的残留及消解动态
2018-10-17刘一平曹海佳钟玉琪李治军廖晓兰
仇 磊,刘一平,刘 青,曹海佳,钟玉琪,李治军,李 涛,廖晓兰*
(1.湖南农业大学植物保护学院,湖南长沙410128;2.湖南化工研究院,湖南长沙400014)
粉唑醇,英文名为 flutriafol,化学名称α-(2-氟苯基)-α-(4-氟苯基)-1H-1,2,4-三唑-1-乙醇,结构式 (图1),是一种具有广谱性的三唑类杀菌剂,在植物体内可自下而上进行传导[1],粉唑醇通过抑制麦角甾醇的生物合成引起真菌细胞壁破裂和菌丝的生长,具有铲除、保护、触杀和内吸活性,对真菌和卵菌引起的植物病害具有良好的保护和治疗效果[2],在防治小麦、大麦、玉米、水稻等禾谷类作物的茎叶及穗部病害和水果的叶部病害上具有卓越的表现,如小麦条锈病[3]、白粉病[4]、赤霉病[5]; 水稻稻瘟病[6]; 草莓白粉病[7]等。
目前已有相关国家和地区制定了粉唑醇在小麦上的最大残留限量 (MRL),日本为0.5 mg/kg[8-9],CAC 和 欧 盟 为 0.15 mg/kg[10-11],中国为0.5 mg/kg[12]。粉唑醇在农作物上的残留已有相关报道,研究对象包括水稻[13]、草莓[14]、烟草[15]、小麦[16]等,其残留分析方法主要有气相色谱法[17]、液相色谱法[18]、液相色谱-串联质谱法[19]等。综合上述方法普遍存在样品前处理过程繁琐、仪器设备要求高等不足。本研究于2016~2017年在北京、湖南、江苏进行2年3地的农药残留田间试验,拟采用优化的粉唑醇残留检测方法,通过乙腈提取、分散固相萃取进行前处理,结合气相色谱-质谱法(GC-MS)法对粉唑醇在小麦田中的残留量进行测定,并对其残留降解动态和最终残留进行研究,其结果将为制定粉唑醇在小麦上的合理使用准则以及安全性评价提供了重要的科学依据。
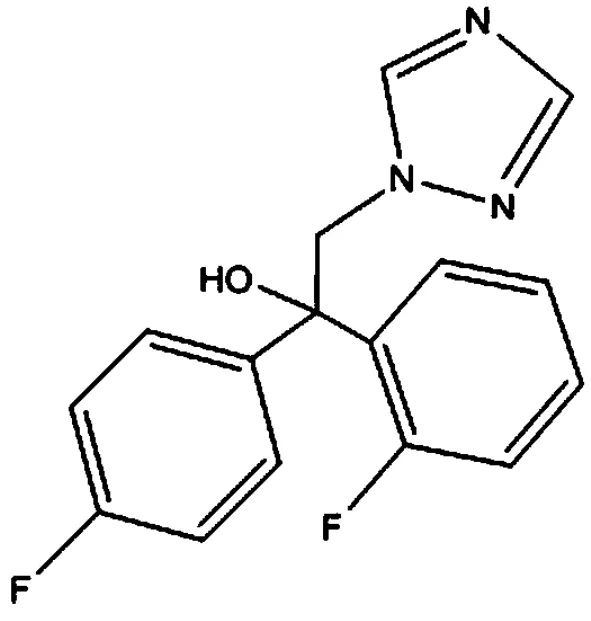
图1 粉唑醇化学结构式
1 材料与方法
1.1 试剂与仪器
1.1.1 药剂及试剂 粉唑醇标准品:95.0%,农业部天津环保科研监测所;250 g/L粉唑醇悬浮剂。
乙腈、无水硫酸镁、氯化钠 (均为分析纯,上海国药集团化学试剂有限公司);PSA(天津博纳艾杰尔科技有限公司);去离子水 (Milli-Q过滤)。
1.1.2 仪器设备 气相色谱-质谱联用仪 (安捷伦科技有限公司),色谱柱:熔融石英毛细管柱 HP-5MS(30m ×0.25mm i.d.×0.25μm)(安捷伦科技有限公司),微型植物粉碎机 (天津泰斯特仪器有限公司),H2050R-1型高速冷冻离心机 (长沙湘仪离心机仪器有限公司),Milli-Q水纯化系统 (北京博雅创新科技发展有限公司),HZQ-C型空气浴振荡器 (哈尔滨东联电子技术开发有限公司),CPA225D型电子天平 (德国赛多利斯股份公司),XW-80A型旋涡混合器 (上海精科实业有限公司)。
1.2 田间试验设计 于2016年和2017年分别在北京、湖南、江苏开展2年3地的田间试验。试验小区根据《农药残留试验准则》[20]的具体要求进行设置,每小区30m2,各小区随机排列,小区间设置保护带,每个处理重复3次,另设空白对照处理。于小麦齐穗期 (参照 BBCH Monograph[21]对应的图谱) 进行喷雾施药。
1.2.1 消解动态试验 施药剂量为720 g.a.i/ha(推荐最高使用剂量的2倍),处理重复3次,处理间设保护隔离区,另设清水空白对照,于施药后2 h、1、2、3、5、7、14、21 d分别采集植株和土壤。植株取样在小区内用随机方式多点采集生长正常、无病害的小麦植株≥2 kg,土壤取样时取土深度为0~10 cm,采样点≥8个,采样量≥2 kg。
1.2.2 最终残留试验 设高、低2个施药剂量,高剂量按720 g.a.i/ha施药,低剂量按360 g.a.i/ha施药,每个剂量均设2次和3次施药2个处理,每个处理3次重复,施药间隔期为10 d,距最后1次施药30、45 d时分别采集植株、麦穗和土壤样本。植株及麦穗取样在小区内用随机方式多点采集生长正常、无病害的植株和麦穗≥2 kg,土壤取样时取土深度为0~10 cm,采样点≥8个,采样量≥2 kg。
1.3 样品制备 植株:植株剪成1 cm以下的小段,充分混匀后,用四分法缩分,取150g 2份,分别装于封口袋中编号;麦粒、麦壳:麦穗脱粒处理后去壳,麦粒和麦壳分别用磨碎机磨碎,分别混匀,用四分法缩分,取磨碎后的麦粒和麦壳各2份,每份150 g,分别装于封口袋中编号;土壤:去除土壤中的杂草、杂物和碎石后,将土壤充分混匀取2份,每份200 g,分别装于封口袋中,标记后贴好标签;将上述制备的实验室样品分类包装并标记后,贴好标签,-18℃保存。
1.4 分析方法
1.4.1 提取
1.4.1.1 土壤 准确称取10 g土壤样品,于50 mL具塞离心管中,加入3 mL水摇匀静置,加入乙腈10 mL,振摇30 s后涡旋提取1 min,然后分别加入4 g无水硫酸镁 (MgSO4)和1 g氯化钠(NaCl),称量均应精确至0.1 g,完成上述步骤后立即进行剧烈振摇,10 s后置于冰水浴中冷却处理1~2 min,涡旋1 min后以3 800 r/min离心5 min。
1.4.1.2 植株 准确称取5 g植株样品,于50 mL具塞离心管中,加入3 mL水摇匀静置,加乙腈5 mL,振摇30 s后于振荡器中振荡1 h,然后分别加入4 g无水硫酸镁 (MgSO4)和1 g氯化钠(NaCl),称量均应精确至0.1 g,完成上述步骤后立即进行剧烈振摇,10 s后置于冰水浴中冷却处理1~2 min,涡旋1 min后以3 800 r/min离心5 min。
1.4.1.3 麦粒和麦壳 准确称取4 g麦粒或小麦壳样品,于50 mL具塞离心管中,加入3 mL水摇匀静置,加乙腈5 mL(小麦壳中加乙腈10 mL),振摇30 s后涡旋提取1 min,然后分别加入4 g无水硫酸镁 (MgSO4)和1 g氯化钠(NaCl),称量均应精确至0.1 g,完成上述步骤后立即进行剧烈振摇,10 s后置于冰水浴中冷却处理1~2 min,涡旋1 min后以3 800 r/min离心5 min。
1.4.2 净化 取1 mL上述离心后的上清液转入装有20 mg PSA,150 mg无水MgSO4的2 mL微量离心管中,振荡20 s后涡旋1 min,以6 000 r/min离心2 min,上清液过0.22 μm有机系滤膜于自动进样瓶中,待测。
1.4.3 仪器检测条件
1.4.3.1 气相色谱条件 载气为纯度≥99.999%的氦气;恒流模式,流速为1.2 mL/min;采用不分流进样,0.8 min之后打开分流阀,进样量1 μL,进样口温度为250℃;柱温箱升温程序:初始温度80℃,保持1 min,以25℃/min速率升温至290℃,保持10 min。
1.4.3.2 质谱条件 色谱-质谱接口温度为280℃;离子源温度为230℃;四级杆温度为150℃;采用电子轰击电离源 (EI),电子能量为70 eV;全扫描模式 (SCAN),扫描质量范围50~300,选择离子监测模式 (SIM),粉唑醇的定性离子对 (m/z)为:219/164和219/123,定量离子对为:219/123。
1.4.4 标准曲线与添加回收率
1.4.4.1 标准曲线 用乙腈将粉唑醇标准品配制成100 mg/L的标准储备液,准确移取适量标准储备液进行梯度稀释,配制成0.01、0.05、0.25、0.5、1 mg/L系列的标准溶液。
在上述气相色谱-质谱条件下测定粉唑醇的标准溶液,以标准溶液的质量浓度与对应的峰面积作标准曲线。1.4.4.2 添加回收率 在空白土壤、植株、麦粒、麦壳样品中进行粉唑醇的添加回收率实验,添加浓度依次为0.05、0.5、1 mg/kg,每个浓度5次重复,另设空白对照。按上述方法及仪器条件进行样品前处理和分析测定,根据峰面积及添加浓度计算粉唑醇在各基质中的添加回收率及其相对标准偏差。
2 结果与分析
2.1 标准曲线和灵敏度 在上述检测条件下对粉唑醇标准溶液进行测定,以添加浓度 (mg/L)为横坐标,测得的相应峰面积为纵坐标,制作粉唑醇的标准曲线图,得到粉唑醇的标准曲线方程为 y=317 637x-2 088.5,相关系数(R2)为0.999 2,结果表明粉唑醇在0.01~1.00 mg/kg的质量浓度范围内其色谱峰面积与质量浓度呈良好的线性关系,该仪器条件下粉唑醇的最小检出量 (LOD)为1.0×10-11g,通过添加回收试验测定各基质中粉唑醇的最低检测浓度 (LOQ)均为0.05 mg/kg。
2.2 回收率和精密度 在空白土壤、植株、麦粒及麦壳基质中分别添加粉唑醇的标准工作溶液,添加水平为0.05~1 mg/kg,添加回收率试验结果 (表1),结果表明:植株中的添加回收率为84.3% ~93.7%,RSD为6.9% ~9.3%;籽粒中的添加回收率为77.6%~95.6%,RSD为4.4%~12.2%;粉唑醇在小麦壳中的添加回收率为84.8% ~88.8%,RSD为7.7% ~10.9%;粉唑醇在土壤中的添加回收率和RSD分别为77.7%~95.5%和4.5%~12.2%。回收率和精密度符合农药残留试验准则的相关要求,相关色谱图 (图2)。

图2 粉唑醇在土壤、植株、麦粒和麦壳中的色谱图
2.3 消解动态试验 采用250 g/L的粉唑醇悬浮剂在小麦齐穗期进行喷雾施药,施药剂量为推荐最高使用剂量的2倍720 g.a.i/ha。结果表明:粉唑醇在土壤和小麦植株中的消解动态均符合一级动力学方程,消解动态方程及相关参数 (表2)。粉唑醇在土壤和小麦植株中的原始沉积量分别为0.43~1.53 mg/kg,5.22~9.21 mg/kg,施药后14 d粉唑醇在土壤中的消解率达85%以上,在植株中的消解率达90%以上,粉唑醇在土壤中消解半衰期为1.8~7.4 d,在植株中消解半衰期为3.2~5.1 d。
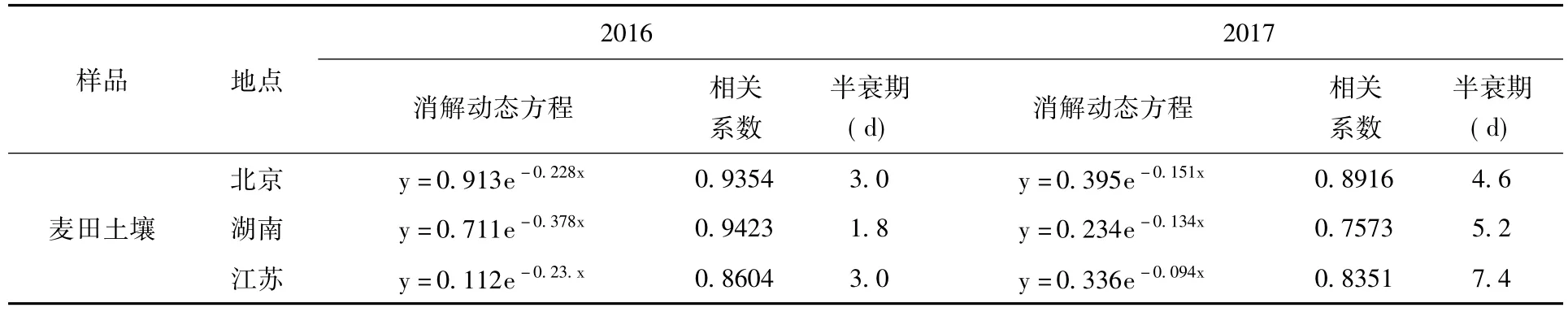
表2 粉唑醇在麦田土壤和小麦植株中的消解动力学参数
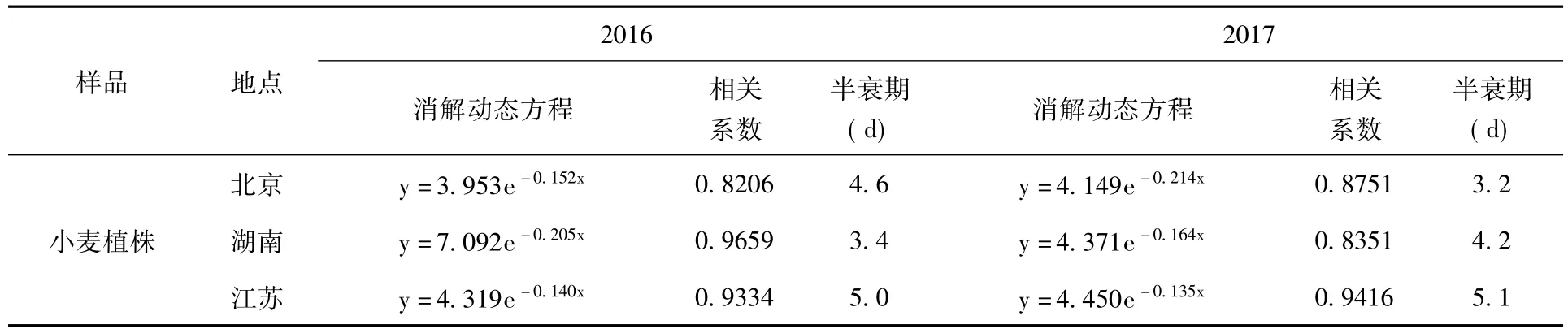
(续)
2.4 最终残留试验 最终残留试验结果表明:以360 g.a.i/ha和720 g.a.i/ha的剂量分别对土壤及小麦施用200 g/L的粉唑醇悬浮剂,每个剂量各施药2次和3次,施药间隔期为10 d,距最后1次施药后30、45 d时采集小麦和土壤样本进行分析,粉唑醇在植株中最终残留量在<LOQ~1.31 mg/kg之间,在麦粒中最终残留量在<LOQ~0.28 mg/kg之间,在麦壳中最终残留量在<LOQ~1.07 mg/kg之间,在土壤中的残留量在<LOQ~1.13 mg/kg之间,上述麦田各基质中粉唑醇的最终残留量的大小依次为:小麦植株>麦田土壤>小麦壳>麦粒;总体上随着采收间隔期的延长以及用药施次数的减少,粉唑醇在麦田各基质中的残留量逐渐减小。距最后1次施药30 d,粉唑醇在麦粒中的最终残留量最大值为0.28 mg/kg,距最后1次施药45 d时粉唑醇在麦粒中最终残留量最大值为0.18 mg/kg,均低于我国制订的粉唑醇在小麦中的最大残留限量值0.5 mg/kg。
3 结论与讨论
本文建立了气相色谱-质谱法测定粉唑醇在土壤、小麦植株、麦粒及麦壳中残留量的检测方法,该方法简单、便捷,灵敏度较高,粉唑醇的平均回收率在77.6% ~95.5%之间,RSD为4.4%~12.2%,符合农药残留分析的要求。粉唑醇在土壤中的中消解半衰期为1.8~7.4 d,在小麦植株中的消解半衰期为3.2~5.1 d,可见,粉唑醇属易降解农药[22];根据最终残留试验结果,距最后1次施药间隔30~45 d,麦粒样本中粉唑醇的最终残留量最大值为0.28 mg/kg,低于我国制定的粉唑醇在小麦中的最大残留限量 (MRL)0.5 mg/kg,因此,建议使用250 g/L的粉唑醇悬浮剂防治小麦条锈病,以360 g.a.i/ha的施药剂量,于小麦齐穗期喷雾施药2~3次,施药间隔期为10 d,推荐安全间隔期为45 d,可保证小麦的质量安全。
