CT诊断常见卵巢良恶性病变的准确度
2018-10-17贾镕泽于德新
董 帅 ,贾镕泽 ,王 青 ,于德新 ,王 芳
(1.山东省肿瘤医院影像科,山东 济南 250117;2.山东中医药大学附属医院,山东 济南 250011;3.山东大学齐鲁医院放射科,山东 济南 250012)
卵巢肿瘤根据来源分为上皮性肿瘤、生殖细胞肿瘤、性索间质肿瘤和转移瘤。卵巢癌占妇科恶性肿瘤的 23%[1],居妇科恶性肿瘤的第 3 位[2],居女性恶性肿瘤死亡原因的第5位[3]。由于症状隐匿,初诊时,2/3的卵巢癌为Ⅲ或Ⅳ期[4],5 年生存率仅为 42.9%[5]。 随着年龄和分期的增加,卵巢癌的发病率和死亡率增加,5年存活率为45%[6]。大多卵巢癌诊断时已发生远处或广泛转移,因此早期、正确诊断尤为重要。临床检查和CA125水平检出卵巢癌的敏感性低于50%。超声检出卵巢癌敏感,但特异性相对较低,导致许多良性病变行不必要的外科手术。CT可获取薄层图像,行图像后处理,为卵巢肿瘤的定性及指导外科治疗提供重要信息[7]。本文旨在分析CT诊断良恶性卵巢病变的准确度。
1 资料与方法
1.1 一般资料 回顾性分析山东大学齐鲁医院和山东省肿瘤医院2014年9月至2018年2月收治的232例经组织病理学证实为卵巢肿瘤及肿瘤样病变患者的CT图像,年龄9~82岁,平均(53.41±13.7)岁。恶性病变162例,包括浆液性囊腺癌133例(12例观察到乳头状结构),黏液性囊腺癌7例,黏液、浆液混合性腺癌1例,透明细胞腺癌6例,子宫内膜样癌4例,粒层细胞瘤2例,癌肉瘤2例,淋巴瘤2例,卵巢卵黄囊瘤1例,小细胞癌1例,移行细胞癌1例,恶性苗勒氏管肿瘤1例,恶性畸胎瘤1例。良性病变70例,包括浆液性囊腺瘤13例(2例观察到乳头状结构),黏液囊腺瘤16例,Brenner瘤2例,Brenner瘤伴黏液性囊腺瘤1例,纤维瘤3例,纤维卵泡膜细胞瘤14例,畸胎瘤19例,卵巢甲状腺肿2例。
1.2 仪器与方法 采用Philips Brilliance 256层CT扫描仪,扫描范围从膈肌到耻骨联合,120 kV,200mAs,层厚、层距均为5mm。采用高压注射器经肘静脉注射优维显(300 mgI/mL)90 mL,流率 3.0 mL/s。注射对比剂后30、70 s行动脉期、静脉期扫描。
1.3 图像分析 由观察者A(9年工作经验)、B(15年工作经验)分别独立阅读CT图像,得出各自诊断结论。病变定位依据:病变位于子宫侧方,与子宫圆韧带关系密切或卵巢血管进入病变,从而确定来源于卵巢。CT判断良恶性病变的参考标准:良性病变多为单侧发病,较小,形态规则,表面光滑,以囊性密度为主,囊壁及分隔薄、厚薄均匀,常无腹、盆腔积液及腹膜结节,无远处转移。恶性病变多为双侧发病,较大,形态不规则,边界模糊,以囊实性或实性为主,囊壁或分隔厚薄不均,多有壁结节,多伴腹、盆腔积液、腹膜结节及远处转移等。良恶性判断还应结合患者年龄、临床症状及肿瘤标志物水平。
1.4 统计学方法 数据分析使用SPSS 19.0统计软件。计算分类变量(良性和恶性)的频率和百分比、连续变量(年龄)的平均值和标准差;计算敏感度、特异度、95%可信区间(CI)、阳性预测值、阴性预测值和准确度;使用Kappa分析计算观察者之间的一致性,以及CT诊断与病理学结果的一致性。
2 结果
组织病理学证实232例中,162例(69.8%)恶性,70例(30.2%)良性。观察者A诊断158例(68.1%)恶性,74例(31.9%)良性。观察者B诊断160例(69.0%)恶性,72例(31.0%)良性。
观察者A诊断结果为:真阳性149例,假阳性9例,真阴性61例和假阴性13例。观察者B诊断结果为:真阳性153例,假阳性7例,真阴性63例和假阴性9例。观察者A诊断假阳性9例,其中4例纤维瘤(图1)或纤维卵泡膜细胞瘤、3例浆液或黏液性囊腺瘤、1例卵巢甲状腺肿(图2)及1例子宫内膜异位囊肿(图3)诊断为恶性肿瘤。其中7例被观察者B诊断为恶性肿瘤。观察者A诊断假阴性13例,术后病理证实为恶性肿瘤,其中8例为浆液性囊腺癌,1例黏液性囊腺癌,1例透明细胞癌,1例小细胞癌,2例分化差的粒层细胞瘤。其中9例被观察者诊断为良性肿瘤(图4)。观察者A和B的CT诊断的敏感度、特异度、阳性预测值、阴性预测值和诊断准确度见表1。观察者间CT诊断的一致性为优(K=0.933)。对于2位观察者,CT与组织病理学间的K值分别为0.779和 0.838。
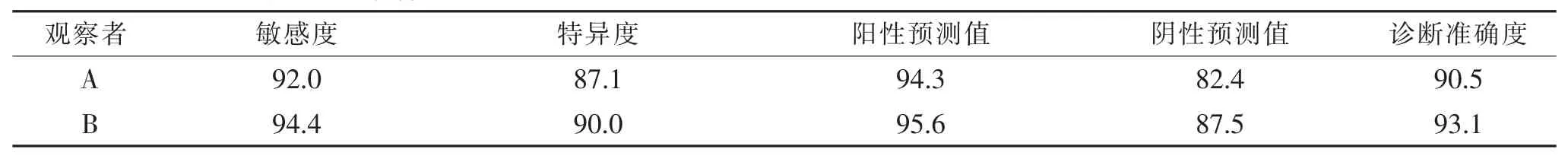
表1 观察者A和B的CT诊断敏感度、特异度、阳性预测值、阴性预测值和准确度(%)
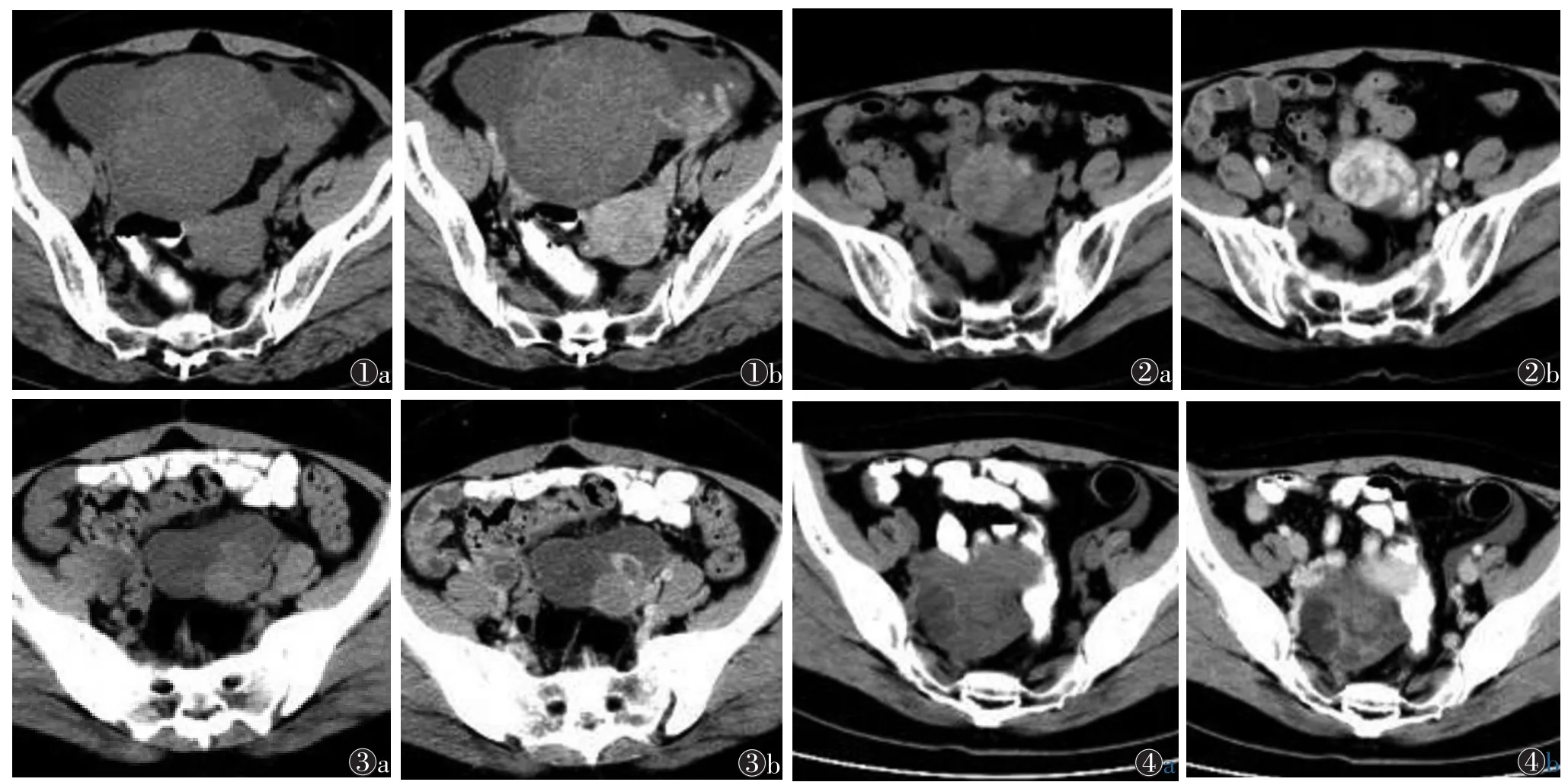
图1 女,57岁,卵巢纤维瘤 图1a,1b 分别为CT平扫、增强扫描静脉期,显示盆腔软组织肿块,密度欠均匀,与左侧附件相延续,增强扫描呈中度欠均匀强化,盆腔积液。CT诊断为卵巢恶性肿瘤 图2 女,64岁,卵巢甲状腺肿 图2a,2b 分别为CT平扫、增强扫描动脉期,显示左侧附件区软组织肿块,密度不均匀,增强扫描明显不均匀强化。CT诊断为卵巢癌 图3 女,43岁,卵巢子宫内膜异位囊肿 图3a,3b 分别为CT平扫、增强扫描静脉期,显示盆腔混杂密度肿块,高密度成分位于重力依赖部位,增强扫描纤维囊壁强化较明显。CT诊断为卵巢癌 图4 女,39岁,卵巢透明细胞腺癌 图4a,4b 分别为平扫、增强扫描静脉期,显示右侧附件区囊实性肿块,实性为主,形态不规则,增强扫描实性成分轻度中度欠均匀强化。CT诊断为良性肿瘤
3 讨论
卵巢恶性肿瘤临床症状出现晚,且无特异性,多数患者因腹部肿块或腹痛超声检查发现[8-9]。确定卵巢肿瘤的良恶性有利于制订治疗方案,诊断主要基于实验室检查和影像检查[10-11]。CT能够检出病变,鉴别良恶性,评估病变范围和有无转移。文献[12]报道CT鉴别卵巢肿块的敏感度和特异度为81.0%和87.0%;鉴别附件肿块良恶性的敏感度和特异度达90.5%和93.7%[12]。本研究中,观察者A采用CT诊断的敏感度和特异度分别为92.0%和87.1%,观察者B为94.4%和90.0%。CT与组织病理学间的一致性及2位观察者间CT诊断的一致性为优。
CT成像速度快,能够同时评估附件和腹部,显示附件肿块特征的能力大大提高。各向同性的图像能够获取高分辨的多平面和3D重组图像,帮助病变定位,直观显示病变与周围结构的关系。薄层和高的分辨力能够显示肿块内部的细节和特征,从而准确鉴别良恶性病变。CT能够发现腹水、腹膜侵犯和淋巴结转移,增加了诊断恶性病变的依据[13],对病变分期及制订手术方案起重要作用。本研究中良性病变多为囊性,囊壁或间隔薄,较均匀,少见壁结节,增强扫描病变强化不明显或仅囊壁及间隔强化。而恶性病变形态不规则,多以囊实性或实性为主,密度不均匀,见不规则壁结节或突起,增强扫描多明显不均匀强化,可见腹盆腔积液、腹膜种植及其他远处转移表现。病变较大时,与周围结构分界不清,仅靠物理位置,难以正确判断病变来源,增强扫描薄层及MPR图像显示卵巢动静脉增粗并进入病变,从而确定为卵巢来源,对合并扭转病变的定位尤其有价值,本研究2位观察者通过此种方法正确定位病变。
卵巢肿块分类复杂,CT表现多样。然而,一些肿瘤具有特定的影像特征,熟练掌握这些特征有助于作出诊断:①成熟囊性畸胎瘤可见脂肪、钙化、漂浮的毛发及脂肪液平。②纤维瘤多为实性,平扫密度略低,增强扫描呈轻度缓慢强化。③浆液性囊腺瘤多为单房;而浆液性囊腺癌多为双侧、多房,病变相对较小,可见实性成分,沙砾体样钙化及腹膜种植多见。④黏液性囊腺瘤多为囊性,病变较大、多房;而黏液性囊腺癌表现为大的多发囊性肿块,类似彩色玻璃样。本研究中,观察者A和观察者B的诊断准确度分别为 90.5%和 93.1%,与文献[12,14]报道一致。观察者A诊断假阳性9例,假阴性13例。观察者B诊断假阳性7例,假阴性9例。导致假阳性诊断的原因包括:病变较大;成分复杂、密度不均;出现腹、盆腔积液。假阴性诊断的原因包括:病变较小,6例直径<4 cm,诊断为良性;病变以囊性为主或表现为单纯性囊肿,仅内部分隔;未充分结合临床信息,低估其他伴随影像表现的诊断价值,如病变内部小的壁结节、内部分隔不光滑,有强化、腹膜结节、淋巴结略大及少量腹盆腔积液等。
本研究分析了观察者间的一致性,而以往研究[11,15]未分析。本研究的不足:为回顾性研究,存在选择偏倚;仅分析CT的诊断准确度和价值,未与MRI进行比较研究;由2位观察者评估图像,难以代表放射科医师的总体诊断水准。
