卵巢浆液性囊腺癌组织中miR-20a、Let-7a表达变化及与患者预后的关系
2016-04-18任红娟
任红娟
(南阳市中心医院,河南南阳473000)
卵巢浆液性囊腺癌组织中miR-20a、Let-7a表达变化及与患者预后的关系
任红娟
(南阳市中心医院,河南南阳473000)
摘要:目的观察卵巢浆液性囊腺癌组织中微小RNA-20a(miR-20a)和Let-7a的表达变化,并探讨二者与患者预后的关系。方法 卵巢浆液性囊腺癌患者93例,术中留取肿瘤组织。分别留取同期手术治疗的卵巢交界性肿瘤患者(43例)及卵巢浆液性囊腺瘤患者(48例)的肿瘤组织,留取正常卵巢组织(40例份)。采用real-time PCR技术检测不同组织中的miR-20a和Let-7a。采用Kaplan-Meier法分析卵巢浆液性囊腺癌组织中miR-20a、Let-7a表达与患者预后的关系。结果各种卵巢肿瘤组织中miR-20a表达量高于正常卵巢组织、Let-7a表达量低于正常卵巢组织(P均<0.05);卵巢浆液性囊腺癌组织中miR-20a表达量高于卵巢交界性肿瘤组织及卵巢浆液性囊腺瘤组织、Let-7a表达量低于卵巢交界性肿瘤组织及卵巢浆液性囊腺瘤组织(P均<0.05)。miR-20a、Let-7a与卵巢浆液性囊腺癌的临床分期、分化程度、淋巴结转移和远处转移发生情况有关(P均<0.05)。卵巢浆液性囊腺癌组织中miR-20a与Let-7a表达呈负相关关系(r=-0.489,P<0.05)。卵巢浆液性囊腺癌患者随访至2014年2月28日,miR-20a表达量>1.42者中位生存时间短于miR-20a表达量≤1.42者,Let-7a表达量<0.98者中位生存时间短于Let-7a表达量≥0.98者(P均<0.05)。结论 卵巢浆液性囊腺癌组织中miR-20a呈高表达、Let-7a呈低表达,二者可能共同参与了卵巢浆液性囊腺癌的发生、发展,并与患者预后有关。
关键词:卵巢肿瘤;卵巢浆液性囊腺癌;微小RNA;微小RNA-20a;Let-7a基因
卵巢癌是常见的女性生殖系统恶性肿瘤。由于卵巢位置较深,卵巢癌发现时多处于晚期,晚期病例尚无有效治疗手段,患者病死率高[1]。卵巢浆液性囊腺癌是最常见的卵巢原发性肿瘤,具有较强的转移、侵袭能力[2,3]。微小RNA-20a(miR-20a)由miR-17-92簇基因编码[4],其在上皮来源的恶性肿瘤组织中高表达,与肿瘤发生、进展关系密切[5,6]。Let-7家族是miRNA成员之一,其中Let-7a是Let-7家族重要成员,具有抑癌基因作用[7,8]。本研究观察了卵巢浆液性囊腺癌组织中miR-20a和Let-7a的表达变化,并探讨其意义,现报告如下。
1资料与方法
1.1临床资料2010年2月~2013年2月在我院择期行手术治疗的卵巢浆液性囊腺癌患者93例,年龄38~73(53.6±8.7)岁;国际妇产科联盟(FIGO)临床分期Ⅰ期26例、Ⅱ期17例、Ⅲ期39例、Ⅳ期11例;中低分化74例、高分化19例;发生淋巴结转移16例、出现远处转移63例。术中留取肿瘤组织。分别留取同期手术治疗的卵巢交界性肿瘤患者(43例)及卵巢浆液性囊腺瘤患者(48例)的肿瘤组织,并留取正常卵巢组织(40例份)。各组标本迅速保存于-70 ℃液氮中备检。
1.2miR-20a、Let-7a检测采用real-time PCR技术检测各组织中的miR-20a、Let-7a。组织研磨后,用TRIzol总RNA提取试剂盒提取总RNA,并用紫外分光光度计进行检测,取A260/A280≥1.8样品完成后续实验。用逆转录试剂盒将RNA逆转录为cDNA。以cDNA为模板,进行PCR反应。miR-20a上游引物序列为5′-GCGGCGGTAAAGTGCTTATAGTG-3′,下游引物序列为5′-TGCAGGGTCCGAGGTAT-3′;Let-7a上游引物序列为5′-GCGCCTGAGGTAGTAGGTTG-3′,下游引物序列为5′-CAGTGCAGGGTCCGAGGT-3′。PCR反应条件:94 ℃预变性60 s,90 ℃变性45 s,74 ℃ 30 s,56 ℃ 30 s,连续进行36个循环。每个样品均设3个平行复孔,以U6为内参,以2-ΔΔCt代表miR-20a、Let-7a相对表达量。
2结果
2.1不同卵巢肿瘤组织及正常卵巢组织中miR-20a、Let-7a相对表达量比较各种卵巢肿瘤组织中miR-20a表达量高于正常卵巢组织、Let-7a表达量低于正常卵巢组织(P均<0.05);卵巢浆液性囊腺癌组织中miR-20a表达量高于卵巢交界性肿瘤组织及卵巢浆液性囊腺瘤组织、Let-7a表达量低于卵巢交界性肿瘤组织及卵巢浆液性囊腺瘤组织(P均<0.05)。详见表1。
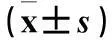
表1 不同卵巢肿瘤组织及正常卵巢组织中
注:与正常卵巢组织相比,*P<0.05;与卵巢浆液性囊腺瘤组织相比,#P<0.05;与卵巢交界性肿瘤组织相比,△P<0.05。
2.2miR-20a、Let-7a表达与卵巢浆液性囊腺癌临床病理参数的关系不同临床分期、不同分化程度、不同淋巴结转移和远处转移发生情况的卵巢浆液性囊腺癌患者肿瘤组织中miR-20a、Let-7a相对表达量相比,P均<0.05。详见表2。

表2 miR-20a、Let-7a表达与卵巢浆液性
注:与Ⅰ、Ⅱ期者相比,*P<0.05;与中低分化者相比,#P<0.05;与有淋巴结转移者相比,△P<0.05;与有远处转移者相比,☆P<0.05。
2.3卵巢浆液性囊腺癌组织中miR-20a与Let-7a表达的相关性卵巢浆液性囊腺癌组织中miR-20a与Let-7a表达呈负相关关系(r=-0.489,P<0.05)。
2.4卵巢浆液性囊腺癌组织中miR-20a、Let-7a表达与患者预后的关系卵巢浆液性囊腺癌患者随访至2014年2月28日。根据本研究结果,miR-20a相对表达量>1.42者(高表达组,71例)中位生存时间15.9个月,miR-20a相对表达量≤1.42者(低表达组,22例)中位生存时间19.2个月,两组中位生存时间相比,P<0.05。Let-7a相对表达量<0.98者(低表达组,59例)中位生存时间14.5个月,Let-7a相对表达量≥0.98者(高表达组,34例)中位生存时间为19.5个月,两组中位生存时间相比,P<0.05。详见图1、2。

图1 卵巢浆液性囊腺癌组织中miR-20a表达

图2 卵巢浆液性囊腺癌组织中Let-7a表达
3讨论
卵巢浆液性囊腺癌作为卵巢癌最常见的病理类型,具有恶性程度高、侵袭性强、易转移等特点,缺乏有效的早期诊断手段,约70%的患者确诊时已处于晚期[9]。因此,相关肿瘤标志物的发现对早期防治有重要意义。研究[10~12]表明,miR-20a在肿瘤发生、进展及转移过程中发挥重要作用,其在多数肿瘤组织中高表达,作为癌基因而发挥作用。本研究结果显示,miR-20a在卵巢浆液性囊腺癌、卵巢交界性肿瘤和卵巢浆液性囊腺瘤组织中相对表达量均高于正常卵巢组织,以卵巢浆液性囊腺癌组织中相对表达量最高;肿瘤临床分期高、分化程度低、发生淋巴结转移或远处转移者肿瘤组织中miR-20a相对表达量更高,提示卵巢病变过程中伴随着miR-20a的异常表达,且miR-20a在卵巢浆液性囊腺癌细胞增殖、侵袭、转移中发挥重要作用。
Let-7a是Let-7家族成员之一,可通过负向调控HMGA2表达从而抑制早期肿瘤进展,可能发挥抑癌基因作用[13]。本研究结果显示,Let-7a在卵巢浆液性囊腺癌、卵巢交界性肿瘤和卵巢浆液性囊腺瘤组织中相对表达量均低于正常卵巢组织,且卵巢浆液性囊腺癌组织中表达最低;临床分期高、分化程度低、出现淋巴结转移或远处转移者肿瘤组织中Let-7a相对表达量更低。上述结果提示Let-7a低表达参与了卵巢病变进程[14],且Let-7a低表达可促进卵巢浆液性囊腺癌细胞增殖、侵袭及转移。Pearson相关分析结果显示,卵巢浆液性囊腺癌组织中miR-20a与Let-7a表达呈负相关关系,提示miR-20a高表达与Let-7a低表达可能在卵巢浆液性囊腺癌发病、侵袭过程中发挥协同作用[15,16]。
为进一步探讨miR-20a、Let-7a表达与卵巢浆液性囊腺癌患者预后的关系,我们根据以上研究结果分别界定miR-20a、Let-7a高表达组及低表达组,进行生存分析后发现,miR-20a高表达组中位生存时间短于miR-20a低表达组,Let-7a低表达组中位生存时间短于Let-7a高表达组,提示miR-20a、Let-7a表达均与卵巢浆液性囊腺癌患者预后有关,miR-20a、Let-7a有望成为卵巢浆液性囊腺癌基因治疗的新靶点。
综上所述,卵巢浆液性囊腺癌组织中miR-20a呈高表达、Let-7a呈低表达,二者可能共同参与了卵巢浆液性囊腺癌的发生与进展过程,且与患者预后有关,具体作用机制尚待进一步明确。
参考文献:
[1] Frampton JE. Olaparib: a review of its use as maintenance therapy in patients with ovarian cancer[J]. Bio Drugs, 2015,29(2):143-150.
[2] Reade CJ, McVey RM, Tone AA, et al. The fallopian tube as the origin of high grade serous ovarian cancer: review of a paradigm shift[J]. J Obstet Gynaecol Can, 2014,36(2):133-140.
[3] Liu P, Wang Y, Tong L, et al. Elevated preoperative plasma D-dimer level is a useful predictor of chemoresistance and poor disease outcome for serous ovarian cancer patients[J]. Cancer Chemother Pharmacol, 2015,76(6):1163-1171.
[4] Wang Y, Zhang Y, Wang H, et al. Aberrantly up-regulated miR-20a in pre-eclampsic placenta compromised the proliferative and invasive behaviors of trophoblast cells by targeting forkhead box protein A1[J]. Int J Biol Sci, 2014,10(9):973-982.
[5] 蔡辉,袁媛,韦雪,等.miR-106b、miR-20a和miR-221在早期胃癌中表达的研究[J].中华普通外科杂志,2014,29(2):115-118.
[6] Zhou J, Liu R, Luo C, et al. MiR-20a inhibits cutaneous squamous cell carcinoma metastasis and proliferation by directly targeting LIMK1[J]. Cancer Biol Ther, 2014,15(10):1340-1349.
[7] 陈烈钳,邱明宁,谭国斌,等.MicroRNA let-7家族与肿瘤的研究进展[J].现代肿瘤医学,2015,23(4):571-575.
[8] Xu C, Sun X, Qin S, et al. Let-7a regulates mammosphere formation capacity through Ras/NF-κB and Ras/MAPK/ERK pathway in breast cancer stem cells[J]. Cell Cycle, 2015,14(11):1686-1697.
[9] Sun Y, Guo F, Bagnoli M, et al. Key nodes of a microRNA network associated with the integrated mesenchymal subtype of high-grade serous ovarian cancer[J]. Chin J Cancer, 2015,34(1):28-40.
[10] Rizzo M, Mariani L, Pitto L, et al. miR-20a and miR-290, multi-faceted players with a role in tumourigenesis and senescence[J]. J Cell Mol Med, 2010,14(11):2633-2640.
[11] Elkayam E, Kuhn CD, Tocilj A, et al. The structure of human argonaute-2 in complex with miR-20a[J]. Cell, 2012,150(1):100-110.
[12] Zhang X, Kong Y, Xu X, et al. F-box protein FBXO31 is down-regulated in gastric cancer and negatively regulated by miR-17 and miR-20a[J]. Oncotarget, 2014,5(15):6178-6190.
[13] Cao Q, Li YY, He WF, et al. Interplay between microRNAs and the STAT3 signaling pathway in human cancers[J]. Physiol Genomics, 2013,45(24):1206-1214.
[14] 李明,姜桦.微小RNA与卵巢癌研究进展[J].国际妇产科学杂志,2015,42(2):136-140.
[15] Pesta M, Klecka J, Kulda V, et al. Importance of miR-20a expression in prostate cancer tissue[J]. Anticancer Res, 2010,30(9):3579-3583.
[16] He FC, Meng WW, Qu YH, et al. Expression of circulating microRNA-20a and let-7a in esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2015,21(15):4660-4665.
(收稿日期:2015-09-09)
中图分类号:R737.31
文献标志码:B
文章编号:1002-266X(2016)07-0047-03
doi:10.3969/j.issn.1002-266X.2016.07.017
