中国黄海封闭与开放水域大叶藻种群动态研究*
2018-10-17潘金华张壮志李晓捷韩厚伟崔翠菊罗世菊杨官品
潘金华,张壮志,李晓捷,江 鑫,韩厚伟,孙 娟,崔翠菊,罗世菊,杨官品
(1.山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东 烟台 264003;2.山东东方海洋科技股份有限公司,山东省海藻遗传育种与栽培技术重点实验室,山东 烟台 264003;3.中国海洋大学海洋生命学院,山东 青岛 266003)
大叶藻(ZosteramarinaL.),属沼生目(Helobiae),大叶藻科(Zosteraceae),大叶藻属(Zostera),主要分布遍及北大西洋和北太平洋东西两岸[1],在我国的辽宁、河北和山东沿海均有分布[2]。大叶藻种群是近海生态系统的重要组成部分,对维持海洋生态系统平衡具有积极作用。受自然因素和人类活动影响,全球范围内海草场出现大面积衰退,激发了许多研究人员对海草种群动态属性研究的兴趣[3-4]。在水质透明度较高的海区,海草种群在深度11 m以浅的海区具有广泛分布,其个体大小往往随着纬度的升高而增加[5],在日本发现的具茎大叶藻(Z.caulescens)繁殖枝最大长度达7 m[6]。大叶藻种群动态在世界其它海区已有比较广泛研究[7-9],而我国关于海草场种群动态方面的研究则相对滞后[10]。郑凤英等[10](2013)对山东半岛黄海沿海大叶藻形态及生长发育特征进行了报道,但是尚无针对山东半岛沿海特别是不同生境条件下大叶藻种群季节动态结构比较研究的报道。山东半岛沿海海草场主要有两大类,分别是以大叶藻(Z.marina)为优势种的大叶藻属海草场和以红须根虾藻(PhyllospadixiwatensisMakino)为优势种的虾形藻属海草场,且前者居多[10]。本文在实地潜水考察的基础上,选取了烟台四十里湾和威海爱莲湾围堰池(山东沿海地地区,人们在潮间带人工筑坝建起来的海参养殖池,通过自然每天的潮汐变化自然进出水进行水体交换,称之为围堰池)内的大叶藻种群为研究对象,进行不同生境下的大叶藻群落研究。四十里湾靠近烟台市区,属旅游度假区附近,周边海域无藻类筏式养殖区,营养盐水平相对较高,且属开放水域,受海流影响较大;爱莲湾则相反,相对远离市区,周边海域有大量海带养殖筏架,水质较好。选取两处水文特征差异较大的大叶藻种群海区进行种群动态的研究,有利于深入了解山东半岛沿海大叶藻场种群变化规律,对于该地区大叶藻场资源保护和合理开发利用具有积极意义。
1 材料与方法
1.1 研究地点
所选两处大叶藻生境均处中国黄海(见图1)。四十里湾(37°30.681′N,122°26.923′E)位于烟台海域,靠近烟台市区,西北与芝罘湾相连,东临养马岛风景度假区,湾外即为崆峒列岛。爱莲湾(37°14.925′N,122°35.716′E)属威海荣成,位于山东半岛最东部,成山角南部,属中国农业部公布的国家级水产种质资源保护区。四十里湾海区水温和盐度由烟台市海洋与渔业局位于该海区的下属浅海养殖单位协助监测,爱莲湾围堰池塘水温与盐度由俚岛映波水泥厂渔业养殖公司协助监测。所选两处观测点平均水深均为3.5 m左右。温度每天测量3次,早(8:00—8:30)、中(12:00—12:30)、晚(17:00—17:30)各测1次,盐度每周测定1次(Cond 3310,德国WTW)。海水透明度(透明度盘 SD20,北京普力特仪器有限公司)每天上午(10:00—10:30)和下午(14:00—14:30)各测量1次,每次随机选取测量3个点。

(△指示监测点:SSL-四十里湾,烟台;AL-爱莲湾,荣成。The △ depicts the study sites: SSL-Sishili Bay,Yantai,and AL-Ailian Bay,Rongcheng.)
图1 黄海山东半岛大叶藻种群动态研究监测点
Fig.1 The study sites for the population dynamics ofZ.marinaon Shandong Peninsula,Yellow Sea,China.
1.2 大叶藻植株大小季节动态
烟台四十里湾与荣成爱莲湾围堰池种群动态的监测,在每次取样时,由同一批采样人员在同一天之内完成。自2011年5月开始,于每月15日前后,采用50 cm×50 cm的方形不锈钢框架作为样方,于观测点随机选取相互距离10 m以上的3个样方。将每个样方内的大叶藻连同地下茎全部挖掘,分别装入泡沫箱内并加水于4 h内带回实验室,立即对大叶藻植株数量、长度(自直立茎与地下茎交接处至藻体最长处的长度视为大叶藻株长度)测量。数据获取周期为2011年5月—2012年5月。
1.3 大叶藻地上与地下生物量季节动态
利用1.2中获取的大叶藻样品,对每次获取的3个样方生物量干重分别进行测定。生物量测定方法为:首先小心去除附着性杂物,然后用吸水纸吸掉植株表面的水分,称量鲜重,然后将地下部分与地上部分切断分开,再分别称量鲜重,然后将地上和地下部分分别在60 ℃烘干至恒重后迅速称量干重[11]。
1.4 大叶藻的有性繁殖
在大叶藻进入繁殖季节之前(3月底),每3天左右跟踪观测一次以确定两海区大叶藻群落产生繁殖枝的具体时间。按照1.2中获取的样品,对每次取样的每个样方内的大叶藻植株进行仔细检查,如发现大叶藻繁殖枝,则统计繁殖枝数量,以掌握繁殖枝季节动态规律。观察时间自2011年2月开始,数据获取周期为2011年5月—2012年5月。在大叶藻种子成熟季节采集大叶藻种子(6月底至7月初),分别从两个海区采集的大叶藻种子随机各抽取300粒,大叶藻种子中间纵切面为类椭圆形[12],用游标卡尺逐一测量大叶藻种子的长(长轴长度)和宽(短轴长度),用电子天平(XPE105)称量单粒大叶藻种子重量。
样品的现场采集、保存、测定和分析等过程参照《海洋调查规范》(GB/T 12763-2007)、《海洋监测规范》(GB 17378-2007)和Method for the Measurement of Seagrass Growth and Production[11]执行。
1.5 数据分析
对每次取样的两个海区大叶藻种群植株密度、植株高度、地上/地下生物量、繁殖枝密度以及大叶藻种子的长度、宽度和大叶藻单粒种子重量数据进行单因素方差分析(One-way ANOVA),采用Duncan’s进行多重比较,显著水平设为P<0.05。所有统计分析均在SPSS 17.0下完成。
2 结果
2.1 两海区大叶藻种群植株长度季节动态
两观测海区大叶藻种群个体长度均在7月份达到峰值,四十里湾大叶藻植株平均体长度为69.98 cm,当月平均水温约21.8 ℃,平均长度最低在10月份,为16 cm,水温约17.8 ℃(见图2);爱莲湾植株平均长度峰值为107.42 cm,当月平均水温约21.3 ℃,最低值出现在10月份,平均约23 cm,平均水温约17.3 ℃(见图3);每月两地大叶藻群落个体长度差异均显著(P<0.05)。四十里湾大叶藻种群密度平均峰值出现在7月,为273.21 株·m-2,爱莲湾种群出现在6月,为364 株·m-2(见图4),两地大叶藻群落种群密度差异显著(P<0.05)。
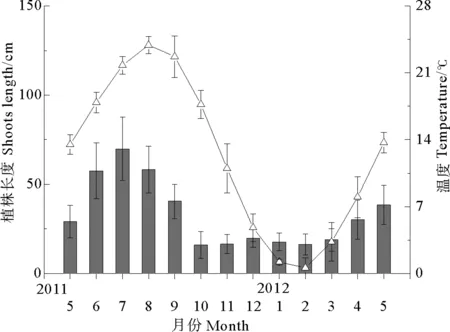
(2011年5月—2012年5月,■个体长度±SD,△水温±SD 。From May 2011 to May 2012.■shoots length±SD,△temperature±SD.)
图2 四十里湾大叶藻植株长度与水温季节动态
Fig.2 Seasonal dynamics ofZ.marinaand water temperature in Sishili Bay
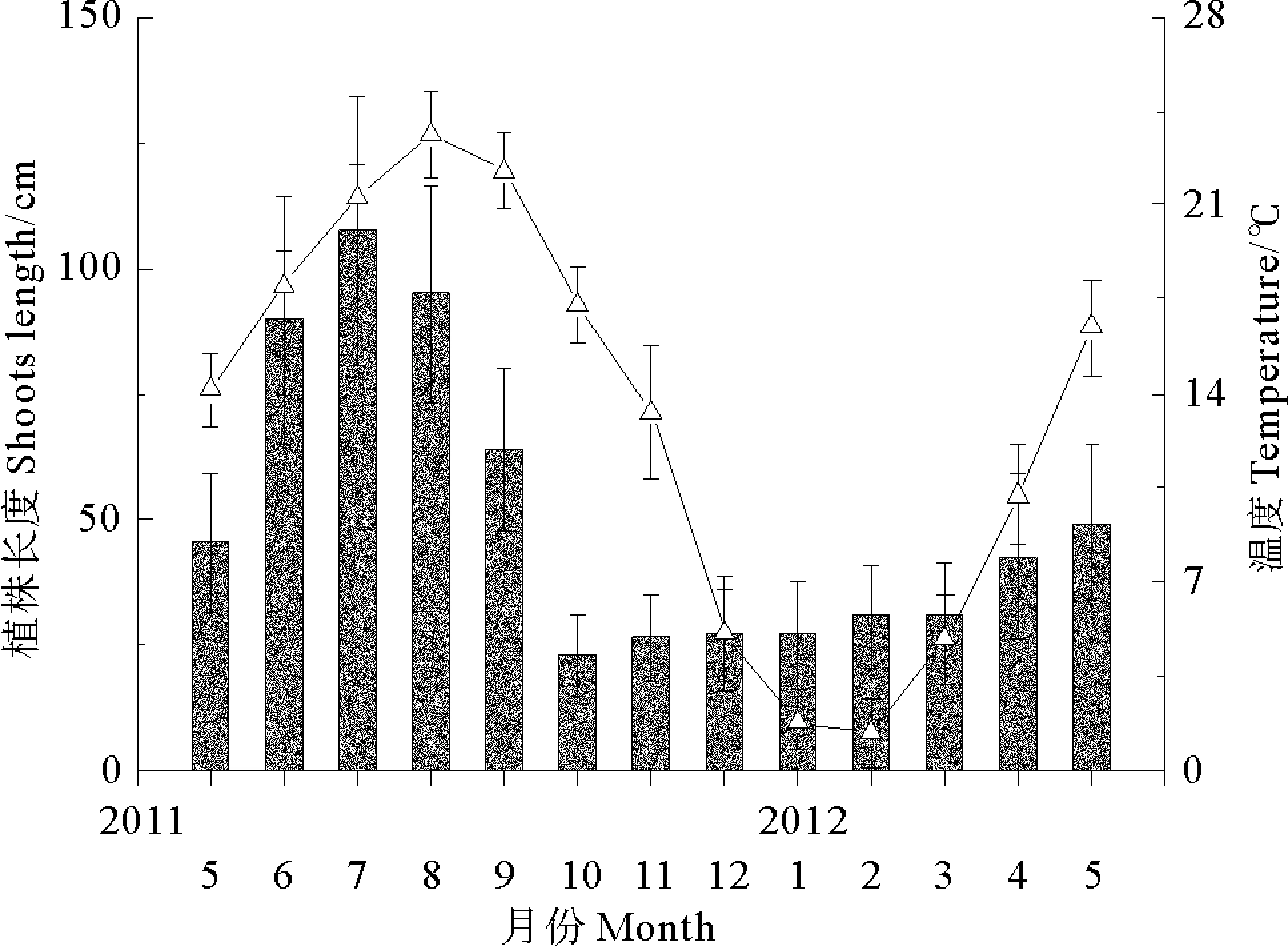
(2011年5月—2012年5月,■藻体长度±SD,△水温±SD。From May 2011 to May 2012.■shoots length±SD,△temperature±SD.)
图3 爱莲湾围堰池大叶藻植株长度与水温季节动态
Fig.3 Seasonal dynamics ofZ.marinaand water temperature in the cofferdam of Ailian Bay
2.2 两海区大叶藻生物量季节动态
四十里湾和爱莲湾围堰池两地大叶藻种群地上生物量(干重g·dwt)均在7月份达到峰值。四十里湾种群地上生物量峰值为487.63 g·dwt·m-2,对应地下生物量为127.63 g·dwt·m-2(见图5);爱莲湾种群地上生物量峰值为754.84 g·dwt·m-2,对应地下生物量为113.21 g·dwt·m-2(见图6),两地大叶藻种群周年地上生物量差异显著(P<0.05)。

(▲爱莲湾种群密度,△四十里湾种群密度,■爱莲湾繁殖枝密度,□四十里湾繁殖枝密度,平均值±SD,n=3,2011年5月—2012年5月。▲Ailian Bay,△Sishili Bay,■Ailian Bay reproductive shoots,□Sishili Bay reproductive shoots,mean±SD,n=3,from May 2011 to May 2012.)
图4 四十里湾与爱莲湾大叶藻营养枝和繁殖枝密度季节动态
Fig.4 Shoots (both vegetative and reproductive) density ofZ.marinain Sishili Bay and Ailian Bay
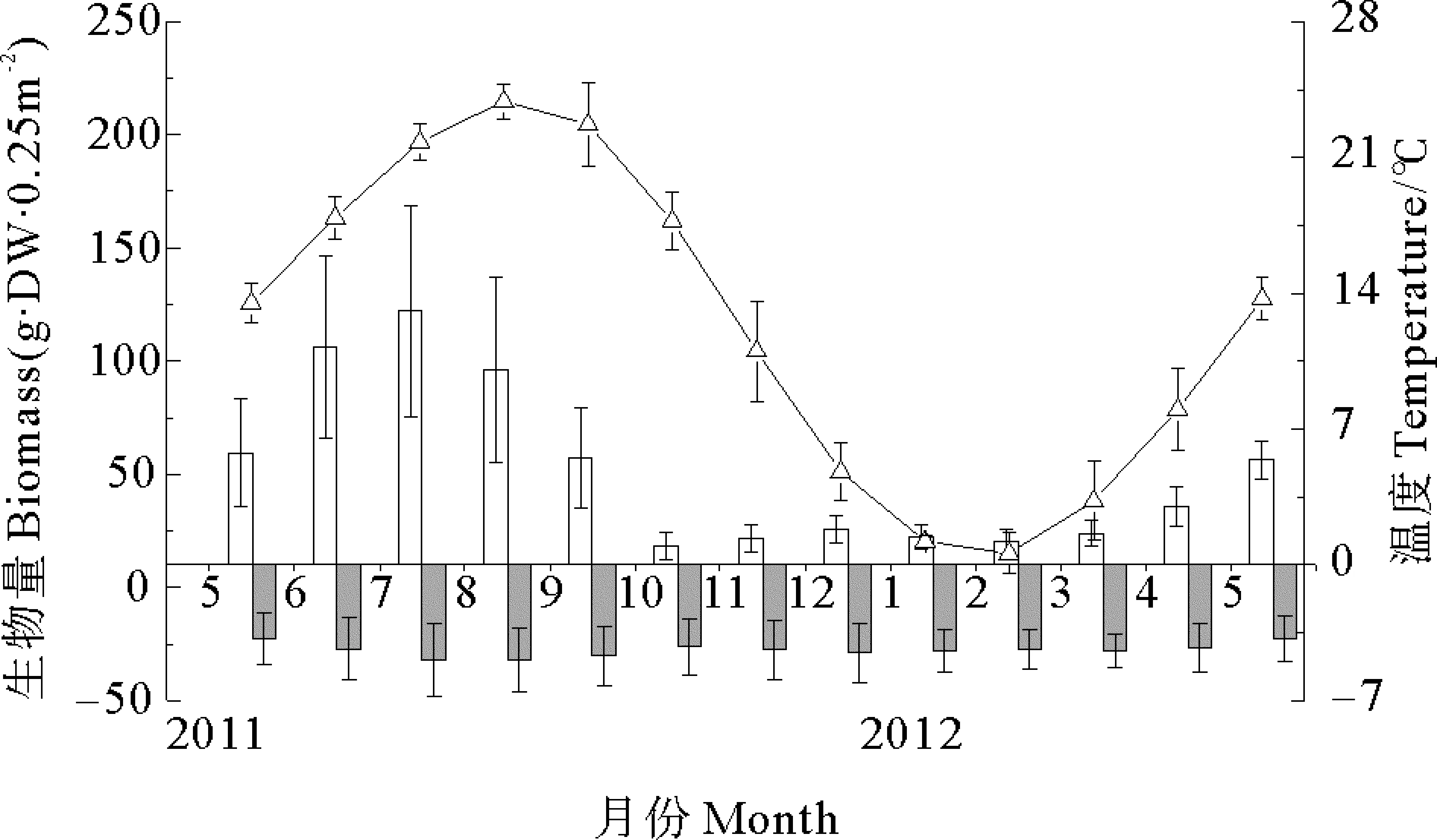
(平均值±SD,n=3,2011年5月—2012年5月。mean±SD,n=3,from May 2011 to May 2012 .)
图5 四十里湾大叶藻地上和地下生物量与水温季节变化
Fig.5 Seasonal dynamic of above/below ground biomass and water temperature in Sishili Bay in the Yellow Sea

(平均值±SD,n=3,2011年5月—2012年5月。mean±SD,n=3,from May 2011 to May 2012.)
图6 爱莲湾大叶藻地上和地下生物量与水温变化规律
Fig.6 Seasonal dynamic of above/below ground biomass and water temperature in Ailian Bay in the Yellow Sea
2.3 两海区大叶藻有性繁殖动态
2011年,爱莲湾围堰池大叶藻种群首次发现繁殖枝时间为4月14日(当天下午3点钟实测围堰池水温11.2 ℃,近岸海区水温8.1 ℃),围堰池平均水温显著高于自然海区;四十里湾首次观测到繁殖枝时间为4月27日(水温11.8 ℃),爱莲湾围堰池内大叶藻产生繁殖枝时间较四十里湾早约2周。爱莲湾围堰池大叶藻种群首次发现开花为5月2日,5月13日首次发现生长种子,6月10日发现个别种子色泽变深褐色,即种子开始成熟,6月中旬以后进入种子成熟盛期(此时开始也是收集大叶藻种子的最佳时机),直至9月10日仍观察到有少量繁殖枝未脱落,只是种子量已经非常少;四十里湾首次发现开花时间为5月19日,6月2日发现开始长种子,6月22日发现成熟种子,7月上旬进入种子大规模成熟盛期,7月底开始衰退,至8月21日观测,繁殖枝基本衰退完毕。四十里湾和爱莲湾大叶藻群落繁殖枝密度均在7月份达到峰值,分别为四十里湾69.21 株·m-2,爱莲湾109.21 株·m-2(见图4)。
2.4 两海区大叶藻种子特征
四十里湾和爱莲湾大叶藻种子在外观大小存在差
异(见图7),四十里湾和爱莲湾大叶藻种群产生的种子平均长度分别为4.17和3.43 mm(见图8 A)、平均宽度分别为2.02和1.75 mm(见图8 B),平均单粒种子质量分别为11.13和6.97 mg(见图8 C)。2个海区大叶藻种子的长度、宽度和重量均存在极显著差异(P<0.05)。

图7 四十里湾海区(左)和爱莲湾围堰池(右)大叶藻种子外形比较Fig.7 Morphological comparison of Z.marina seeds in Sishili Bay (the left) and Ailian Bay (the right)
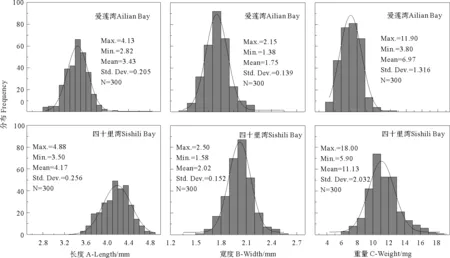
图8 四十里湾和爱莲湾大叶藻种子长度(A)、宽度(B)和重量(C)大小分布图Fig.8 Length (A),width (B) and weight (C) frequency distribution of Z.marina seeds in Sishili Bay and Ailian Bay
2.5 两海区海水透明度季节动态
四十里湾周年平均透明度约86.8 cm,而爱莲湾周年平均透明度约135.2 cm。爱莲湾海水平均透明度明显高于四十里湾透明度(见图9)。
3 讨论
3.1 不同海区大叶藻种群动态
在温带海区,海草营养生长(克隆生长)具有明显季节动态,冬季时植株生长由于受到不利环境的限制而非常缓慢,夏季随着温度升高、光照强度增加和光照时间延长,植株生长和补充速度迅速提高[13-14]。本研究中四十里湾和爱莲湾围堰池两地大叶藻种群个体长度和密度均在7月份前后达到峰值,8月开始衰退,至10月份跌至最低点,待水温回落至20 ℃以下时,大叶藻植株又开始缓慢生长,但水温下降迅速,至次年3月份,大叶藻生长比较缓慢,自三、四月份开始又进行新一轮的迅速生长(见图2、3和4)。Fonseca等[15](1983)研究发现大叶藻植株长度与水流呈正相关关系,且耐受最大水流可达120~150 cm/s,然而,本文对四十里湾开放海区和爱莲湾围堰池封闭海区的大叶藻场研究发现,水流较小的封闭海区大叶藻平均长度大于水流较大开放海区。Hauxwell等[16]研究发现大叶藻实际接收的光照强度与藻体长度也呈现明显正相关。光照强度降低会严重影响到海草分布和生长[17-18],海区营养盐排放量增加导致海草场透明度降低会直接影响到大叶藻生长和生存[17,19-20],本研究中四十里湾紧靠烟台市区,营养排放远高于爱莲湾海区[21-22],因此四十里湾海区水体中的富营养化程度远高于爱莲湾海区,使四十里湾光照条件显著低于爱莲湾海区(图9),成为导致四十里湾大叶藻种群生物量和植株长度以及种群密度远低于爱莲湾围堰池种群原因之一。
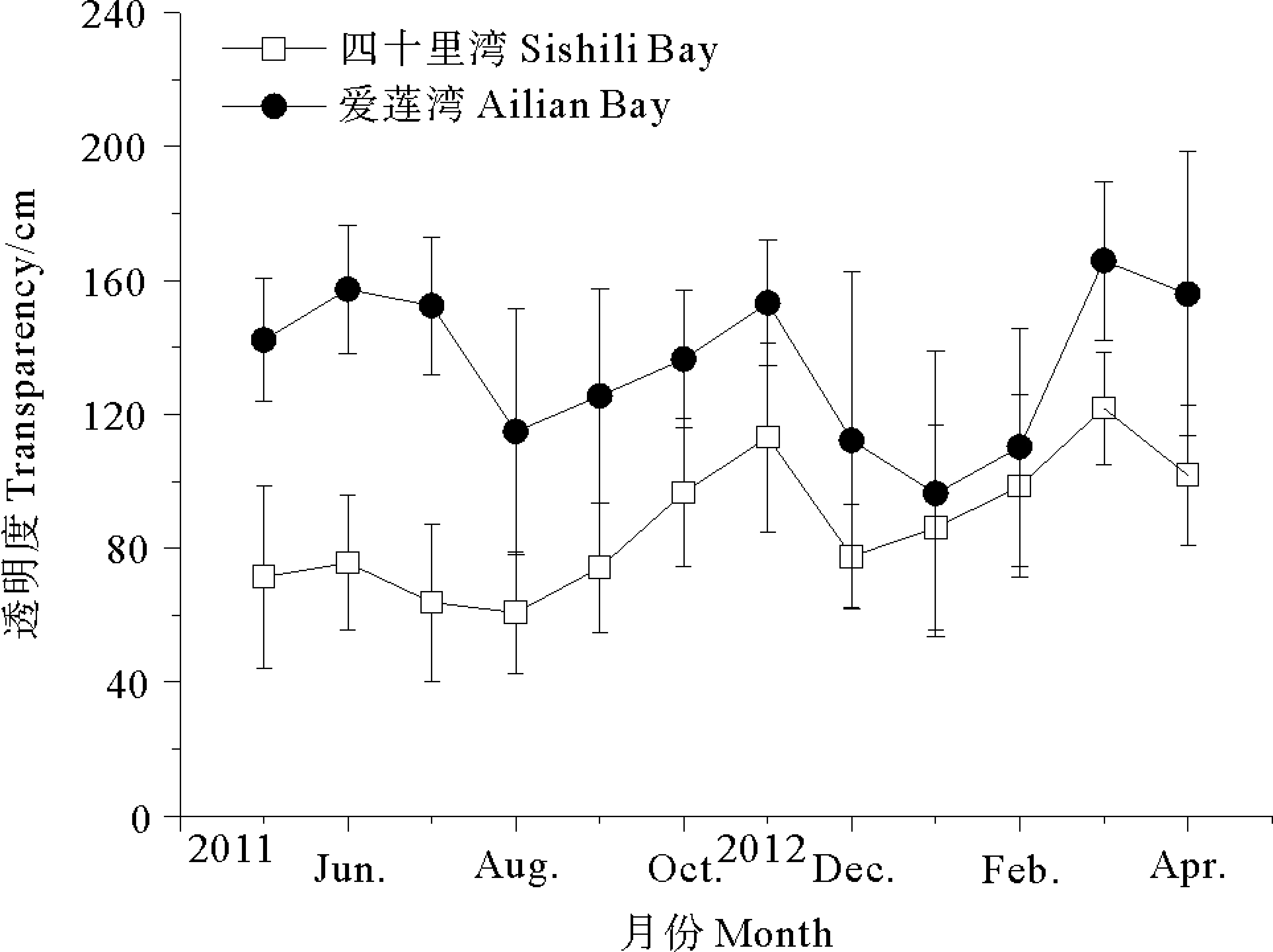
图9 四十里湾和爱莲湾围堰池海水透明度(mean±SD)的季节变化Fig.9 Seasonal dynamics of transparency in Sishili Bay and Ailian Bay (mean±SD)
海草生物量会在一年周期中产生很大变化。Duarte[23]综合比较了14种不同地区的海草之后发现,70%的海草生物量在一年周期内会产生很大变异性。季节变化对海草生物量变化的影响,主要通过受制于不同季节日照变换引起的光照强度、光照时间和水温进行调控[24-26],因此生物量的变化也会随着纬度的变化而变化[23]。相比热带和亚热带地区海草种群每年不同时间的生物量比较稳定,温带地区海草种群生物量季节变化很大,本研究中四十里湾周年大叶藻地上生物量峰值是最小值的6.7倍(见图5),爱莲湾围堰池峰值为最小值的6.1倍(见图6)。而地处亚热带海区的美国佛罗里达海区的Thalassiatestudinum最高生物量仅约为最低生物量不足1.7倍,而在热带/亚热带海区,这已是较高的比例;周年峰值生物量与最小生物量比例,朝赤道方向逐步变小,朝高纬度逐步升高[27]。光照条件也是大叶藻生物量季节变化的重要调控因素,特别是在温带地区,生物量或者生产率高峰期一般会出现在日照强度和日照时间长度的高峰期[7,14,28-31],本研究监测的四十里湾和爱莲湾围堰池的大叶藻场生物量高峰期出现在7月份(见图5、6),恰逢日照时间长度峰值刚过,日照时间由最长逐渐变短之初(日照时长参考http://richurimo.51240.com/shandongsheng__richurimo/)。
3.2 海浪冲击和潮流对大叶藻场景观尺度的影响
海浪冲击度和潮汐流动是影响海草场植株和景观尺度周年变化的重要因素之一。较大潮流和浪冲击度会降低海草覆盖度,促使海草场分布更加碎片化、斑块化,而相对稳定的水体环境有利于海草场群落结构稳定和扩增[32]。根据Verhagen和Nienhuis[33](1983)报道,一个位于荷兰西南部河口湾在1971年被人工水坝围成了葛维林汉湖(Lake Grevelingen,欧洲最大的咸水湖)之后,到1978年湖内大叶藻场面积由原1 200 ha繁衍扩增至4 400 ha,面积增加超3.6倍。覆盖率60%是区分斑块状海草场(Patchy seagrass meadows)和大型均质性海草场(Uniform seagrass meadows)的临界值,也是区分受高能海浪潮流影响海草场和稳定海草场的临界值[32]。四十里湾大叶藻种群属于开放海区与外海完全连通,受到潮汐流和海浪冲击度远大于半封闭式爱莲湾围堰池内的大叶藻种群,四十里湾内大叶藻种群明显呈斑块状分布,最大斑块为十几平方米,最小仅1平方米左右,而爱莲湾围堰池内的大叶藻种群则基本连成整体,形成均质性海草场。山东半岛围堰池内大叶藻种群通过克隆生长,种群密度会快速增加,种子产量较大,在围堰池内收集种子基本不会对围堰池内大叶藻种群造成不利影响。因此,从某种意义上讲,山东半岛沿海地区的围堰池建设,为大叶藻场保护产生了一定的有利影响,也可在有限区域内提供更大量的成体植株和种子来源,对大叶藻场保护和海草场人工修复具有一定启发。
3.3 不同海区大叶藻繁殖动态
山东半岛北部黄海大叶藻种群通常在春末(4月底5月初)开花,种子成熟一般在6月中旬到7月初。因此,最佳繁殖枝采集时间一般在6月底到7月底进行,由于每个海区的具体时间会略有差异,繁殖枝采集前要通过实地监测来确定。爱莲湾围堰池大叶藻种群至9月10日仍可见少量繁殖枝未脱落,而四十里湾大叶藻至8月21日观测繁殖枝已完全衰退(见图4)。美国切萨皮克湾内大叶藻一般在冬末春初开花,种子成熟和脱落一般在5月底至6月初[19],日本伊势湾(Ise Bay)大叶藻种群也与之类似[34]。因为海草开花和种子发育的阶段和进程在其地理范围内保持一致,开花时间、持续周期和开花与种子产量规模随着不同地区不同温度、光照、水质、深度和底质特征以及其它一些未知因素而出现较大差异[35]。所以,海草繁殖季节、持续时间和种子成熟时机存在较大时空差异[7],不同地区甚至在同一地区不同年份之间也可能有较大差异。在某一个海区而言,最佳种子采集时间一般至少持续1~2周,同一个地区内不同点之间繁殖周期进程也可能会相差数周[36]。例如,在美国切萨皮克湾内,在春季如果水温较正常水温偏低,会延缓大叶藻种子成熟达数周时间,相反,如果水温偏高,则会大大加快种子发育、成熟和脱落[37]。Lee等[38]对韩国南部Dongdae湾和Aenggang湾研究也发现海水温度是调控大叶藻种群不同繁殖阶段和进程的重要影响因子。本研究中所监测的四十里湾和爱莲湾大叶藻场因水温不同而导致繁殖阶段发育的差异,也佐证了这一点。
3.4 大叶藻场自我维持和补充策略
大叶藻繁殖力具有很强的适应性,可以在大叶藻场遭到破坏后短时间内通过种子库内的种子进行快速恢复和重建[39-41],说明了种子在维持环境压力较大的大叶藻场种群中的重要性。而在密集海草场区域,海草植株密度的维持通常主要靠营养繁殖维持,有性生殖繁殖力在许多种海草植物中都很低,通常繁殖枝占所有植株比例一般低于10%,而且种子产量也非常不稳定[42-44]。本研究监测四十里湾海区大叶藻种群繁殖枝密度显著小于爱莲湾种群(见图4),但是四十里湾大叶藻种子在大小和重量上要远高于爱莲湾围堰池种子,前者平均重量是后者1.6倍(见图8 C)。海草克隆生长在小范围海草场填补较小的空间间隙是海草场种群维持的有效机制,而繁殖输出较大、产生大量种子的大型海草以其种子的高效扩散,在填补大面积的海草间隙,以及在距离既有海草场较远空间区域的空间拓殖中担当重要使命[45]。再者,较大植株会压制小植株生长,因此在由大型植株占据的海草场内,有性繁殖补充只有当既有的大型植株损失之后才会在空出的空间内生存发展,多数海草场幼苗的补充都在既有海草场外围不受大型植株影响的空间进行,而且种子存活率和新产生幼苗的成活率都极低,也进一步说明在成熟的密集海草场区域之内有性繁殖进行海草植株补充的数量非常低[46-47]。四十里湾大叶藻产生的种子在平均重量上远高于爱莲湾围堰池的种子,大叶藻种子大小会影响萌发后幼苗的存活率,较重种子会产生更大更健康的幼苗,对不利环境具有更高的耐受力[48];当海草种子因生物扰动被带到更深的底质当中,或因沉积作用被埋入更深底质时,较重的种子在生存方面具有更强的生态优势[49-50],较重种子的子叶更有能力穿透较深底质到达表层进行生长;较重种子比较轻种子产生子叶的长度更长[12],而子叶的产生对于种子在水体中的生存具有重要意义[51]。处于开放海区的四十里湾大叶藻场面临的环境压力要远大于爱莲湾围堰池内的大叶藻场,前者产生种子个体较大,为其应对所处较高环境压力下维持大叶藻场群落提供了保障。
