不同氮磷比和铁浓度对两种海洋微藻生产二甲基硫和二甲巯基丙酸内盐的实验研究*
2018-10-17张洪海杨桂朋
朱 蓉,张洪海, 2,张 婧, 2,杨桂朋, 2**
(1.中国海洋大学化学化工学院,山东 青岛 266071;2.海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071)
二甲基硫(Dimethylsulfide,DMS)是从海洋释放到大气中组成最重要的挥发性有机硫化物[1-4]。它在硫循环中扮演的角色在于其由海洋生物合成产生,是大气中SO2的前体物质,对凝云气溶胶形成有重要意义。有科学家研究出,海水DMS的海气通量和氧化过程影响浮游植物、云层对阳光的反射和辐射,并且有相应反馈作用,更重要的是DMS会影响海区气候和酸雨及酸雾的形成[5]。
DMS主要来源于海洋微藻,Challenger等发现海藻细胞中广泛存在二甲基巯基丙酸内盐(DMSP,分子式(CH3)2SCH2COOH),DMSP是DMS的前体物质[6]。影响海水中DMS的生产和消耗的因素很多,如温度、盐度和营养盐等,但是这些因素对DMS释放的影响还没有一致认可[7]。海洋中的微型和大型藻类是DMSP的重要来源,但是不同藻体种间和株间产生DMSP的差异较大[8]。海洋微藻中大部分的金藻(Chrysophytes)、定鞭金藻(Prymnesiopytes)和甲藻(Dinophytes)是DMSP的高产者,如金藻纲的棕鞭藻(Ochromonas),甲藻纲的原甲藻(Prorocentrum)和前沟藻(Amphidinium)。相反,硅藻(Diatoms)、蓝藻(Cyanophyceae)产生DMSP的能力弱,但是有研究发现极地的硅藻意外的能产生大量的DMSP,其含量与棕囊藻属相似[9]。在近岸海水中,春季浮游植物优势藻种为硅藻,但是,夏季水体中营养盐浓度降低而成为浮游植物生长的限制因子,甲藻成为了优势藻种,这会导致水体中DMSP的产量差别很大。

1 材料与方法
1.1 实验藻种
尖刺拟菱形藻和塔玛亚历山大藻均来源于中国海洋大学海洋污染生态化学实验室。培养所用海水为东海海水,经0.45 mm醋酸纤维膜过滤,装入2 000 mL的三角烧瓶,并在121 ℃高压灭菌20 min,待冷却后充分摇动以恢复溶解气体含量[20]。培养液采用改进的f/2配方[21],调节pH为8.10±0.05,置于光照培养箱中静置培养[20]。培养条件为:温度20 ℃,光暗周期为12 h:12 h,光照强度为4 500 lx,每3 h摇瓶一次,以保持藻液中的溶解气体含量[22]。进行预培养后取等量生长状况良好的处于指数生长期的藻种200 mL以1∶10的比例接入如下设定的培养基中[20,23]。考虑到中国近岸海水的营养盐利用及铁浓度的范围,以及赤潮发生的营养盐中氮磷比大小,设置贫磷(磷浓度为0.361 2 μmol·L)和富磷(磷浓度为36.12 μmol·L)两种条件[24],调整培养液中的氮浓度(储存液浓度883 μmol·L-1),使N/P比分别为0∶1、5∶1、20∶1、50∶1。设置培养液中Fe3+浓度梯度分别为10、100、1 000 nmol·L-1。铁浓度使用的是Fe-EDTA浓度表示。需要说明的是设计的N/P比例和Fe计浓度均是外加的,本应该考虑本体海水中的N、P、Fe都有数值,测定其值作为实际培养液中的营养盐确定值,但是由于实验条件限制和本实验主要探究一个变化趋势,没有予以精确化。隔天早上9:00取样进行各项实验,每组实验设2个平行样[23]。
1.2 仪器和色谱条件
6850A型气相色谱仪(GC):配置火焰光度检测器(FPD)(美国安捷伦公司);六通阀(日本岛津公司);高纯氢气发生器(HG-1803A型,北京科普生分析科技有限公司);空气发生器(SGK-2LB,北京东方精华苑科技有限公司);气提室:玻璃圆柱体,底端有砂芯滤板;干燥管:长10 cm的硬质玻璃管,经硅烷化处理,加无水K2CO3;捕集管:管长1.5 m的Teflon-FEP管线;进样器:50 mL(江苏省金坛市第二注射器厂)。
色谱柱:HP-5石英毛细管柱(30 m × 0.32 mm,0.25 μm);柱温:升温程序为起始温度35 ℃,保持5 min,15 ℃·min-1升温至150℃,保持5 min;载气流速1 mL·min-1,分流比10∶1;检测器所用空气流速60 mL·min-1,氢气流速为50 mL·min-1。
1.3 取样及测定方法
1.3.1 DMS和DMSP的测定 DMS分析是用无菌注射器从培养瓶中取20 mL藻液测定水体中的DMS、颗粒态DMSP(DMSPp)和溶解态DMSP(DMSPd)的含量,取样时不需要摇晃锥形瓶,以防易挥发的DMS的损失和保持各实验组的平行。取1 mL藻液定容到250 mL容量瓶中,然后按照杨桂朋等[25]的吹扫-捕集气相色谱法进行测定。DMSP在pH大于13的强碱条件下按1∶1的比例完全降解为DMS,故每次取8 mL藻液在重力作用下用玻璃纤维滤膜(Whatman GF/F,25 mm)滤入体积为42 mL的样品瓶中(已加入2 mL 10 mol·L-1KOH),加入蒸馏水顶空,避光冷藏24 h后取出,进行DMS的测定,得到结果减去样品中本身含有的DMS浓度,以间接获得样品中DMSPd和DMSPp的浓度[23]。
1.3.2 藻细胞密度的测定 藻细胞密度的测定:用Lugol碘液对藻细胞固定、染色,然后用光学显微镜(OLYMPUS-CX31)进行计数,每个样品做3个平行样,取其平均值。
1.4 数据分析
采用t-test对不同N/P比与不同Fe 浓度下的各细胞密度、DMSP和DMS含量采用SPSS软件进行差异性分析。
2 结果与讨论
2.1 不同 N/P比对两种藻细胞密度和DMSP、DMS生产的影响
2.1.1 N/P比对细胞密度的影响 尖刺拟菱形藻在富磷时,N/P比为5∶1、20∶1和50∶1条件下细胞密度没有很明显的差别(见图1);在贫磷情况下,四种N/P之间有明显差异(P<0.05),N/P比为50∶1时细胞密度明显最大(P<0.05),峰值为355.6×104cell·mL-1,并且同样的N/P比在贫磷时细胞密度要比在富磷时大一些。塔玛亚历山大藻到达细胞密度峰值的时间较长。在富磷条件下,第20 d N/P比为50∶1的实验组最早进入指数生长期,其最大细胞密度(186.87×104cell·mL-1)明显大于其余三组N/P比实验组的最大细胞密度;贫磷时,细胞密度小于富磷条件下的细胞密度,并且N/P比为5∶1时的细胞密度明显最大(P<0.05)。硝酸盐对甲藻的影响先前在大鹏湾海域有过报道[26],氮是重要的限制因素。以上探究可知,并不是N/P比越大细胞密度会相应变大,微藻在到达最合适的N/P比之前,生长速率与N/P比有正相关的关系,但是超过最适宜比例后,并不能同等的增强细胞密度的繁殖,磷营养消耗殆尽后,比例失调会使藻过量的吸收氮营养,这样对细胞生长没有好处[27]。
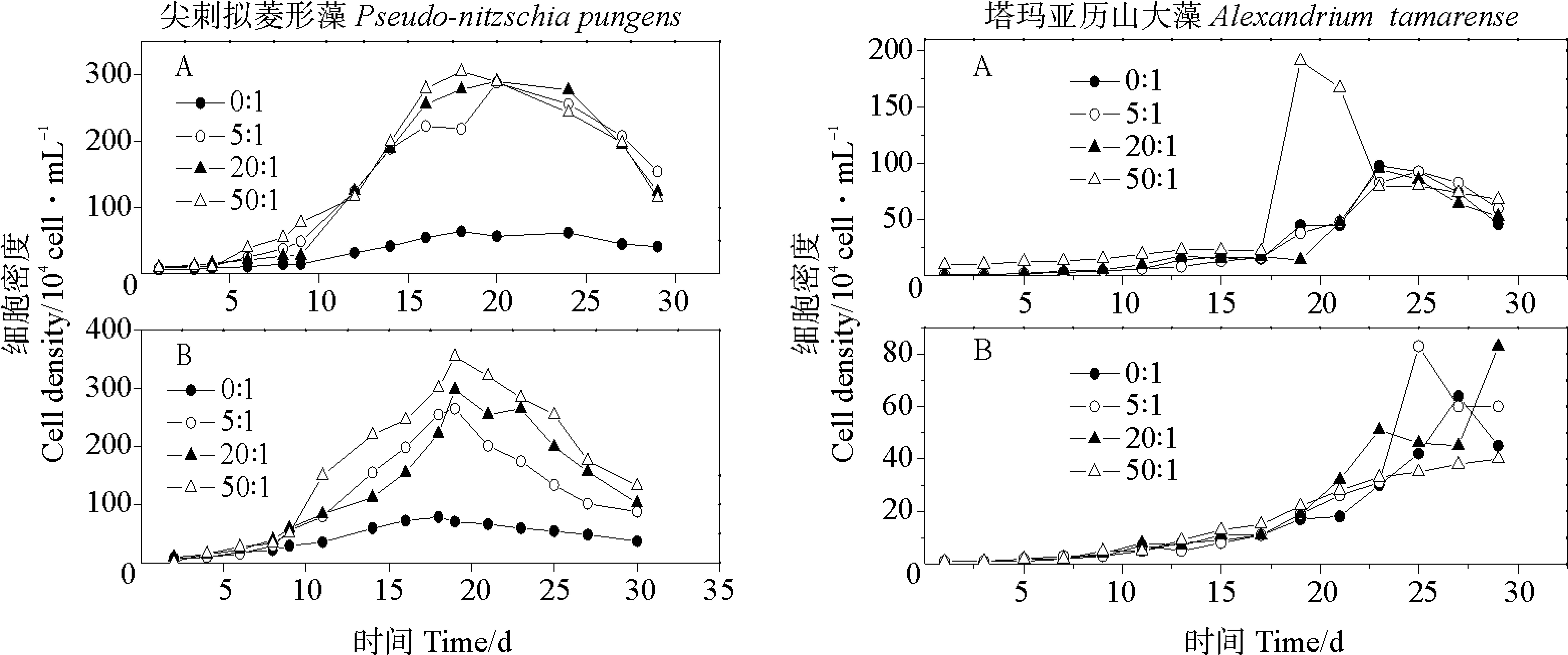
(A.富磷Phosphorus-replete;B.贫磷Phosphorus-deplete)图1 在不同N/P比条件下两种微藻培养液中细胞密度的变化Fig.1 Variations of species cell densities in two algal cultures under different N/P ratio conditions
两种海洋微藻在不同的N/P比条件下DMSP的生产情况如图2和3所示。N/P比的变化对两种藻DMSPd和DMSPp浓度的影响程度不同。尖刺拟菱形藻生产DMSPd在不同N/P比和磷水平条件下没有很明显的差异,在经历了快速生长期后,进入了较长的稳定生长期和较不明显的衰老期,这说明氮营养和磷营养对DMSPd的释放没有明显影响。同样,DMSPp表现出了相似的变化趋势,也可以看出DMSP的生产对氮和磷没有明显的响应。塔玛亚历山大藻产生的DMSP浓度在经历了近10d的缓慢生长期后,在稳定生长后期才有峰值,这可能与其有较大的细胞粒径关系密切。富磷时,DMSPp浓度在N/P比为50∶1时有最大的峰值13 625 nmol·L-1,但是之后下降很明显。贫磷时,N/P比为0∶1的DMSPp浓度明显最大,这说明在有些时候营养水平不高但是比例合适时也会有高的DMSPp值。还有一种可能,海水中氮缺乏导致藻细胞中DMSP含量提高,这可能由于前体蛋氨酸经过转氨基和还原作用生成MTHB,S-腺苷-甲硫氨酸转甲基化分解出来的甲基同MTHB合成产物经过氧化和脱羧生成DMSP这一合成机制[28]。

(A.富磷Phosphorus-replete;B.贫磷Phosphorus-deplete)图2 不同N/P比条件下两种微藻培养液中DMSPd变化Fig.2 Variations of DMSPd concentrations in two algal cultures under different N/P ratio conditions
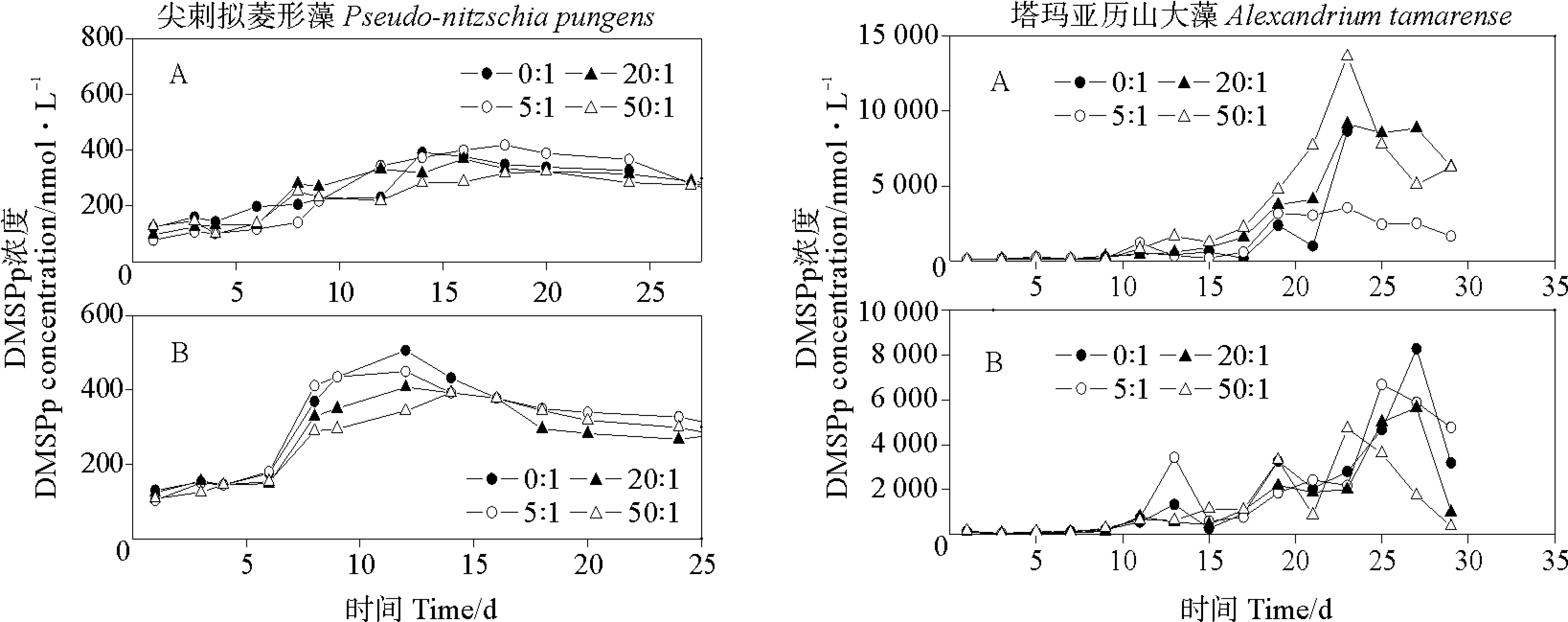
(A.富磷Phosphorus-replete;B.贫磷Phosphorus-deplete)图3 不同N/P比条件下两种微藻培养液中DMSPp变化Fig.3 Variations of DMSPp concentrations in two algal cultures under different N/P ratio conditions
实验结果证明,在营养盐较充足时,N/P比在0∶1~50∶1之间改变对两种藻的影响并不大,DMSP的产生虽然同N/P比相关,但更重要的是水体中的氮营养和磷营养是否到了一个临界值。在临界水平下,就算是在最适合的氮磷比,DMSP的生产依然较低;相反地,在营养盐比较充足的时候,即使没达到最适合的N/P比,其他条件都很优越的时候,藻释放DMSP浓度也会较高。朱蓉等[23]在研究球形棕囊藻产生DMSP时,也得到了相似的结果,如果通过改变营养盐比例来观察限制因素对微藻生产DMSP情况的影响,只能表明这种营养物质时首先得以消耗,但是不能确定此营养物质低就是限制微藻生长的临界,也可能虽然其值很低但还是高于临界值,能保证浮游植物的正常生长。所以其实N/P比不能确定富养水体的赤潮暴发,这个时候的氮磷水平超过了藻类可以吸收的最大值[29]。由此可知,浮游植物产生DMSP先取决于对营养的整体需要,其次是营养比例。在藻缺少铁和锰等物质时,即使最合适的盐度、光照、pH和最基本的营养盐条件下不会有密集的种群密度,也不会产生较多的DMSP[30]。
图4是两种微藻不同的N/P比条件下的DMS浓度变化。尖刺拟菱形藻的磷浓度变化对DMS的生产没有影响,富磷时,在N/P比在0∶1、5∶1和20∶1条件下DMS浓度没有明显的差异(P>0.05),但是均高于N/P比为50∶1情况下的DMS浓度;贫磷时,N/P比为50∶1时的最大DMS浓度明显较小,最大值仅仅有38.48 nmol·L-1,其他三组实验组之间的DMS浓度没有明显的差别,说明在低的N/P比时就有较多的DMS产生。塔玛亚历山大藻的DMS浓度变化比较特殊,开始生长速率特别小,并且有很长的缓慢生长期,在12~14 d时到达了峰值后,迅速减小,15 d时又恢复到很慢的生长情况。无论是富磷还是贫磷,都是在N/P比为0∶1时有较高的DMS浓度,富磷条件时峰值峰值在13 d,达到525.76 nmol·L-1;相同,贫磷时峰值也是在13 d到达峰值487.92 nmol·L-1。生物生产DMS在不同生长阶段的变化最主要与DMSP的浓度和DMSP裂解酶的活性有关系。
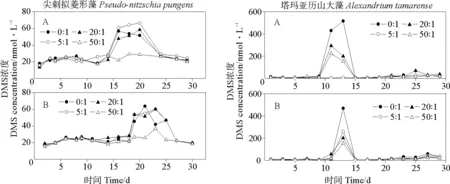
(A.富磷Phosphorus-replete;B.贫磷Phosphorus-deplete)图4 不同N/P比条件下两种微藻培养液中DMS变化Fig.4 Variations of DMS concentrations in two algal cultures under different N/P ratio conditions
由以上结果可知,氮限制对两种藻的DMS释放有促进作用,而磷浓度变化却对两者DMS释放影响不大。这与朱蓉等[23]对球形棕囊藻的研究结果略有差别,其认为低氮、富磷条件能够促进球形棕囊藻DMS和DMSP的生产。在海洋中的浮游植物,若是N/P比<10∶1时,可以看成氮限制条件,而N/P比>20∶1,则被看成磷限制条件的[31]。不同微藻对氮的适应性是决定藻类在海洋中DMS生产占有优势程度的重要因素。Sunda等[32]发现氮限制时,DMS含量有明显的提高,DMSP和DMS可以成为一个抗氧化体系,能够对抗细胞内的自由基。我们知道,DMSP浓度的增加或者DMSP转化为DMS,可以调节紫外照射和碳限制等氧化压力源对藻的生长产生的影响。由于氮限制能降低酶的合成和修复[33],并且减小光合作用[34],这样氮减小成为了一种氧化源,为了平衡,浮游植物细胞内DMSP会增加或转化成DMS。此外,氮浓度较小,细胞体内氮类的渗透压剂会减少,这时候DMSP可以代替其发挥作用,促进了DMS释放[35]。
2.2 不同Fe3+浓度对两种藻细胞密度和DMSP、DMS生产的影响
2.2.1 Fe3+浓度对两种藻细胞密度的影响 两种微藻在不同铁浓度下,细胞密度的动态变化如图5所示。在Fe3+浓度为10、100、1 000 nmol·L-1培养液中,尖刺拟菱形藻的细胞密度均在第17 d到达峰值,分别为77.98、93.47 、236.75 nmol·L-1。Fe3+浓度为1 000 nmol·L-1时培养液的细胞密度明显高于Fe3+浓度为10、100 nmol·L-1时的培养液中的细胞密度(P<0.05)。在三种Fe3+浓度培养液中,塔玛亚历山大藻细胞密度分别于13、16 d达到最大值,为248.17、240.57、397.38 nmol·L-1,Fe3+浓度为1 000 nmol·L-1培养液的细胞密度明显最高(P<0.05)。由此看出,Fe3+浓度的变化对两种微藻的生长皆有影响,缺铁会导致细胞分裂的减慢。铁是不可缺乏的,大部分铁以铁蛋白的形式贮存在叶绿体中[36]。其不仅是对微藻的光合作用有很大的作用,而且铁又能组成硝酸盐还原酶,能增强微藻对硝酸盐的还原和转移,从而影响浮游植物吸收氮营养盐。虽然水中铁的生物可利用具有明显的种间差异,各浮游植物的临界最适合铁浓度会有很大不同,但尖刺拟菱形藻和塔玛亚历山大藻的细胞密度均在铁浓度为1 000 nmol·L-1时明显增加,可利用铁临界为1 000 nmol·L-1。

图5 不同Fe3+浓度条件下两种微藻培养液中细胞密度的变化 Fig.5 Variations of species cell densities in two algal cultures under different Fe3+ concentration conditions
天然海水中的铁浓度应该是很难满足大多数微藻的需要,表现出铁限制状态[37],外加的铁元素能够帮助微藻的生长[38]。铁是通过合成还原酶和促进光合作用[39],间接影响微藻的生长、叶绿素a的合成、同化作用[40]和对碳氮的固定[41]。
图6和7显示了铁浓度变化对两种藻培养液中的DMSPd和DMSPp的生产的影响。尖刺拟菱形藻在Fe3+浓度为1 000 nmol·L-1的培养液中的DMSPd浓度明显最高(P<0.05),峰值达到了1 136.78 nmol·L-1,而其他两组实验组之间并没有明显的差别(P>0.05)。塔玛亚历山大藻中DMSPd峰值出现的较晚(17d),这与细胞密度趋势相似;三组Fe3+浓度培养液中的DMSPd值并没有明显的差异(P>0.05),这说明铁浓度的改变对塔玛亚历山大藻生产DMSPd没有明显的影响。
总之,铁浓度变化对浮游植物释放DMSPd的影响不相同。较高的铁浓度对尖刺拟菱形藻释放DMSPd有帮助,这可能由于其归属于硅藻纲;相反,在塔玛亚历山大藻的整个实验周期内,铁浓度的升高反而会阻碍微藻产生DMSP。
由图7可知,尖刺拟菱形藻培养液中,虽然能看出随着Fe3+浓度的升高,峰值也变大,但是差异性分析结果表明三种Fe3+浓度下的DMSPp浓度之间并没有显著差异性(P>0.05),说明尖刺拟菱形藻中DMSPp的合成没有受到Fe3+浓度影响。塔玛亚历山大藻在Fe3+浓度为100 nmol·L-1的藻液中的DMSPp平均浓度是Fe3+浓度为1 000 nmol·L-1的藻液中的DMSPp平均值的1.3倍。总结以上结论,Fe3+浓度的改变对DMSPp的合成有一定的影响。中间浓度的Fe3+浓度对塔玛亚历山大藻产生DMSPp有利,另外,尖刺拟菱形藻中DMSPp的合成与Fe3+浓度关系不大。

图6 不同Fe3+浓度条件下两种微藻培养液中DMSPd的变化 Fig.6 Variations of DMSPd concentrations in two algal cultures under different Fe3+ concentration conditions

图7 不同Fe3+浓度条件下两种微藻培养液中DMSPp的变化Fig.7 Variations of DMSPp concentrations in two algal cultures underdifferent Fe3+ concentration conditions
如图8所示,不同Fe3+浓度下的两种藻释放DMS的变化趋势。尖刺拟菱形藻的峰型很规则,三组实验都在17 d到达峰值,从低到高Fe3+浓度条件下,DMS释放量比值为1∶1.3∶1.6,Fe3+浓度升高,藻的DMS生产力也提升。塔玛亚历山大藻的DMS动态变化曲线呈现规则状,从低到高Fe3+浓度条件下,DMS的平均值分别为18.34、21.57和13.77 nmol·L-1。在较高铁浓度时,尖刺拟菱形藻和塔玛亚历山大藻明显有助于DMS的释放,因为在细胞内氧自由基的清除由SOD和过氧化氢酶完成。在缺铁的细胞中,SOD和过氧化氢酶浓度降低[42],这样缺铁的细胞更易受到氧自由基的破坏,不利于DMS和DMSP的产生。
由于硝酸盐的还原酶中含有铁原子,铁的浓度会影响硝酸盐的吸收[43,44],所以也会改变DMSP的产量和DMS的释放量[23]。Van Leeuwe等[45]对南极棕囊藻属(Phaeocystis)研究发现,铁会不同程度地影响碳和硝酸盐的同化,也可影响细胞内的生物化学成分。在不同的光照和铁浓度下,存在还原能力的竞争现象。所以,铁浓度的改变会影响还原剂的供给,使细胞内碳固定、氮合并、氨基酸的合成均受到影响[23]。作为藻细胞内重要碳源的DMSP[46],培养液中不同初始铁浓度会影响到细胞内DMSP的合成和DMS的释放。铁浓度对于DMSP生产的影响程度具有种间差异性,不同微藻细胞内铁在DMSP合成过程中的作用还需要更加深入的探讨。
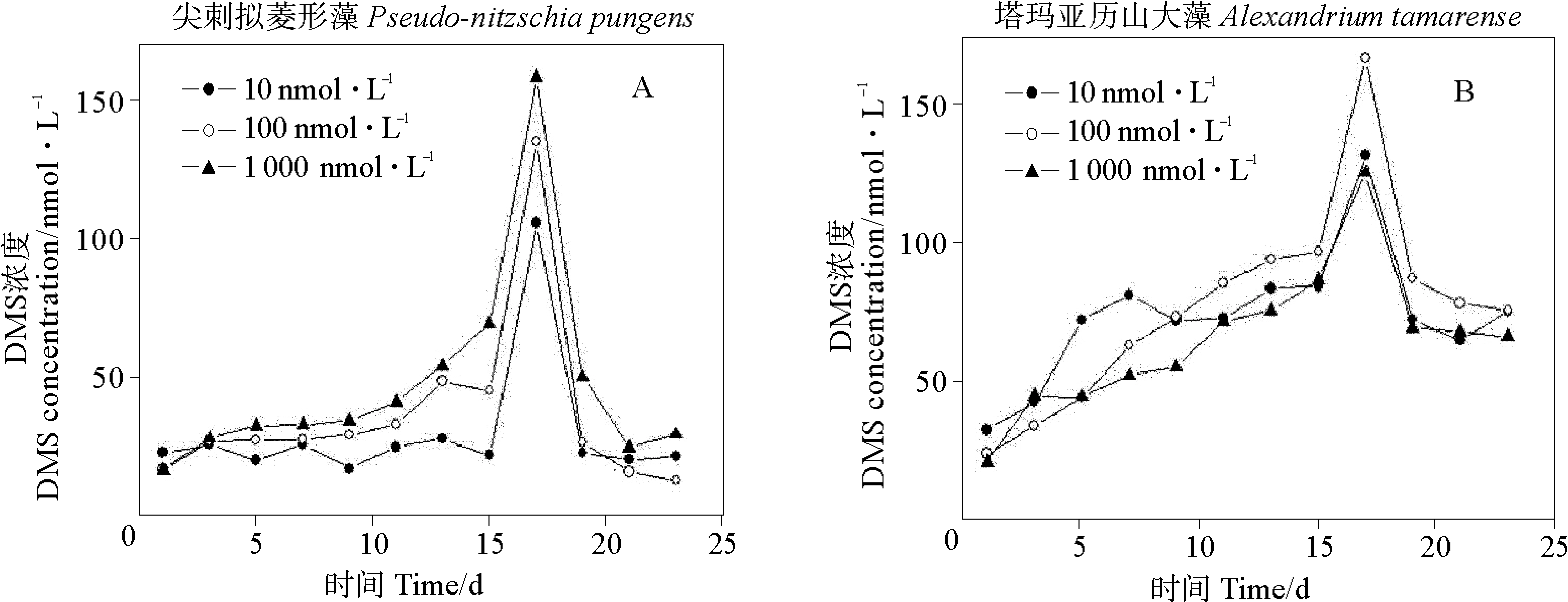
图8 不同Fe3+条件下两种微藻培养液中DMS的变化Fig.8 Variations of DMS concentrations in two algal cultures under different Fe3+ concentration conditions
3 结语
通过实验室培养实验研究了不同氮磷比以及铁浓度对尖刺拟菱形藻、塔玛亚历山大藻DMS和DMSP产生的影响,结果表明尖刺拟菱形藻在贫磷情况下,N/P比为50∶1时细胞密度明显最大;塔玛亚历山大藻在富磷条件下,N/P比为50∶1的最早进入指数生长期,并且有最大细胞密度。氮营养和磷营养没有成为尖刺拟菱形藻生产DMSP浓度的限制因子,还有另外的原因会导致DMSP的变化;塔玛亚历山大藻受N/P比的影响最显著,低N/P比条件下的DMS浓度是高N/P比条件下的2.5倍。
培养液中Fe3+浓度水平的提高明显促进尖刺拟菱形藻和塔玛亚历山大藻细胞的生长。高Fe3+浓度有助于尖刺拟菱形藻藻液中DMSPd的形成,却抑制了塔玛亚历山大藻细胞内DMSP的生产。高Fe3+浓度明显提高尖刺拟菱形藻中DMS的产量。
总体来说,在DMSP和DMS的生产过程中海洋微藻扮演着重要角色,并受到营养盐条件和Fe3+浓度的显著影响。研究结果将有助于揭示我国近海微藻生产DMS的情况,进而评价其在海洋生源硫的生物地球化学循环过程中所起的重要作用。
