红光与远红光比值对盐胁迫下番茄幼苗抗氧化能力的影响
2018-10-16艾楷棋何雅倩杨俊伟王云龙邹志荣
于 捷,艾楷棋,何雅倩,杨俊伟,曹 凯,王云龙,邹志荣*
(1 广西中农富玉国际农业科技有限公司, 广西玉林 537000;2 西北农林科技大学 园艺学院,农业部西北设施园艺工程重点实验室,陕西杨陵 712100)
番茄(SolanumlycopersicumL.)是设施内广泛种植的一种蔬菜。近年来设施蔬菜集约化经营管理使设施内土壤次生盐渍化程度不断加重,过度耕作、大量施肥以及缺乏雨水淋洗等因素都加剧了设施内土壤的盐渍化程度。盐碱胁迫是影响设施作物的主要非生物逆境之一,己成为限制中国番茄等蔬菜作物优质高效生产的主要因素[1]。
盐胁迫严重影响植物的生长发育,对植物的危害主要为渗透胁迫和离子毒害。盐胁迫的渗透胁迫效应指当培养介质中盐分含量过高时,其水势相应降低,使植物根系吸收水分困难。盐胁迫的离子毒害效应则主要体现在两个方面:一是氧自由基对膜脂的破坏作用,即细胞内盐离子过量积累,会造成氧自由基产生与清除之间的动态平衡被破坏,引发或加剧膜脂过氧化和膜脂脱脂化作用,危害植物正常的生理活动[2];二是过量的Na+可取代质膜和细胞内膜上的Ca2+,膜结构破坏及功能改变,质膜透性加大,致使细胞内钾、磷和有机溶质外渗,使离子平衡失调,进而抑制植物的生长发育[3]。
光敏色素是植物中重要的光受体,主要吸收红光和远红光,它在调控植株的生长发育中起重要作用。光敏色素有两种构型:红光吸收型(Pr)和远红光吸收型(Pfr),这两种构型在红光(R)和远红光(FR)的驱动下可以相互转换,并承载着相应的信号影响基因的表达,红光与远红光比值(R∶FR)是影响光敏色素构型的一个重要参数。日光的R∶FR值大概为1.15,在不同环境下或一年中的不同时间变化都很小[4]。当植物在遮阴环境下,R∶FR值会降到0.05~0.7,引起光敏色素构型的变化,诱发植物典型的避阴反应[5]。当今设施栽培中常用LED灯作为人工光源,白色LED灯的R∶FR值通常在6以上[6]。光敏色素作为在植物发育过程中能控制许多步骤的一种分子,在胁迫中也会起到重要作用。近年来许多研究发现,光敏色素参与调控植物应对病原菌、虫害等生物胁迫,以及冷害、高温、干旱和盐害等非生物胁迫的抗性机制[7-8]。尤其在阐明光敏色素参与盐胁迫反应上已取得了初步成果[9]。
光敏色素是由一个很小的基因家族编码的,每个基因在介导对光信号的响应时都有各自独特的功能,同时还会有部分相互冗余的功能。其中,对phyB1基因核心功能的研究发现,白光下phyB1对胚轴伸长具有明显的抑制作用[10],并且在调节玉米成熟植株的茎组织的伸长中起主要作用[11]。赵杰等还发现phyB1介导的R信号在叶绿素合成及叶绿体膜发育中均具有重要作用[12]。近些年,phyB1基因在胁迫中的功能也被逐渐探索和发现,Gavassi等研究表明phyB1在渗透调节物质的积累中起作用,如甜菜碱等,以应对干旱胁迫和盐胁迫下植物的水分丢失[13]。
对抗氧化系统的诱导是胁迫环境下光敏色素最明显的反应[14]。抗氧化酶,如过氧化物酶,是已经发现的胁迫条件下通过光敏色素进行调节的抗氧化物[15]。但是至今还没有phyB1在不同R∶FR值下对受盐胁迫番茄抗氧化能力调节的研究。因此,本试验拟通过设置不同R∶FR值的光质来处理番茄品种‘Money Maker’的野生种和phyB1突变体,研究phyB1在植物抵抗盐胁迫中的作用。
1 材料和方法
1.1 实验地点及材料
试验于2016年4月~2017年9月在陕西省杨凌示范区西北农林科技大学南校区科研温室植物工厂内进行。植物工厂及其控制系统均由陕西旭田光电科技有限公司生产,内设4个培养架,每个3层,每层长145 cm、宽60 cm、高40.5 cm。温度可控范围为16~45 ℃,空气在每层培养架内实现环流,每层培养架光照系统自动控制。试验材料为番茄品种‘Money Maker’野生型和以‘Money Maker’为背景的phyB1突变体,试验采用的营养液配方为山崎番茄专用配方。LED补光灯由东莞市广盈电子有限公司生产,白色LED灯为每根18 W,远红色LED灯为每根30 W。
1.2 实验处理
挑选长势一致的2叶1心期的番茄幼苗,将其根部基质清洗干净后定植于植物工厂培养架上,进行深液流水培,培养液为1/2山崎番茄营养液(pH 6.2~6.5),株距为10 cm,行距为15 cm,每个处理种植36株,重复3次。白天白色LED灯光照12 h(8:00~20:00),温度为26~28 ℃,光照强度约为(200±20)μmol·m-2·s-1;夜间12 h,温度为18~20 ℃。营养液每0.5 h内运行15 min,停止15 min,在24 h内如此循环。白天打开风扇使空气环流。缓苗6 d后开始试验处理。本试验设置4个不同处理,即T1(盐胁迫),光源为白色LED(红光∶远红光=7.4,即R∶FR=7.4),并在营养液中添加100 mmol·L-1NaCl;T2(盐胁迫+ 1.2R∶FR),光源为白色LED+远红光LED(调节光强使R∶FR=1.2),并在营养液中添加100 mmol·L-1NaCl;T3(盐胁迫+ 0.8R∶FR),光源为白色LED+远红光LED(调节光强使R∶FR=0.8),并在正常营养液中添加100 mmol·L-1NaCl;CK(对照),光源为白色LED(R∶FR=7.4),正常营养液栽培。处理和对照中不同R∶FR值的光源每天处理时间均为12 h(8:00~20:00)。
1.3 测定指标及方法
野生型和phyB1突变体处理后第8天,每个处理随机选择6个植株,测定番茄幼苗的根生长指标以及叶和根的相对电解质渗透率。在处理后0、2、4、6和8 d取野生型番茄植株去叶脉的新鲜叶和根,另外在处理后8 d取phyB1突变体番茄植株去叶脉的新鲜叶和根,样品剪碎后置于-80 ℃中保存,用于测定可溶性蛋白、脯氨酸、超氧阴离子、H2O2、MDA的含量以及SOD、POD和CAT活性,重复6次。
1.3.1光照强度和光谱用光谱辐射计(Model PS-100, Apogee Instruments Inc., Logan, Utah, U.S.)测定白色和远红色LED的光照强度和光谱。如图1所示,CK和T1为白色LED,光合有效辐射(400~700 nm)为200 μmol·m-2·s-1,光环境中的红光(R,655~665 nm)为2.84 μmol·m-2·s-1,远红光(FR,725~735 nm)为0.38 μmol·m-2·s-1,R∶FR=7.4;T2为白色和远红色LED,光合有效辐射为200 μmol·m-2·s-1,光环境中的红光为2.89 μmol·m-2·s-1,远红光为2.39 μmol·m-2·s-1,R∶FR=1.2;T3为白色和远红色LED,光合有效辐射为200 μmol·m-2·s-1,光环境中的红光为2.82 μmol·m-2·s-1,远红光为3.55 μmol·m-2·s-1,R∶FR=0.8。
1.3.2根生长指标从水培槽中取出番茄幼苗,将根从植株上分离开,通过扫描仪(EPSON PERFECTION V700 PHOTO, Seiko Epson Corporation)将完整的根图像扫描存入计算机,采用根分析系统软件(WinRHIZO PRO 2012)分析总根长、总根表面积、根尖数及根叉数等形态学参数。
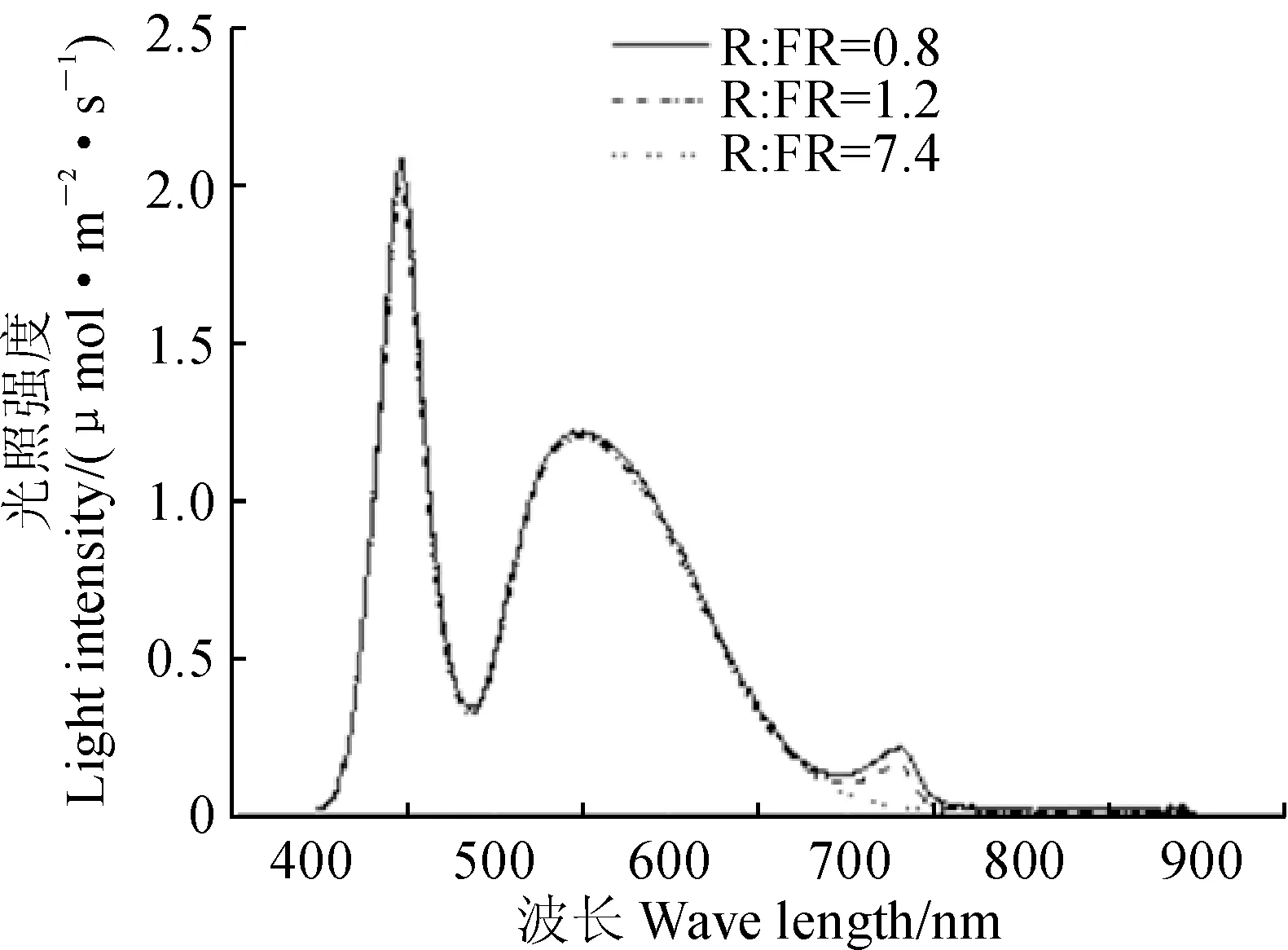
图1 各处理中白色与远红色LED调节光的光照强度和光谱Fig.1 Light intensity and spectrum distribution of the compound light of white and far-red LED
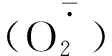
1.4 数据处理
试验数据用SPSS数据处理软件(version 20.0, IBM Inc., USA)中的Duncan新复极差法进行显著性测试(P<0.05),用OriginPro做图软件(version 8.0, Origin Lab, MA, USA)进行图表制作。
2 结果与分析
2.1 R∶FR值对盐胁迫下番茄幼苗根系生长的影响
植物受到盐胁迫时,根最早感受到胁迫信号,也最先受到盐胁迫的伤害。由表1可知,在处理后第8天,盐胁迫处理(T1)番茄幼苗的总根长、总根表面积、根尖数和根叉数均比对照条件下显著减少(P<0.05),降幅分别为40.89%、58.07%、46.94%和50.53%。在盐胁迫条件下再进行低R∶FR值处理(T2和T3),这4个根系生长指标均比T1处理显著增加,且T3处理又均显著高于T2处理,其中T3处理比T1处理分别显著升高了11.95%、41.12%、25.52%和47.94%。同时,由表1还可知,在处理后第8天,phyB1突变体番茄幼苗的总根长、总根表面积、根尖数和分根数在盐胁迫处理(T1)下比同期对照分别显著减少了40.38%、44.34%、45.60%和48.92%;但是,在盐胁迫条件下再进行低R∶FR值处理,phyB1突变体番茄幼苗的4个指标均与T1处理没有显著差异。结果表明,在盐胁迫条件下,降低光环境中的R∶FR值会促进野生型番茄幼苗根系的生长,缓解盐胁迫对根系的伤害,但低R∶FR值对phyB1突变体番茄幼苗根系的盐胁迫伤害没有缓解作用。
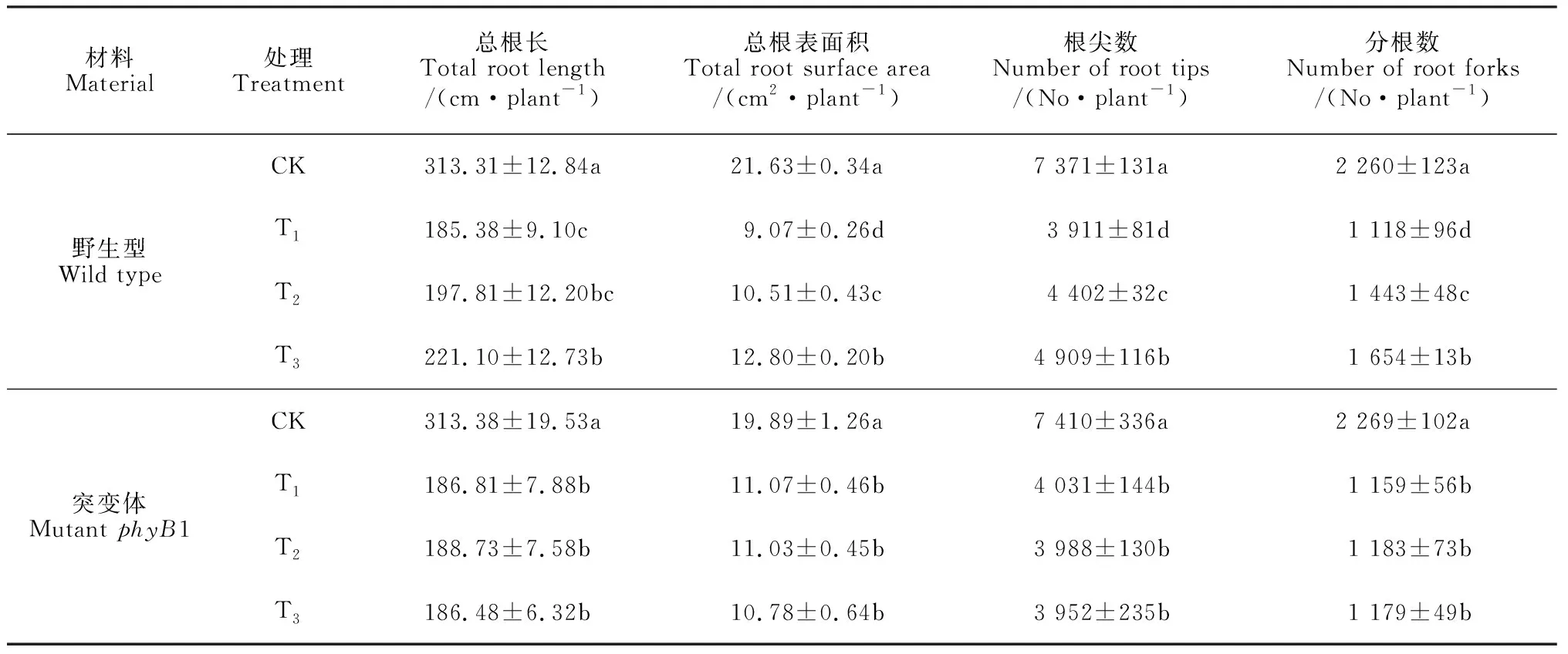
表1 不同R∶FR值对盐胁迫下番茄野生型和突变体幼苗根系生长指标的影响
注: CK.白色LED(R∶FR=7.4) +正常营养液栽培;T1.白色LED(R∶FR=7.4)+100 mmol/L NaCl;T2.白色LED +远红色LED(R∶FR=1.2)+100 mmol/L NaCl;T3.白色LED +远红色LED(R∶FR=0.8)+100 mmol/L NaCl。同列相同材料内不同字母表示处理间在0.05水平存在显著性差异 (P<0.05)
Note: CK. White LED (R∶FR=7.4) +normal nutriculture; T1.white LED (R∶FR=7.4) +100 mmol/L NaCl; T2.White LED +far-red LED (R∶FR=1.2) +100 mmol/L NaCl; T3.White LED +far-red LED (R∶FR=0.8) +100 mmol/L NaCl. Different letters in the same column meant significant difference among treatments within same material at 0.05 level
2.2 R∶FR值对盐胁迫下番茄幼苗渗透调节物质含量的影响
2.2.1可溶性蛋白含量野生型番茄幼苗叶片可溶性蛋白含量在T1处理后4 d内显著升高,在处理4~8 d没有显著变化,但在处理期间显著高于对照;T2和T3处理叶片可溶性蛋白含量在处理期间持续升高,并在处理4~8 d显著高于T1处理,两者在第8天时分别比T1处理显著升高了7.30%和12.43%,且T3处理显著高于T2处理(图2,A)。同时,各处理野生型番茄根中可溶性蛋白含量在处理期间均显著高于同期对照,T1和T2处理均在第6天时达到峰值,T3处理在第8天时达到峰值;第8天时,T2和T3处理分别显著高于T1处理16.67%和22.97%,但T2和T3处理间差异不显著(图2,B)。另外,在处理8 d后,phyB1突变体番茄幼苗叶和根中可溶性蛋白含量在T1处理下分别比对照显著上升了11.67%和30.88%,在T2和T3处理均与T1处理没有显著差异(图2,A、B)。可见,在盐胁迫条件下进行低R∶FR值处理,野生型番茄叶和根中可溶性蛋白含量会进一步升高,并以R∶FR值为0.8时最高;低R∶FR值处理对盐胁迫下phyB1突变体番茄幼苗根叶中可溶性蛋白含量均没有显著影响。
2.2.2脯氨酸含量3个盐胁迫处理野生型番茄幼苗叶和根中脯氨酸含量均随时间延长持续升高,并均显著高于同期对照,而T2和T3处理又始终显著高于同期T1处理,但T2和T3处理间差异多不显著;处理第8天,T2和T3处理叶中脯氨酸含量分别比T1处理显著升高了48.24%和63.73%,根中则分别显著升高了45.86%和57.96%(图2,C、D)。另外,在处理第8天,T1处理phyB1突变体番茄幼苗叶和根中脯氨酸含量分别比对照显著升高了23.29倍和22.10倍,而T2和T3处理均与T1处理没有显著差异(图2,C、D)。以上结果表明,在盐胁迫条件下再进行低R∶FR值处理,野生型番茄叶和根中脯氨酸含量会进一步升高,但在R∶FR值为1.2和0.8的处理间差异不显著;低R∶FR值处理对盐胁迫下phyB1突变体番茄幼苗根叶中脯氨酸含量均没有显著影响。
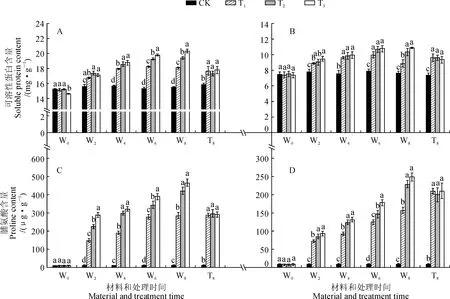
W0、 W2 、W4、W6和 W8分别表示野生型番茄处理0、2、4、6和8 d,T8表示phyB1突变体番茄处理8 d。相同材料相同处理时间下不同字母表示处理间在0.05水平存在显著性差异(P<0.05)。下同图2 不同R∶FR值对盐胁迫下野生型和phyB1突变体番茄叶(A、C)和根(B、D)中可溶性蛋白、脯氨酸含量的影响W0,W2,W4,W6 and W8 stand for wild type tomato treated for 0, 2,4,6 and 8 days, respectively, while T8 represent phyB1 mutant tomato treated for 8 days. Different letters in the same time meant significant difference among treatments within same material at 0.05 level (P<0.05). The same as belowFig.2 Effect of different R∶FR values on contents of soluble protein and proline in wild type and phyB1 mutant tomato leaves (A,C) and roots (B,D) under salt stress
2.3 R∶FR值对盐胁迫下番茄幼苗活性氧含量的影响
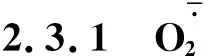
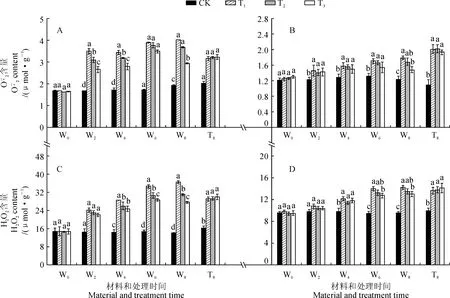
图3 不同R∶FR值对盐胁迫下野生型和phyB1突变体番茄幼苗叶(A、C)和根(B、D)中含量的影响Fig.3 Effect of different R∶FR values on contents of and H2O2 in wild type and phyB1 mutant tomato leaves (A,C) and roots (B,D) under salt stress
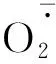
2.4 R∶FR值对盐胁迫下番茄幼苗抗氧化酶活性的影响
2.4.1SOD活性3个盐胁迫处理野生型番茄幼苗叶和根中SOD活性在处理期间随时间延长持续升高,均在第8天达到峰值,并显著高于同期对照,而对照始终保持稳定;T2和T3处理幼苗叶中SOD活性在处理后6~8 d内显著高于同期T1处理,而其根中SOD活性始终显著高于同期T1处理,但T2与T3处理间差异不显著;在处理后第8天,T2和T3处理叶中SOD活性比T1处理分别显著升高了18.58%和23.80%,根中则分别显著升高了19.26%和18.06%(图4,A、B)。另外,在处理后第8天,各处理phyB1突变体番茄幼苗叶和根中SOD活性均比对照显著上升,T1处理增幅分别为28.27%和30.12%,而T2和T3处理与T1处理均没有显著差异(图4,A、B)。
2.4.2POD活性3个盐胁迫处理野生型番茄幼苗叶和根中POD活性与SOD活性变化趋势相似,均随处理时间的延长呈现持续升高的趋势,且始终显著高于同期对照;T2和T3处理叶和根中POD活性均在处理后6~8 d显著高于同期T1处理,且T3处理又显著高于T2处理;处理后第8天,T2和T3处理叶中POD活性比T1处理分别升高了14.87%和24.69%,根中则分别升高了16.58%和22.55%(图4,C、D)。另外,在处理后第8天,各处理phyB1突变体番茄幼苗叶和根中POD活性均比对照显著上升,T1处理增幅分别为167.35%和31.56%,而T2和T3处理均与T1处理无显著差异(图4,C、D)。
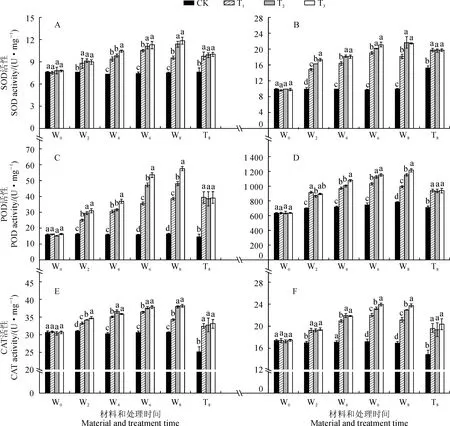
图4 不同R∶FR值对盐胁迫下野生型和phyB1突变体番茄幼苗叶(A、C、E)和根(B、D、F)中SOD、POD、CAT活性影响Fig.4 Effect of different R∶FR values on activities of SOD, POD and CAT in wild type and phyB1 mutant tomato leaves (A,C,E) and roots (B,D,F) under salt stress
2.4.3CAT活性随处理时间的延长,各处理野生型番茄幼苗叶片和根系中CAT活性均呈现升高的趋势,它们均在第6天或者第8天达到峰值,且在处理期间均显著高于同期对照;T2和T3处理叶和根中CAT活性期间始终显著高于同期T1处理,但T2和T3处理间大多差异不显著;在处理后第8天,T2和T3处理叶中CAT活性比T1处理分别升高了10.84%和11.77%,根中则分别升高了8.86%和12.36%(图4,E、F)。另外,在处理后第8天,phyB1突变体番茄幼苗叶和根中CAT活性在T1处理下分别比对照显著上升了38.30%和32.43%,而T2和T3处理均与T1处理没有显著差异(图4,E、F)。
以上结果说明,在盐胁迫条件下进行低R∶FR值处理,野生型番茄叶和根中SOD、POD和CAT活性均会进一步升高,并多以R∶FR值为0.8时最高;低R∶FR值处理对盐胁迫下phyB1突变体番茄幼苗根叶中POD、POD和CAT活性均没有显著影响。
2.5 不同R∶FR值对盐胁迫下番茄幼苗MDA含量和相对电解质渗透率的影响
2.5.1MDA含量3个盐胁迫处理野生型番茄幼苗叶和根中MDA含量均随处理时间的延长呈现升高的趋势,且在处理期间均显著高于对照;T2和T3处理叶和根中MDA含量均在处理后6~8 d显著低于同期T1处理,而T2和T3处理间大多差异不显著;在处理后第8天,T2和T3处理叶中MDA含量比T1处理分别降低了22.12%和30.61%,根中则分别降低了21.95%和28.46%(图5,A、B)。另外,在处理后第8天,各处理phyB1突变体番茄幼苗叶和根中MDA含量均比对照显著上升,T1处理分别升高了132.92%和135.23%,而T2和T3处理均与T1处理没有显著差异(图5,A、B)。可见,低R∶FR值处理可使盐胁迫下野生型番茄叶和根中MDA含量有所降低,并且叶中MDA含量以R∶FR值为0.8时最低;而低R∶FR值处理对盐胁迫下phyB1突变体番茄幼苗根叶中MDA含量均没有显著影响。
2.5.2相对电解质渗透率相对电解质渗透率可反映植物的细胞膜透性。由图6可知,处理后第8天,3个盐胁迫处理野生型番茄幼苗叶和根中相对电解质渗透率显著高于对照,T2和T3处理又显著低于同期T1处理,但T2和T3处理间差异不显著,其中T3处理叶和根中相对电解质渗透率比T1处理分别降低了15.60%和19.74%。另外,处理后第8天,各处理phyB1突变体番茄幼苗叶和根中相对电解质渗透率均比对照显著上升,T1处理分别升高了31.76%和52.75%,而T2和T3处理均与T1处理没有显著差异。因此,低R∶FR值处理可降低盐胁迫下野生型番茄叶和根中相对电解质渗透率,但R∶FR值为0.8和1.2时差异不显著;低R∶FR值处理对盐胁迫下phyB1突变体番茄幼苗根叶中相对电解质渗透率均没有显著影响。
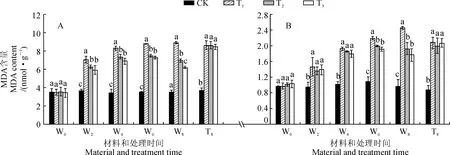
图5 不同R∶FR值对盐胁迫下野生型和phyB1突变体番茄幼苗叶(A)和根(B)中MDA含量的影响Fig.5 Effect of different R∶FR values on content of MDA in wild type and phyB1 mutant tomato leaves (A) and roots (B) under salt stress
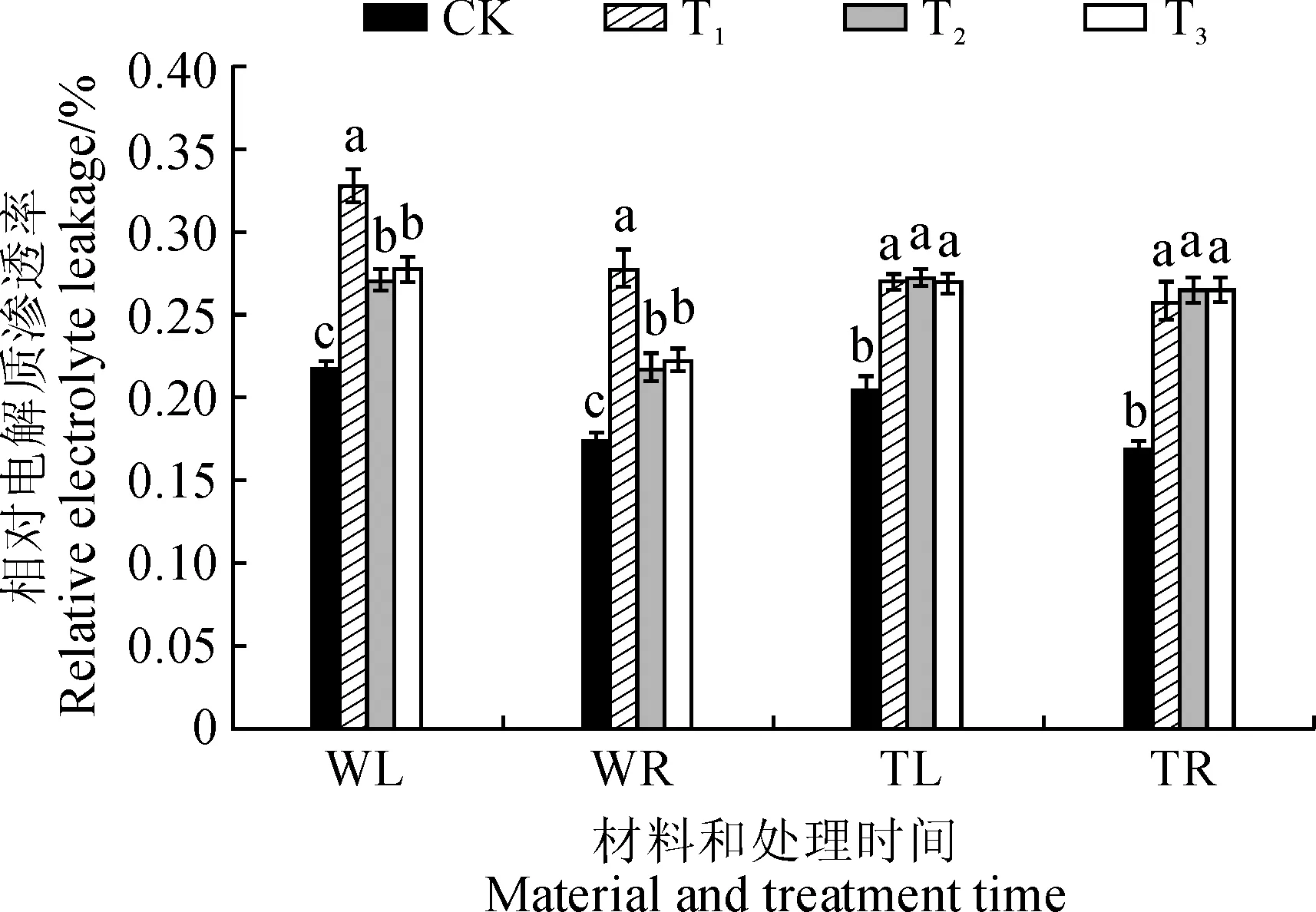
WL.野生型番茄叶片;WR.野生型番茄根系;TL.phyB1突变体番茄叶片;TR.phyB1突变体番茄根系图6 不同R∶FR值对盐胁迫下野生型和phyB1突变体番茄幼苗叶根相对电解质渗透率的影响WL.wild type tomato leaves; WR.wild type tomato root; TL.phyB1 mutant tomato leaves; TR.phyB1 mutant tomato rootFig.6 Effect of different R∶FR values on content of relative electrolyte leakage in wild type and phyB1 mutant tomato leaves and roots under salt stress
3 讨 论
根系是最早感受盐胁迫逆境,也是最直接的受害部位。当植物受到盐胁迫时,根系最先感应到胁迫信号并迅速发出信号,使整个植株对盐胁迫作出反应,同时根系的形态结构也发生相应变化[22-23]。本试验中,番茄幼苗的总根长、总根表面积、根尖数和分根数等根系指标在盐胁迫下显著下降(P<0.05),而当光环境中的R∶FR值降低到1.2时均显著上升,当R∶FR值为0.8时又均较R∶FR值为1.2时显著上升。表明低R∶FR比值的光环境缓解了盐胁迫对番茄幼苗根系造成的伤害,且R∶FR值为0.8时优于1.2。同时,phyB1突变体在相同处理下表现出不同现象,降低R∶FR比值对盐胁迫幼苗的根系指标无显著影响。除此之外,光敏色素对根系的生长发育还有多方面的影响。Casal在对烟草的研究中发现,光敏色素会影响木质部导管的数量和直径[24];Salisbury发现在低R∶FR值光照下,侧根的发生率升高,在这个过程中phyB起到重要作用[25];de Simone研究发现phyB介导了持续远红光作用下拟南芥根毛数量的增加[26]。
盐胁迫下,植物通过积累一定的渗透保护物质(如可溶性蛋白、脯氨酸等)来响应渗透胁迫,也被称为渗透协调溶质,因为它们即使呈高浓度时,仍不会参与改变酶活性的相关反应。这些物质存在于细胞质中,在渗透胁迫下可以维持细胞膨胀[27]。Cockburn研究发现降低R∶FR值可增加松醇、可溶性碳水化合物的积累量,以此来提高植物的耐盐性[28]。本实验中也发现,盐胁迫下番茄的根和叶中的可溶性蛋白和脯氨酸含量在低R∶FR值处理中持续升高,并高于盐胁迫处理植株。说明低R∶FR值处理能使盐胁迫下多种渗透性物质的含量上升,从而缓解细胞的渗透胁迫,提高番茄的耐盐性。
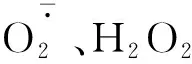
光敏色素参与植物对多种生物胁迫和非生物胁迫反应[37-40]。番茄中有5种光敏色素基因,分别为phyA、phyB1、phyB2、phyE和phyF[41],phyB1主要参与对红光和远红光的响应,控制下胚轴的伸长、生长素的积累、子叶的展开、开花过程和非生物胁迫的耐受性[37, 42]。本研究表明不同R∶FR值对野生番茄种苗的耐盐性有显著影响,然而这种影响在phyB1突变体中消失,从而证明低的R∶FR环境通过光敏色素B1提高了番茄的耐盐性。虽然在非生物胁迫下光敏色素的作用还有很多是未知的,有很多报道表明光敏色素参与植物中的非生物胁迫反应,调节胁迫条件下抗氧化酶(如POD等)活性和非酶抗氧化物(如抗坏血酸、类胡萝卜素和类黄酮等)含量[37, 40]。有研究表明,植物在不同R∶FR值下能调节激素的合成(赤霉素、生长素、细胞分裂素和脱落酸),这些激素都参与了植物的耐盐反应[43-44]。此外光敏色素还调节一些参与耐盐性蛋白的表达[11]。这些发现表明了光敏色素和耐盐性之间的显著关联,其中可能包含了一个复杂的信号网络。
综上所述,本研究探讨了不同R∶FR值对番茄盐胁迫的影响,结果表明低R∶FR值能显著缓解番茄盐胁迫导致的氧化伤害,通过调节抗氧化酶活性,增强了清除活性氧能力,同时提高了渗透调节物质含量,提高了野生型番茄的抗氧化能力,进而促进了番茄幼苗的生长,增强了番茄幼苗的耐盐能力。同时,在phyB1突变体番茄植株中,低R∶FR比值的光环境对NaCl胁迫下番茄根系生长、根叶渗透调节物质含量、根叶活性氧的清除和抗氧化酶活性的促进作用均消失,从而证明phyB1基因在调节盐胁迫下番茄植株根系生长、渗透调节和抗氧化系统方面均有重要作用。本研究结果也为今后光质和盐胁迫之间的关系或盐胁迫对其他作物的影响的探索提供了依据。
