茶树水通道蛋白基因的克隆与表达分析
2018-10-16曹红利林宏政叶乃兴
岳 川,曹红利,王 赞,陈 丹,林宏政,孙 云,叶乃兴
(福建农林大学 园艺学院,茶学福建省高校重点实验室,福州 350002)
水通道蛋白(aquaporin, AQP)是生物体内广泛存在的一种膜内在蛋白。第一个植物AQP基因从拟南芥中分离出来后,植物中的AQP已被广泛报道,且发现其主要以多基因家族的形式存在,如拟南芥、玉米和番茄等植物中均含30个以上的AQP编码基因[1]。根据亚细胞定位和序列同源性分析结果,AQP可以分为5种类型,即质膜内在蛋白(PIPs)、液泡膜内在蛋白(TIPs)、根瘤菌-26内在蛋白(NIPs)、小的碱性膜内在蛋白(SIPs)以及新型的膜内在蛋白(XIPs)[2]。在植物中,AQP不仅能够调控水分子的跨膜运输,还能够选择性地转运甘油、二氧化碳、尿素、氨、硼酸、硅酸、过氧化氢和亚砷酸盐等小分子物质[1-3]。大量研究发现,AQP在种子休眠、细胞伸长、气孔运动、体内物质运输以及有性生殖等生长发育中发挥重要作用,同时还广泛参与了植物的抗逆响应。研究者前期报道了茶树中20个CsAQPs基因,研究显示它们与茶树的芽休眠和开花调控以及干旱、低温和盐等多种逆境胁迫响应密切相关[4]。本研究进一步挖掘克隆茶树中的CsAQPs基因,分析它们在不同组织中的表达规律,以及在干旱、低温、高盐和ABA等胁迫诱导中的表达模式,为全面揭示CsAQPs基因在茶树抗逆响应中的作用奠定基础。
1 材料和方法
1.1 材料及处理
本试验所用材料为生长健壮的2年生茶树品种‘龙井43’。茶苗盆栽种植于福建农林大学南区教学茶厂温室内,自然光照,温度控制在25~28 ℃。随机选取3株生长健壮的茶苗,迅速从盆中取出,用大量自来水洗去根部土壤等污染物,分别剪取幼嫩根部、成熟叶和顶端1~2 cm嫩茎,液氮速冻后提取RNA,用于检测基因的组织表达特异性。参照曹红利等[5]的方法分别进行ABA(100 μmol/L)、干旱[10%(w/v)PEG]、低温(4 ℃)和高盐(250 mmol/L NaCl)等胁迫处理。分别于处理后0、3、9和24 h取顶端第2~3片成熟叶为材料,提取RNA,测定目标基因的表达水平变化。在相应时间点取正常生长的茶树叶片作为对照。每个处理进行3次生物学重复。
按照天根多糖多酚植物总RNA提取试剂盒的方法步骤,用约0.1 g样品为材料提取茶树总RNA,测定RNA浓度及电泳检测完整性后,调整浓度到500 ng/μL,用于合成cDNA进行荧光定量PCR(qRT-PCR)检测和RT-PCR扩增验证。
1.2 方 法
1.2.1茶树CsAQPs基因的查找与克隆根据前期转录组数据(NCBI登录号:SRP134145)的注释结果,筛选茶树CsAQPs基因序列,序列经拼接后在NCBI中进行Blastx同源比对,并结合DNAMAN软件查找开放阅读框(ORF)。在ORF上下游设计引物(表1),以‘龙井43’茶树cDNA为模板,按照PrimeSTAR HS试剂盒说明书操作步骤进行,采用50 μL PCR体系扩增,PCR程序为:98 ℃ 10 s,55 ℃ 5 s,72 ℃ 90 s,共30个循环。扩增产物回收,转化进入大肠杆菌,挑取2个经抗性培养基筛选的阳性克隆进行测序,测序结果与原序列拼接,最终获得基因的cDNA序列。

表1 CsAQPs全长克隆及荧光定量PCR引物
1.2.2CsAQPs基因的生物信息学分析用DNAStar软件包对序列进行拼接;用DNAMAN软件进行开放阅读框查询;核酸序列及氨基酸序列分别在NCBI数据库中用BLASTn和BLASTx分析;将序列用Clustal W比对后,在GeneDoc中输出同源比对结果;在MEGA6.0软件中用邻近相连法构建系统进化树;在EXPASY(http://expasy.org/tools/)中分别对氨基酸序列的编码蛋白质分子量、理论等电点、磷酸化位点、跨膜结构域等生物信息学特征进行分析;在WoLF PSORT中进行亚细胞定位预测;在SOPMA中对蛋白质二级结构进行预测,用SWISS-MODEL模拟蛋白质三级结构,并在Pymol中编辑输出。
1.2.3CsAQPs基因的表达分析按照全式金试剂盒(EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix)的说明书,将不同组织和不同逆境处理所提取的RNA分别合成cDNA用于qRT-PCR检测。以茶树CsPTB基因作为内参基因[6],根据序列特异性,设计qRT-PCR引物(表1),按照全式金(Transstart®Tip Green qPCR superMix)试剂盒的操作步骤,采用10 μL体系于Bio-rad CFX96 Touch实时定量PCR仪上检测目的基因的表达水平。PCR主要程序为:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 34 s,共40个循环,组织表达结果和逆境胁迫处理结果分别采用2-ΔCT和2-ΔΔCT算法进行分析[7]。
2 结果与分析
2.1 茶树CsAQPs基因家族的鉴定及系统进化分析
根据转录组测序结果的NR、NT、KO、Swissprot、GO等的注释信息,筛选出茶树中的AQPs基因序列87条,然而大部分筛选出的序列均为作者前期报道的序列。因此,根据注释信息主要筛选出部分前期未被报道的序列21条。将筛选到的序列进行拼接并在NCBI中进行比对分析,依据比对结果,获得9条新的序列,查找ORF结果显示有6条序列含有完整的ORF。本研究以这6条序列为目的基因进行分析。通过在ORF两端设计引物,PCR扩增、测序验证结果显示,这6条序列均具有完整的ORF(图1)。根据注释的信息及NCBI中Blastx的比对结果,并根据系统进化分析的结果,参考其他植物水通道蛋白命名法,分别将这6条序列命名为CsTIP1;1、CsTIP2;2、CsNIP1;1、CsNIP5;1、CsPIP2;1和CsPIP2;2,对应的GenBank登录号分别为MH167481、MH167482、MH167479、MH167480、MH167483和MH167484(表2)。
序列同源分析显示,同一亚家族成员的序列相似性较高,而不同亚家族成员间的相似性较低。CsPIP2;1和CsPIP2;2的相似性最高,达91.2%,CsTIP1;1和CsTIP2;2的相似性为61.01%,CsNIP1;1和CsNIP5;1的相似性为40.68%;不同亚家族成员间,CsPIP2;1和CsTIP1;1的相似性最高为37.35%,且CsNIP5;1和CsPIP2;2的相似性仅为25.1%,表明在进化中AQP家族可能呈现出同一亚家族聚集的趋势。结合作者前期报道的20条茶树CsAQPs基因,目前从茶树中共鉴定出了26条含有完整ORF的基因。系统进化树分析显示,茶树AQP家族的系统进化聚类模式与其他植物相符,茶树中的AQP家族也可以分为5个亚家族,即PIP、NIP、TIP、SIP和XIP。其中不同亚家族还可以在分成若干小类,如PIP可以分成PIP1和PIP2这2类;TIP可以分成5类,而NIP中所含的类型最多,共有6种类型,XIP只有1种类型(图2)。在我们获得的26条CsAQPs基因中,PIP亚家族的数量最多,为12条,同时还鉴定了1条最新报道的XIP亚家族基因。

M1. DL 2 000; M2. DL 1 000图1 茶树CsAQPs的ORF扩增结果Fig.1 PCR products of CsAQPs genes from tea plant
2.2 茶树CsAQPs理化性质及序列特征分析
从表2中可以看出,本研究获得的6条基因序列的编码氨基酸较短,除CsNIP5;1编码301个氨基酸外,其余基因的编码氨基酸序列均在300个氨基酸以下。同时,它们的蛋白质分子量也较小,主要在25.186~30.728 kD之间,这与其他植物中的AQPs基因编码特征相符。SignalP4.1 Server预测分析表明,它们的蛋白均不含信号肽输出位点。蛋白质总亲水性平均系数(GRAVY)预测显示,6个蛋白质的亲水性系数在0.469~0.992间,表明它们均为疏水性蛋白。利用WoLF PSORT进行亚细胞定位预测,结果显示,CsTIP1;1定位在细胞质的可能性最大,而CsTIP2;2主要定位在液泡,其余4个均预测定位在质膜上。理论等电点分析显示,同其他亚家族相比,TIP亚家族的理论等电点较低,CsTIP1;1和CsTIP2;2的相对等电点分别为5.58和4.90,属酸性氨基酸,这与TIP的亚细胞定位密切相关;而CsNIPs和CsPIPs的理论等电点均在7.5以上,偏碱性。跨膜结构域预测分析,结果显示它们均含有6个跨膜螺旋结构域。磷酸化位点预测显示,它们均含多个丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)的磷酸化位点,其中CsNIP1;1的磷酸化位点最多,为29个(10.1%),CsTIP2;2中最少为12个,表明CsAQPs的功能受蛋白质磷酸化修饰调控。

拟南芥AQP家族用○标示,茶树AQPs用□标示,本研究克隆的6个茶树AQPs用◆标示图2 茶树CsAQPs的系统进化树分析The AQPs family members of Arabidopsis were labeled with ○. AQPs, which previously identified and cloned in this study from tea plant, were labeled with □ and ◆, respectivelyFig.2 Phylogenetic tree analysis of AQPs from tea plant and other plants
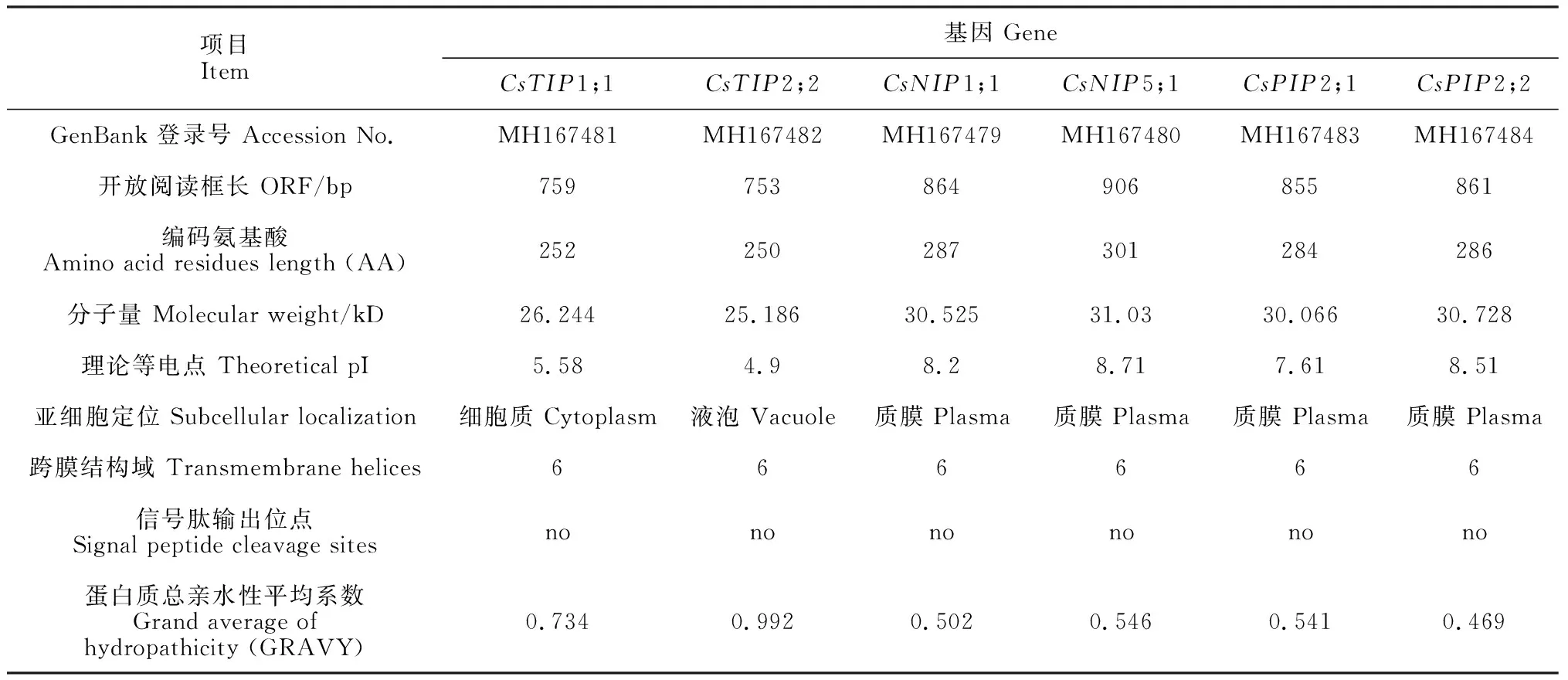
项目Item基因 GeneCsTIP1;1CsTIP2;2CsNIP1;1CsNIP5;1CsPIP2;1CsPIP2;2GenBank 登录号 Accession No.MH167481MH167482MH167479MH167480MH167483MH167484开放阅读框长 ORF/bp759753864906855861编码氨基酸 Amino acid residues length (AA)252250287301284286分子量 Molecular weight/kD26.24425.18630.52531.0330.06630.728理论等电点 Theoretical pI5.584.98.28.717.618.51亚细胞定位 Subcellular localization细胞质 Cytoplasm液泡 Vacuole质膜 Plasma质膜 Plasma质膜 Plasma质膜 Plasma跨膜结构域 Transmembrane helices666666信号肽输出位点 Signal peptide cleavage sitesnononononono蛋白质总亲水性平均系数 Grand average of hydropathicity (GRAVY)0.7340.9920.5020.5460.5410.469
Prosite在线分析结果显示,在6个基因编码氨基酸序的N-端均含有MIP家族蛋白的特征序列HF/I/VNPA/SI/L/VTI/FA/G。序列联配分析结果显示,尽管不同亚家族成员间的序列相似性,但它们在跨膜结构域中的序列具有较高的保守性,特别是Loop B和Loop E中的2个NPA基序具有较高的保守性(图3),其中Loop B中的部分序列是MIP家族的保守特征基序。NPA基序由3个氨基酸(Asn-Pro-Ala)组成,其中CsNIP5;1中Loop B上的NPA突变为NPS,Loop E上的NPA突变为NPV,NPS和NPV基序是植物中NIP5;1蛋白含有的特征序列,与其功能密切相关。同时,AQP中的芳香族/精氨酸(Ar/R)选择性虑器位点—H2、H5、LE1和LE2,以及Froger位点P1~P5的氨基酸残基在相同亚家族中也具有一定的保守性。
二级结构预测显示,6个CsAQPs的结构主要由α螺旋、无规则卷曲、扩展链和β转角构成。其中,在6个蛋白质中31.56%~35.31%的结构区域为α螺旋结构,38.0%~44.72%的结构区域为无规则卷曲,19.01%~22.0%的结构区域为扩展链,而β转角结构仅占2.1%~7.2%,表明AQP结构主要是由α螺旋结构和无规则卷曲等共同构成的跨膜结构。在SWISS-MODEL中分别以CsTIP1;1、CsNIP5;1和CsPIP2;1为代表,对它们的三级结构进行预测分析,结果显示,AQP主要以四聚体结构形式存在(图4,A)。尽管CsTIP1;1、CsNIP5;1和CsPIP2;1属于不同亚家族,但它们的三级结构特征高度相似(图4,B-D)。它们均含有MIP家族典型的跨膜螺旋结构特征,即由5个环(LoopA~E)连接的6个跨膜螺旋结构(TM1~TM6)共同组成的类似沙漏状的跨膜结构。其中,TM2-TM3和TM5-TM6间的LoopB和LoopE分别形成一个短小的半跨膜螺旋结构,该结构上分别含有一个高度保守的NPA结构域,两个NPA结构域的一半以相反的方向嵌入膜中(图4),在跨膜结构域的中间位置,参与形成AQP 水孔,是调控小孔开闭的主要结构域[8-9]。

2个NPA结构域用方框标示,芳香族/精氨酸选择性虑器位点H2、H5、LE1和LE2以及Froger位点P1~P5用虚线框标示图3 6个茶树CsAQPs的序列联配分析The two NPA domains are boxed. The Ar/R selectivity filter (H2, H5, LE1 and LE2) and Froger’s positions (P1-P5) are highlighted by dotted boxes, respectivelyFig.3 Mutiple alignment of amino acid sequences of six CsAQPs

A为典型的AQP四聚体结构构象,B、C和D分别为CsNIP5;1、CsPIP2;1和CsTIP1;1的三级结构图4 茶树CsAQPs的三级结构模拟A.Typical tetrameric quaternary structure of AQP in plant; B, C and D are indicated as the monomer structures of CsNIP5;1,CsPIP2;1 and CsTIP1;1 respectivelyFig.4 The tertiary structure homology-modeling of CsAQPs
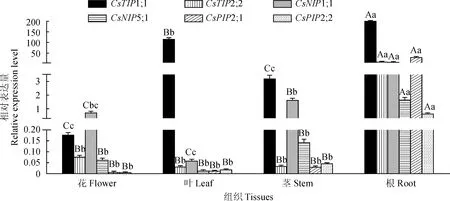
不同大小写字母分别表示在0.01和0.05水平上差异显著图5 CsAQPs在茶树不同组织中的表达Different capital and normal letters indicate significant difference at 0.01 and 0.05 levels, respectivelyFig.5 Expression of CsAQPs in various tea plant tissues

热图表达结果为3次重复的平均值,红色表示上调表达,绿色表示下调表达图6 茶树CsAQPs在非生物逆境胁迫下的表达模式分析The mean values of three replicates results were generated in heat map. Red and green represents high and low expression, respectivelyFig.6 Expression profile analysis of CsAQPs in response to abiotic stress
2.3 茶树CsAQPs的组织表达特异性分析
采用qRT-PCR技术检测了6个CsAQPs基因(图5)在茶树花、叶、茎和根4种组织中的表达水平,结果显示,在4种组织中均检测到它们的表达。它们在根中的表达水平显著高于其他组织的表达水平。其中,CsTIP1;1在叶片中也具有较高的转录水平;与叶片中的表达量相比,CsNIP1;1和CsNIP5;1在花和茎中的表达水平较高,CsPIP2;1和CsPIP2;2在茎中也具有较高的表达水平。表明它们可能与茶树根、茎等组织中的水分等小分子物质转运密切相关。
2.4 茶树CsAQPs在逆境胁迫中的表达模式分析
图6显示,在100 μmol/L ABA处理的24 h过程中,除CsTIP1;1外,其余5个基因的表达量均被显著诱导上调,其中CsNIP5;1的上调水平最高,在处理3 h时表达量上调了4.3倍,且随着处理时间的延长,在9 h和24 h时的相对表达量均达6.0 倍以上。在250 mmol/L NaCl高盐胁迫处理下,CsTIP1;1、CsTIP2;2和CsNIP1;1的表达被显著抑制,CsTIP1;1在9 h时的表达量仅为对照的0.17倍;而CsNIP5;1、CsPIP2;1和CsPIP2;2的表达被显著上调,在9 h时CsPIP2;2的表达量上调了4.9倍。与盐胁迫的表达模式相似,10%(w/v)PEG诱导的干旱胁迫抑制CsTIP1;1、CsTIP2;2和CsNIP1;1的表达,而CsNIP5;1、CsPIP2;1和CsPIP2;2的表达被显著上调,其中CsPIP2;1的表达水平在9 h和24 h时分别上调了5.2和19.0倍。4 ℃低温处理下,CsTIP1;1的表达变化不显著,CsTIP2;2的表达在3 h时显著上调,其他时间点的表达变化不显著;CsNIP1;1的表达量受低温胁迫诱导,在24 h的表达量上调了2.3倍;而CsNIP5;1、CsPIP2;1和CsPIP2;2的表达均被显著抑制。
3 讨 论
AQP在植物生长发育及环境响应中发挥重要作用。多种植物中已从全基因组分析中鉴定了相关的AQPs基因,如拟南芥中含35个[10],水稻中含34个[11],芝麻中含36个[12],杨树中为55个[13],而陆地棉中的数量达71个[14]。作者前期已鉴定了茶树中20个CsAQPs基因[4],在此基础上,通过分析转录组数据获得了6个新的茶树CsAQPs基因,即NIP亚家族的CsNIP1;1和CsNIP5;1,PIP亚家族的CsPIP2;1和CsPIP2;2,TIP亚家族的CsTIP1;1和CsTIP2;2。至此,共获得26个茶树CsAQPs基因的cDNA全长序列,它们可以被分为5个亚家族,即12个PIPs,7个TIPs,4个NIPs,2个SIPs和1个XIPs,这为研究AQPs在茶树生长发育及逆境胁迫响应中的功能奠定了基础。然而,同其他植物中鉴定出的数量相比,茶树中仍有较多的CsAQPs基因有待分离鉴定。
本研究获得的6个CsAQPs基因的编码蛋白均符合MIP家族蛋白的特征。它们均含有MIP家族蛋白的特征信号序列HF/I/VNPA/SI/L/VTI/FA/G,以及AQP特有的NPA保守功能基序,不同亚家族成员还含有相应的特征序列,这样的结构特征决定了其转运底物的特异性。例如,同其他植物中的NIP5;1成员一样,CsNIP5;1中的NPA基序分别突变为NPS和NPV;另外,CsNIP5;1中的Ar/R滤器为AIGR基序,这与报道的NIP5;1一致,表明其在植物中的转运功能具有保守性。研究显示,拟南芥AtNIP5;1作为能够转运大分子的通道蛋白,具有转运水分、硼酸和砷等底物的功能[15-16],因此推测CsNIP5;1在茶树转运硼酸和砷中发挥重要的功能。在AQP中,NPA孔缢决定了可以通过的底物的尺寸,而Ar/R滤器和P1~P5的5个氨基酸残基在决定运输底物特异性中具有重要的作用[8, 17]。本研究获得的6个茶树CsAQPs形成5种类型的Ar/R滤器,而拟南芥35个AQPs中仅有9种,表明茶树CsAQPs在转运底物中具有多样性。根据其他植物中的研究结果,CsPIP2;1和CsPIP2;2均含有水分运输型Ar/R 滤器(FHTR),预测它们还可以运输二氧化碳、硼酸、尿素和过氧化氢等底物;CsNIP1;1的Ar/R 滤器为WVAR,推测其除了转运水分子外,还可以转运硼酸、甘油、甲酰胺以及砷等物质[16]。CsTIP1;1的Ar/R 滤器为HIAV,推测其可能具备转运过氧化氢的功能;而CsTIP2;2的Ar/R 滤器为HIGR,推测其可能识别转运尿素和氨。从蛋白质高级结构分析预测中可以看出,尽管不同亚家族的序列差异显著,但它们的结构构象及折叠方式等均有较高的保守性。以CsTIP1;1、CsNIP5;1和CsPIP2;1为代表构建的三维结构特征高度相似,这种相似性不仅保持在不同亚家族AQPs间,在动物、低等植物等生物中也保持这种类似沙漏的跨膜结构构象,这说明AQPs在维持生命体正常生理功能中发挥了重要的作用,为了维持其功能,在物种长期进化过程中仍然保持着相似结构特征。
本研究中的6个CsAQPs基因在茶树根、茎、叶和花中都表达,但它们在根中的表达量显著高于在其他组织中的表达水平,表明它们在茶树根系吸收转运底物中发挥了重要的功能。前期报道的20个CsAQPs的组织表达水平显示,它们在不同组织中均表达,部分基因在花中的表达量较高,而其他组织中高表达的基因较少。本研究中的6个基因均在根中高表达,这与它们的转运底物密切相关,如尿素、硼酸等主要是通过根系吸收进入体内。根部是植物吸收转运水分和矿质元素等物质的重要部位,CsAQPs在根中具有较高的转录水平,不仅反映了茶树根系具有较强的吸收能力,也为研究茶树根系物质转运提供了参考。表达量分析显示,CsTIP1;1在叶片中也具有较高的表达水平,预测能够转运水分及过氧化氢等物质,推测其可能在叶片蒸腾作用中起作用。前面的分析显示,CsNIP1;1和CsNIP5;1可能参与硼酸等物质的转运,硼酸是花粉管发育、受精等生殖生长中必不可少的微量元素,组织表达分析发现它们在花中的转录水平高于叶片中的水平,表明这2个基因可能在茶树花内硼酸转运中发挥作用。
AQP通过转运水分子等物质参与植物的逆境胁迫响应。前期的研究显示,CsAQPs的表达模式与茶树抗逆响应密切相关[4],本研究对CsAQPs在ABA、高盐、干旱和低温胁迫下的表达进行检测,明确了这6个基因在茶树抗逆响应中的表达模式,为后续研究CsAQPs介导的水分等物质转运在茶树抗逆响应中的功能提供了重要的参考。高盐、干旱和低温等逆境能够对植物造成渗透胁迫,进而破坏膜系统导致细胞死亡,因此,维持细胞渗透式对提高植物的抗逆性至关重要。CsAQPs基因在不同胁迫中的表达模式不尽相同,下调的基因可能参与了物质的向外运输,而上调的基因可能调节了物质的向内运输,这样可以维持膜内外渗透式的平衡来响应逆境胁迫。除此以外,它们在逆境胁迫下的表达模式还与其转运底物相关,逆境胁迫能够产生过氧化氢的积累,进而调控过氧化氢转运相关的AQPs成员,如CsTIP1;1、CsPIP2;1和CsPIP2;2等的表达,降低过氧化氢积累,减轻逆境对膜系统的伤害。研究显示,在烟草、香蕉等多种植物中过表达AQPs基因,能够减弱逆境胁迫对转基因植株膜系统的伤害[18-19]。过表达水稻OsPIP2;6能够显著提高转基因植株的抗逆能力[20]。CsNIP5;1、CsPIP2;1和CsPIP2;2的表达均受ABA、高盐和干旱胁迫的强烈诱导,然而它们的表达在低温胁迫中呈下调表达模式,可能与ABA依赖的渗透胁迫响应相关。Li等[21]研究显示,灰毛滨藜中AcPIP2的表达受ABA、干旱等诱导,但在低温下呈下调模式,在拟南芥中过表达该基因,能够调控转基因植株对干旱、高盐和低温等胁迫的抵抗力。香蕉MaPIP1;1等也表现出相似的表达模式和功能[18]。然而,本研究中仅检测了这些基因在叶片中的表达模式,由于它们在根中具有较高的转录水平,后续还需分析逆境胁迫下它们在根中的表达模式。在拟南芥等植物中过表达AQPs基因,能够增强植物的导水率,促进根系的生长,进而提高转基因植株对干旱、高盐和低温等的抵御能力[22-23]。根据它们在逆境胁迫中的表达模式可以看出,茶树CsAQPs与茶树抗逆响应密切相关,后续我们将通过转基因等手段研究它们的功能,为揭示茶树抗逆机理提供参考。
