雷公藤AP2/ERF转录因子基因的克隆与分析
2018-10-16祝传书陈蒙蒙冯俊涛
祝传书,刘 艳,陈蒙蒙,蒲 时,冯俊涛,张 兴
(1 西北农林科技大学 无公害农药研究服务中心,陕西杨陵 712100;2 陕西省生物农药工程技术研究中心,陕西杨陵 712100)
雷公藤(TripterygiumwilfordiiHook.f.)为卫矛科雷公藤属多年生木质藤本植物,在中国很早以前就用于医学和防治各种害虫,是一种重要的杀虫植物和传统的中药材,主要分布于东南亚以及中国长江流域以南等地区。在农业上对多种害虫具有胃毒、触杀、拒食、抑制发育等活性。在医学研究领域,雷公藤植物提取物具有抗癌、治疗类风湿性关节炎、调节免疫系统等作用[1]。雷公藤植物因根入药,野生资源生长缓慢,大量采摘造成雷公藤野生资源日益减少,使得雷公藤植物活性化合物的应用受到限制。通过离体培养并结合雷公藤活性次生代谢物质生物合成途径的调控,成为提高雷公藤植物次生代谢物质含量以及利用代谢工程与合成生物学手段获取活性次生代谢物质的有效途径。
转录因子(transcription factor)也称反式作用因子,是一种具有特殊结构、能与真核生物的基因启动子区域发生特异性结合,从而调控目的基因表达的蛋白质分子[2]。AP2/ERF (APETALA2/ethylene-responsive element binding factor)转录因子家族,也称AP2/EREBP,广泛存在于植物中,其家族成员均含有由60个左右氨基酸组成的保守DNA结合域,即AP2/EREBP结合域[3]。近年来已从拟南芥(Arabidopsisthaliana)[4]、大豆(Glycinemax)[5]、水稻(Oryzasativa)[6]、葡萄(Vitisvinifera)[7]、烟草(Nicotianatabacum)[8]等多种植物中分离获得。AP2/ERF转录因子参与多种生物学过程,包括生长发育、生物和非生物胁迫(如干旱、高盐、低温等)逆境胁迫响应等[9-12]。近期研究发现,植物AP2/ERF转录因子也参与调控多种药用植物的次生代谢产物生物合成。青蒿(Artemisiaannua)中分离的2个茉莉酸(jasmonic acid, JA)响应的AP2(APETALA2)家族转录因子AaERF1和AaERF2,它们能够与青蒿素合成途径关键酶基因的启动子结合,调控关键酶基因的协同表达,影响合成青蒿素前体紫穗槐-4,11-二烯到青蒿酸的生物合成,最终影响青蒿素的含量[13]。青蒿中表皮毛特异表达的转录因子AaORA(A.annuaoctadecanoid-responsive AP2/ERF-domain transcription factor)可调控青蒿素合成关键酶基因的表达水平,从而调控青蒿素和青蒿酸的合成[14]。而且调控毛状体和青蒿素生物合成途径的AP2/ERF转录因子TAR1(trichome and artemisinin regulator 1)也可直接作用于青蒿素合成途径中的关键酶基因,从而调控青蒿素生物合成[15]。从紫杉(Taxuscuspidata)中分离的AP2/ERF转录因子TcAP2,可通过调控紫杉醇生物合成途径中关键酶基因的表达而增加紫杉醇的积累,而AP2类转录因子TcDREB(T.cuspidatadehydration response element binding)也参与调控东北红豆杉异戊二烯代谢途径产物紫杉醇的生物合成[16]。从长春花(Catharanthusroseus)中筛选出的AP2/ERF类转录因子ORCA2(octadecanoid-derivative responsiveCatharanthusAP2-domain protein 2)在萜类吲哚生物碱的生物合成中具有重要的调节作用[17],而且茉莉酸甲酯(MeJA)响应的ORCA3(octadecanoid-derivative responsiveCatharanthusAP2-domain protein 3)转录因子在调控长春碱生物合成过程中也具有重要作用[18]。烟草中烟碱的生物合成也受AP2/ERF转录因子的调控,JA可促进烟草中NtERF1、NtERF32、NtERF121基因的表达量增加,同时可影响烟草中总生物碱和烟碱含量的提高[8]。
为了明确雷公藤中AP2/ERF转录因子的生物学信息和功能,本研究对雷公藤AP2/ERF转录因子进行基因克隆和生物信息学分析,并通过实时荧光定量PCR方法检测其在MeJA诱导处理后的雷公藤发状根中的表达量变化,为进一步研究该基因的功能提供理论依据,并为利用雷公藤中AP2/ERF转录因子提高雷公藤植物细胞中次生代谢物质的含量奠定基础。
1 材料和方法
1.1 实验材料
雷公藤(Tripterygiumwilfordii)采自福建泰宁,经鉴定后移植于西北农林科技大学无公害农药研究服务中心;雷公藤发状根保存于MS液体培养基中,25 ℃、120 r·min-1于黑暗条件下振荡培养,每30 d继代1次[19]。选择继代2次生长良好的雷公藤发状根,继代培养28 d后,往培养发状根中加入MeJA诱导子,使其终浓度为100 μmol·L-1。于诱导后0、1、3、6、9、12、24、48 h后取样,液氮速冻后置于-80 ℃保存备用。
1.2 方 法
1.2.1雷公藤发状根RNA提取和cDNA合成取MeJA诱导处理不同时间点的雷公藤发状根,在液氮中迅速研磨,依据Biospin多糖多酚植物总RNA提取试剂盒说明书(博日生物科技有限公司,杭州)提取雷公藤发状根总RNA,利用Nanodrop2000进行核酸含量测定以及1%琼脂糖凝胶电泳检测RNA完整性。利用无RNA酶的脱氧核糖核酸酶(DNase I)(TaKaRa)对所提取的RNA进行纯化,去除基因组污染。利用PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit (TaKaRa)将雷公藤受MeJA诱导3 h的发状根RNA反转录为第一互补链DNA(cDNA),用于后续的基因克隆试验;使用PrimeScriptTM RT reagent Kit with gDNA Eraser (TaKaRa)试剂盒将受MeJA诱导处理的雷公藤发状根8个时间点的RNA反转录为cDNA,用于荧光定量PCR试验。
1.2.2雷公藤AP2/ERF基因序列的克隆由于雷公藤植物目前没有可用的基因组序列,通过对雷公藤根转录组中转录因子AP2/ERF进行筛选(SRX472292,http://www.ncbi.nlm.nih.gov/sra/SRX472292),获得了2个全长的AP2/ERF转录因子基因(GAVZ01042389.1和GAVZ01016765.1)。参照GenBank中已知具有调控植物次生代谢功能的AP2/ERF蛋白序列,通过NCBI进行Blast比对分析,设计AP2/ERF基因扩增引物(表1)。以雷公藤总RNA反转录cDNA为模板进行PCR扩增,按以下反应体系对雷公藤AP2/ERF基因进行扩增:cDNA 1 μL、上游引物F (10 μmol·L-1) 1 μL、下游引物R (10 μmol·L-1) 1 μL、PrimeSTAR (TaKaRa) 12.5 μL补充ddH2O至25 μL。PCR反应程序为: 95 ℃预变性3 min;98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸1 min,进行34个循环;最后72 ℃终延伸10 min。用1%琼脂糖凝胶电泳检测PCR产物,用天根公司(北京)通用型DNA纯化回收试剂盒回收PCR产物。将回收的PCR产物用TaKaRa公司的PremixTaq(ExTaqVersion 2.0 plus dye)酶进行加“A”反应,然后连接pMD18-T载体(TaKaRa)。转化至E.coliDH5α感受态细胞(TaKaRa)中,在氨苄抗性平板上进行筛选,再经菌落PCR检测后选择阳性克隆送北京奥科生物技术有限公司测序验证。
1.2.3雷公藤TwAP2/ERF1和TwAP2/ERF2基因序列的生物信息学分析使用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找TwAP2/ERF1和TwAP2/ERF2基因开放阅读框,用DNAMAN软件将TwAP2/ERF1和TwAP2/ERF2基因序列翻译成氨基酸序列。用Protparam在线软件(http://www.ebi.ac.uk/Tools/pfa/iprscan)预测雷公藤TwAP2/ERF1和TwAP2/ERF2转录因子编码的氨基酸理化性质。在NCBI中对TwAP2/ERF1和TwAP2/ERF2进行保守结构域分析。用DNAMAN软件对序列编码的蛋白质进行多重比对,用ClustalW软件分析雷公藤TwAP2/ERF1和TwAP2/ERF2转录因子与其他植物的AP2/ERF氨基酸序列亲缘关系。用生物软件MEGA 6.0对TwAP2/ERF1和TwAP2/ERF2进化系统进化树的建立和分析。通过SWISS-MODEL完成蛋白质三级结构的分析。

表1 克隆和qRT-PCR引物
1.2.4雷公藤TwAP2/ERF1和TwAP2/ERF2基因诱导表达差异分析将1.2中反转录cDNA用于荧光定量PCR试验,依据TaKaRa的SYBR Premix Ex Taq Ⅱ Kit说明进行qRT-PCR反应,反应体系如下:cDNA模板2 μL,上下游引物(10 μmol·L-1)各1 μL,SYBR Premix Ex Taq Ⅱ 12.5 μL,Rnase-Free dH2O 8.5 μL。实时PCR反应程序如下:95 ℃预变性30 s;然后进行40个循环:95 ℃ 10 s,58 ℃ 30 s。以26S核糖体RNA基因作为内参,用2-ΔΔCt方法分析TwAP2/ERF1和TwAP2/ERF2的相对表达量,其中ΔCt=Ct(样本/对照)-Ct内参,ΔΔCt=ΔCt样本-ΔCt对照[20]。
2 结果与分析
2.1 雷公藤TwAP2/ERF1和TwAP2/ERF2基因的克隆与序列分析
以雷公藤发状根cDNA为模板,PCR扩增克隆得到了2个AP2/ERF家族基因,分别命名为TwAP2/ERF1(GenBank登录号GAVZ01042389.1;图1,A)和TwAP2/ERF2(GenBank登录号GAVZ01016765.1;图1,B)。
TwAP2/ERF1和TwAP2/ERF2基因的开放阅读框与氨基酸序列分析表明,TwAP2/ERF1基因含有525 bp开放阅读框(ORF),编码186个氨基酸(图2);TwAP2/ERF2基因的开放阅读框(ORF)为789 bp,编码262个氨基酸(图3)。
2.2 雷公藤TwAP2/ERF1和TwAP2/ERF2基因序列生物信息学分析
利用ProtParam软件对TwAP2/ERF1和TwAP2/ERF2基因编码的蛋白质进行理化性质分析,TwAP2/ERF1基因预测编码蛋白分子量大小为20.53 kD,理论等电点为8.96;带正电残基(Arg+Lys)为24,带负电残基(Asp+Glu)为22,蛋白不稳定系数是73.28,是不稳定蛋白;脂肪系数为65.59,亲水性系数为-0.676,为亲水性蛋白。TwAP2/ERF2基因预测编码蛋白分子量大小为29.30 kD,理论等电点为6.41;带正电残基(Arg+Lys)为19,带负电残基(Asp+Glu)为23,蛋白的不稳定系数是49.49,是不稳定蛋白;脂肪系数为41.76,亲水性系数为-0.980,为亲水性蛋白。
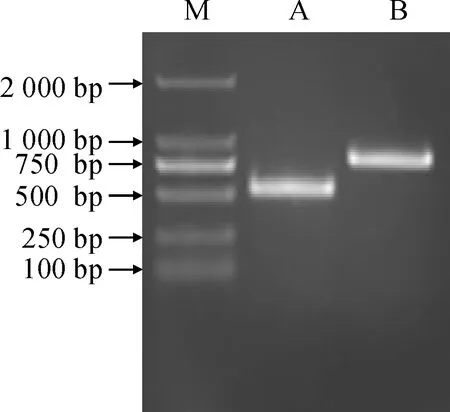
图1 雷公藤TwAP2/ERF1和TwAP2/ERF2基因扩增M. DL2000;A. TwAP2/ERF1;B. TwAP2/ERF2Fig.1 Amplification of open read frame (ORF) of TwAP2/ERF1 and TwAP2/ERF2

ATG为起始密码子;TAA为终止密码子图2 TwAP2/ERF1基因cDNA序列及其编码的氨基酸序列ATG is the initiation codon; TAA is the stop codonFig.2 The cDNA sequence and deduced amino acid sequence of TwAP2/ERF1

ATG为起始密码子;TAG为终止密码子图3 TwAP2/ERF2基因cDNA序列及其编码的氨基酸序列ATG is the initiation codon; TAG is the stop codonFig.3 The cDNA sequence and deduced amino acid sequence of TwAP2/ERF2
NCBI中保守结构域分析表明,TwAP2/ERF1和TwAP2/ERF2基因编码蛋白的氨基酸序列都具有单个AP2保守结构域,分别位于第64~122(图4,A)和45~103(图4,B)氨基酸上,符合ERF家族特征,是AP2/ERF转录因子。
SOPMA预测蛋白二级结构,TwAP2/ERF1蛋白的二级结构中α-螺旋占31.72%,β-折叠占7.53%,无规则卷曲占50%,延伸链占10.75%;TwAP2/ERF2蛋白的二级结构中α-螺旋占19.85%,β-折叠占10.69%,无规则卷曲占53.44%,延伸链占16.03%。
利用SWISS-Model构建雷公藤TwAP2/ERF1和TwAP2/ERF2的三维结构,以拟南芥AtERF1晶体结构[21](PBD ID:3gcc.1.A)为模板,TwAP2/ERF1和TwAP2/ERF2蛋白与拟南芥AtERF1蛋白氨基酸相似度分别为75.67%和75.38%。建模结果显示,TwAP2/ERF1(图5,A)和TwAP2/ERF2(图5,B)与AtERF1的AP2结合域三级结构非常相似,均有1个α螺旋和3个β折叠。
利用DNAMAN将TwAP2/ERF1和TwAP2/ERF2基因编码的氨基酸序列与NCBI中已登录的其他高等植物的AP2/ERF氨基酸序列进行同源关系比较(图6),结果显示,各种植物AP2/ERF编码的氨基酸序列存在较高相似性,多数都达60%以上,且在AP2/ERF保守结构域中都具有一个保守的YRG和WLG元件。BlastX分析表明,TwAP2/ERF1和TwAP2/ERF2编码的氨基酸序列与山黄麻AP2/ERF(POO02792.1)、榆科山黄麻AP2/ERF(PON77925.1)、拟南芥AP2/ERF(AEE27952.1)、赤豆AP2/ERF(BAT83431.1)、刺菜蓟AP2/ERF(KVI01950.1)的氨基酸序列具有较高相似性,分别为73%、83%、75%、75%、72%和82%、77%、68%、74%、77%。
将TwAP2/ERF1和TwAP2/ERF2编码的氨基酸序列与NCBI中已登录的其他植物的AP2/ERF氨基酸序列进行系统的进化树分析,使用MEGA 6.0软件采用邻结法构建了不同植物中AP2/ERF的系统进化树。共选取了12条植物AP2/ERF氨基酸序列进行建树(图7),从进化树中可以看出,TwAP2/ERF1与TwAP2/ERF2聚为一个大类的两个分支,TwAP2/ERF1与油桐AP2/ERF(APQ47444.1)和木油桐AP2/ERF(APQ47365.1)聚为一支,TwAP2/ERF2与毛果杨AP2/ERF(XP_002304640.1)和樱桃AP2/ERF(ALD84477.1)聚为一支。
2.3 MeJA诱导处理雷公藤发状根后TwAP2/ERF1和TwAP2/ERF2的差异表达分析
用2-ΔΔCt法处理实时荧光定量PCR数据,分析雷公藤发状根中TwAP2/ERF1和TwAP2/ERF2在MeJA诱导后不同时间的表达水平,结果如图8。MeJA诱导后TwAP2/ERF1基因的相对表达量有明显的提高,于诱导后9 h达到最高值,是0 h表达量的16.77倍,后随着诱导时间的延长相对表达量逐渐降低,在诱导48 h后表达量水平与0 h无差异。MeJA诱导对TwAP2/ERF2基因的表达表现出抑制的作用,随着诱导时间的延长,相对表达量有所提高,但是表达量变化水平不大。由此可知MeJA能够诱导TwAP2/ERF1基因的表达,并且短时间内能够抑制TwAP2/ERF2基因的表达。
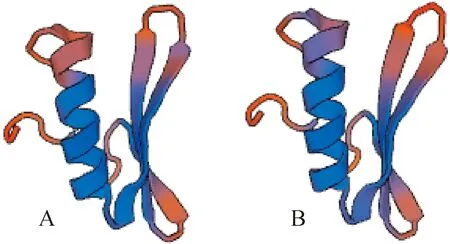
图5 TwAP2/ERF1(A)和TwAP2/ERF2(B)蛋白的三维结构预测Fig.5 The three-dimension structures of TwAP2/ERF1(A) and TwAP2/ERF2(B)

图4 TwAP2/ERF1(A)和TwAP2/ERF2(B)蛋白保守结构域分析Fig.4 Conserved domain analysis of TwAP2/ERF1(A)and TwAP2/ERF2(B)

图6 TwAP2/ERF1和TwAP2/ERF2与其他物种AP2/ERF氨基酸序列多重比对Fig.6 The alignment of amino acid sequence of AP2/ERF from TwAP2/ERF1, TwAP2/ERF2 and other plants
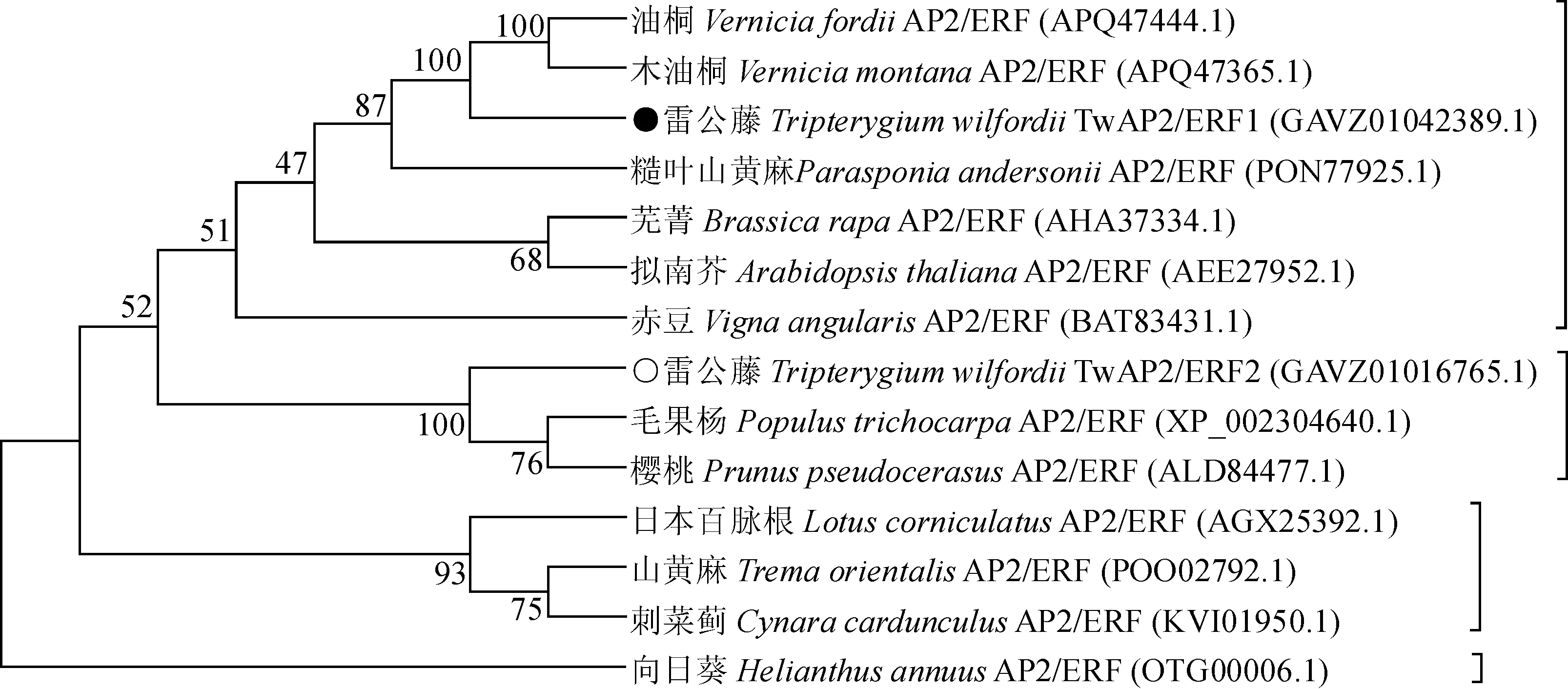
图中各节点处数字代表可信度图7 TwAP2/ERF1和TwAP2/ERF2与其他植物氨基酸序列的系统进化树The numbers at the node of the figure is credibility.Fig.7 Phylogenetic tree of TwAP2/ERF1, TwAP2/ERF2 and other plant species
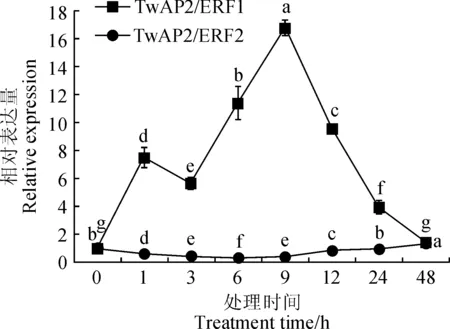
不同小写字母代表0.05水平差异显著图8 MeJA处理雷公藤发状根对TwAP2/ERF1和TwAP2/ERF2表达量的影响Different normal letters represent significant differences at 0.05 levelFig.8 Effects of MeJA elicitors on the expression of TwAP2/ERF1 and TwAP2/ERF2 genes in T. wilfordii hairy roots
3 讨 论
雷公藤作为传统的药用植物,资源短缺和活性成分含量低等问题限制了其在农业和医药领域中的应用。通过转录水平调控高活性次生代谢物质生物合成途径相关基因以及关键酶基因的表达是实现定向、高效调节药用植物生长及活性成分生物合成的有效手段之一。近年来转录因子调节药用植物发育及活性成分的生物合成的研究备受关注,转录因子AP2/ERF家族是植物最大转录因子家族之一,不仅在药用植物生长发育过程中发挥调控作用,而且还与药用植物的活性成分生物合成和抗逆反应密切相关[9-18]。转录因子AP2/ERF在模式植物和重要农作物以及一些药用植物中的调控作用已被广泛研究,但对于雷公藤植物中AP2/ERF转录因子家族的相关研究未见报道。本研究以雷公藤发状根为材料[19],从中克隆得到了TwAP2/ERF1和TwAP2/ERF2转录因子,其分别编码186个和262个氨基酸。对转录因子TwAP2/ERF1和TwAP2/ERF2保守结构域分析表明,2个转录因子蛋白均含有一个典型的AP2保守结构域,其中TwAP2/ERF1典型的AP2保守结构域位于64~122氨基酸位点上,TwAP2/ERF2的AP2保守结构域位于45~103氨基酸位点上。多重序列比对发现TwAP2/ERF1和TwAP2/ERF2的保守结构域与山黄麻(T.orientalis)AP2/ERF(POO02792.1)等其他植物的AP2/ERF蛋白结构域有70%以上的高度相似性。对雷公藤TwAP2/ERF1和TwAP2/ERF2转录因子的三维结构分析发现,2个转录因子蛋白均有1个α-螺旋和3个β-折叠,与拟南芥AtERF1在AP2结合域的相似性非常高,推测AP2/ERF结构域中的β-折叠可能在识别顺式元件中起重要作用,而α-螺旋可能在与其他转录因子的相互作用中起作用[21]。系统进化分析发现,雷公藤TwAP2/ERF1转录因子与油桐AP2/ERF(APQ47444.1)和木油桐AP2/ERF(APQ47365.1)聚为一支且亲缘关系较高,雷公藤TwAP2/ERF2转录因子与毛果杨AP2/ERF(XP_002304640.1)和樱桃AP2/ERF(ALD84477.1)聚为一支且亲缘关系较近,研究克隆得到的雷公藤TwAP2/ERF1和TwAP2/ERF2转录因子在进化树中明显聚类为两支,推测其可能在雷公藤中发挥着不同的生物学功能。
在自然生长环境中植物会面临各种不利的生物胁迫和非生物胁迫,为了克服这些不利条件,植物已形成系统的防御机制,涉及多种信号途径,其中JA在各种信号分子之间起着非常重要的作用[22]。研究发现,MeJA处理青蒿后,与青蒿素合成途径有关的关键酶基因的表达量都有较大变化,而变化的这些基因都含有转录因子AP2/ERF的结合位点[13]。荧光定量PCR分析表明,青蒿素AaERF1和AaERF2受MeJA诱导表达量变化最大,且AaERF1和AaERF2过表达载体转化青蒿植株后青蒿素含量也有所增加[13]。在烟草中,MeJA诱导的AP2/ERF转录因子NtERF32基因能够调控生物碱代谢途径中的关键酶基因的表达,从而影响着烟碱的生物合成[8]。本研究采用MeJA处理雷公藤发状根,荧光定量PCR方法检测TwAP2/ERF1和TwAP2/ERF2基因表达情况表明,TwAP2/ERF1基因受MeJA诱导后表达量提高,在诱导后9 h时表达水平上调了16倍多;但相同诱导条件下,TwAP2/ERF2基因的表达则表现出早期抑制,随着诱导时间的延长,相对表达量有所提高,诱导48 h后表达量上升但是变化幅度较小。由此我们初步推测TwAP2/ERF1基因可能调控雷公藤中活性次生代谢物质生物合成途径中关键酶基因的表达,从而提高相应次生代谢物质的生物合成,然而雷公藤TwAP2/ERF1转录因子具体调控哪类活性物质的生物合成以及具体的调节机理有待进一步研究。
本研究首次通过雷公藤根转录组序列分析结合PCR方法对雷公藤TwAP2/ERF1和TwAP2/ERF2转录因子基因进行了克隆与生物信息学分析及表达模式的初步探索,研究结果为阐明雷公藤次生代谢物质的生物合成调控提供基础,同时也为进一步利用代谢工程方法提高雷公藤次生代谢物质的含量提供依据。
