用配合还原反萃取法从P204有机相中去除Fe(Ⅲ)
2018-10-15高腾飞刘勇奇谭群英刘少葵唐红辉
高腾飞,刘勇奇,谭群英,刘少葵,唐红辉
(湖南邦普循环科技有限公司,湖南 长沙 412600)
有机磷酸萃取剂P204,即磷酸二(2-乙基己基)脂对Fe3+的萃取选择能力很强,在萃取有价金属时会优先萃取Fe3+,因此Fe3+的反萃取就相对困难。Fe3+易在有机相中富集从而降低P204的萃取性能[1-3]。目前,从负载Fe3+的P204有机相中反萃取Fe3+主要有两种方法:一种是利用P204对Fe2+的选择性低,容易实现Fe2+的反萃取,通过加入还原剂将Fe3+还原成Fe2+,再加酸反萃取去除Fe2+,如加铁粉、锌粉等还原剂在机械搅拌和强保护气氛中还原反萃取Fe3+[4-5];另一种是加入配合剂,使Fe3+形成配合物进入水相从而去除Fe3+,如在P507-N235体系中,加入EDTA配合反萃取,Fe3+反萃取率可达96.42%[6];负载有机相中加入HF,HF与Fe3+反应形成FeF3,从而去除Fe3+。P204有机相中的Fe3+,用EDTA配合反萃取虽能有效去除Fe3+,但加入的EDTA对再生有机相的萃取能力有较大影响,且后续废水中EDTA的去除也是一个难题[7-9]。
试验所用原料为6 mol/L HCl反萃取后的P204有机相,其中的Fe3+更加难以反萃取。结合实际工艺提出采用配合与还原相结合的反萃取法除铁,即利用高浓度HCl将Fe3+从有机相中分离出来,然后再用还原剂将Fe3+还原为Fe2+,最后再反萃取Fe2+,使P204有机相中的Fe3+得到深度去除。
1 试验部分
1.1 试验原料与试剂
试验原料:有机相为28%P204+72%260#磺化煤油,是经6 mol/L HCl反萃取后所得,其中Fe3+质量浓度为0.15 g/L。
其他试剂:无水亚硫酸钠,焦亚硫酸钠,草酸,盐酸,均为分析纯,国药集团化学试剂有限公司产品;五水合硫代硫酸钠,分析纯,广东光华科技股份有限公司产品;硫化钠,分析纯,汕头市西陇化工厂有限公司产品。
1.2 试验仪器与设备
250 mL玻璃分液漏斗;100 mL量筒;FA2004N电子天平;JW-B分液漏斗振荡器;WFX-130A型原子吸收分光光度计;SRJX-8-13箱式电阻炉。
1.3 试验原理与方法
1.3.1P204萃取、反萃取Fe3+原理
P204属于酸性萃取剂,在煤油等非极性溶液中一般以多聚体形式存在,当水相pH较低时,主要形成二聚体H2A2,通过离子缔合和螯合作用萃取金属离子。其与Fe3+生成的萃合物十分稳定,在低pH条件下,与Fe3+的反应为

(1)
生成物的结构式[10-12]为

用配位剂Bm-从P204有机相中反萃取Fe3+,反应式为

(2)
式(2)可分解为:

(3)
(4)
式(3)的平衡常数为K1,式(4)的平衡常数为K2,则
(5)
(6)
式(2)平衡时,
=K1·K2;
(7)
其中,Fe3+分配比
(8)
从式(8)看出,有机相中HA和A-活度及K1不变时,分配比D与K2、配位剂Bm-活度有关。其他条件不变时,提高K2和配位剂活度都有利于减小分配比,从而使Fe3+进入水相。一些常见配位剂与Fe3+生成配合物的稳定常数见表1。

表1 配位剂与Fe3+配合物的稳定常数(291~298 K)
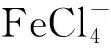
Fe3+在酸性条件下有较强的氧化性,本身得电子被还原成Fe2+:

(9)
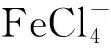
1)在搅拌条件下,配合物FeA3·3[HA]通过相界面进入水相;
2)FeA3·3[HA]在水相中电离分解生成Fe3+、A-及HA;
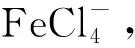
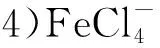
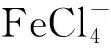
试验方法:取一定量P204有机相于分液漏斗中,加入一定体积一定浓度的盐酸溶液,进行第一次振荡,时间为4 min;之后再加入一定量还原剂(或先加入还原剂振荡4 min后再加入盐酸),进行第二次振荡;之后静置分相,取下层水相用原子吸收分光光度法测定溶液中Fe3+质量浓度(若未说明加入顺序,均为先加盐酸后加还原剂;试验中讨论的振荡时间均为第二次振荡时间)。
1.3.2P204有机相中Fe3+质量浓度的测定
取P204有机溶液100 mL于坩埚内,置于箱式电阻炉中高温烧灼1 h左右,得到的残余固体用王水充分溶解后定容,用原子吸收分光光度法测定其中Fe3+质量浓度,计算出P204有机相中Fe3+质量浓度。
2 试验结果与讨论
2.1 不同还原剂及加入方式对Fe3+反萃取的影响
P204有机相100 mL,还原剂加入量为理论量的4倍,一次振荡时间4 min,盐酸浓度4 mol/L,盐酸体积50 mL,二次振荡时间12 min。硫代硫酸钠加入方式对Fe3+反萃取率的影响试验结果见表2。可以看出:硫代硫酸钠对Fe3+的反萃取有明显促进作用;草酸、亚硫酸钠、硫化钠及焦亚硫酸钠对Fe3+的反萃取几乎无影响。这是因为硫代硫酸钠的还原电位比其他各还原剂的电位都要高,其还原性更强,Fe3+与Cl-生成配合物后,其稳定性增加,更难被还原,因此,选择硫代硫酸钠作还原剂。先加入硫代硫酸钠时,Fe3+反萃取率明显偏低;而先加入盐酸、后加硫代硫酸钠,Fe3+反萃取率相对较高:这可能是硫代硫酸钠在有机相中的溶解度较低,P204与Fe3+形成的配合物无法直接电离致溶液中Fe3+浓度十分低,硫代硫酸根离子难以与Fe3+相遇形成有效碰撞,大部分与有机相夹带的水相或萃取剂中H+反应生成亚硫酸而失效的缘故。因此,试验选择先加入盐酸再加入硫代硫酸钠来反萃取P204有机相中的Fe3+。
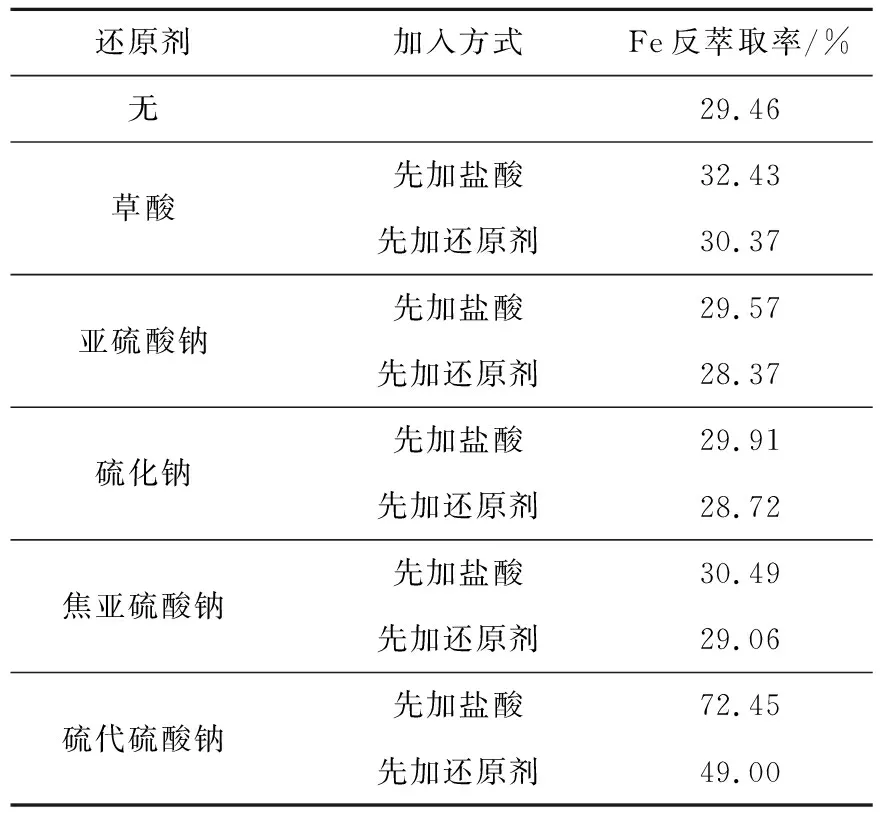
表2 还原剂加入方式对Fe3+反萃取率的影响
2.2 盐酸与Na2S2O3配合还原反萃取Fe3+
2.2.1振荡时间对盐酸与Na2S2O3配合还原反萃取Fe3+的影响
P204有机相体积100 mL,盐酸体积50 mL,盐酸浓度4 mol/L,一定的Na2S2O3加入量。振荡时间对Fe3+还原反萃取的影响试验结果如图1所示。

—■—4 mol/L HCl,2倍Na2S2O3理论加入量;—●—4 mol/L HCl,4倍Na2S2O3理论加入量;—▲—3 mol/L HCl,2倍Na2S2O3理论加入量。
由图1看出,在不同还原剂加入量条件下,振荡时间对还原反萃取Fe3+的影响趋势基本一致:反应时间越长,Fe3+反萃取效果越好;反应2 min后,Fe3+反萃取率变化较小;反应10 min后,Fe3+反萃取率基本稳定。

2.2.2盐酸浓度与Na2S2O3加入量对配合还原反萃取Fe3+的影响
P204有机溶液体积100mL,盐酸体积为50 mL,Na2S2O3加入量为理论量的1~6倍,振荡时间12 min,Fe3+反萃取率随盐酸浓度与Na2S2O3加入量的变化关系如图2所示。
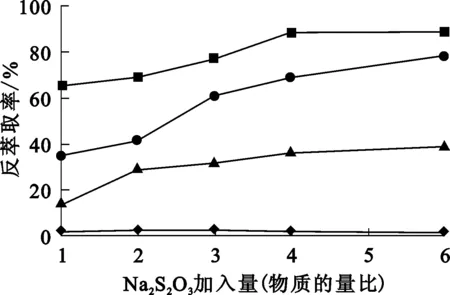
—■—5 mol/L HCl;—●—4 mol/L HCl;—▲—3 mol/L HCl;—◆—2 mol/L HCl。
由图2看出:随HCl浓度提高,Fe3+还原反萃取效果趋好;盐酸浓度为2 mol/L时,Fe3+反萃取率很低,说明在无配合反萃取条件下,直接加入Na2S2O3几乎无法达到还原效果。Na2S2O3溶于水相后,难以与有机相中的Fe3+形成有效碰撞,使其还原为Fe2+;另外,在一定范围内提高Na2S2O3加入量,明显有利于Fe3+的反萃取,因为Na2S2O3与水相中的H+反应生成Na2SO3,而Na2SO3在此条件下无法还原Fe3+:因此,Na2S2O3过量加入才能有较好的还原反萃取效果。盐酸浓度为5 mol/L,Na2S2O3加入量为理论量的4倍时,Fe3+反萃取效果较好,反萃取率为90%左右。
2.2.3萃取相比对配合还原反萃取Fe3+的影响
P204有机相50~200 mL,盐酸体积50 mL,盐酸浓度5 mol/L,Na2S2O3加入量为理论量的4倍,振荡时间12 min或间歇振荡(振荡4 min后停止4 min,再继续振荡4 min),相比Vo/Va对Fe3+反萃取的影响试验结果如图3所示。
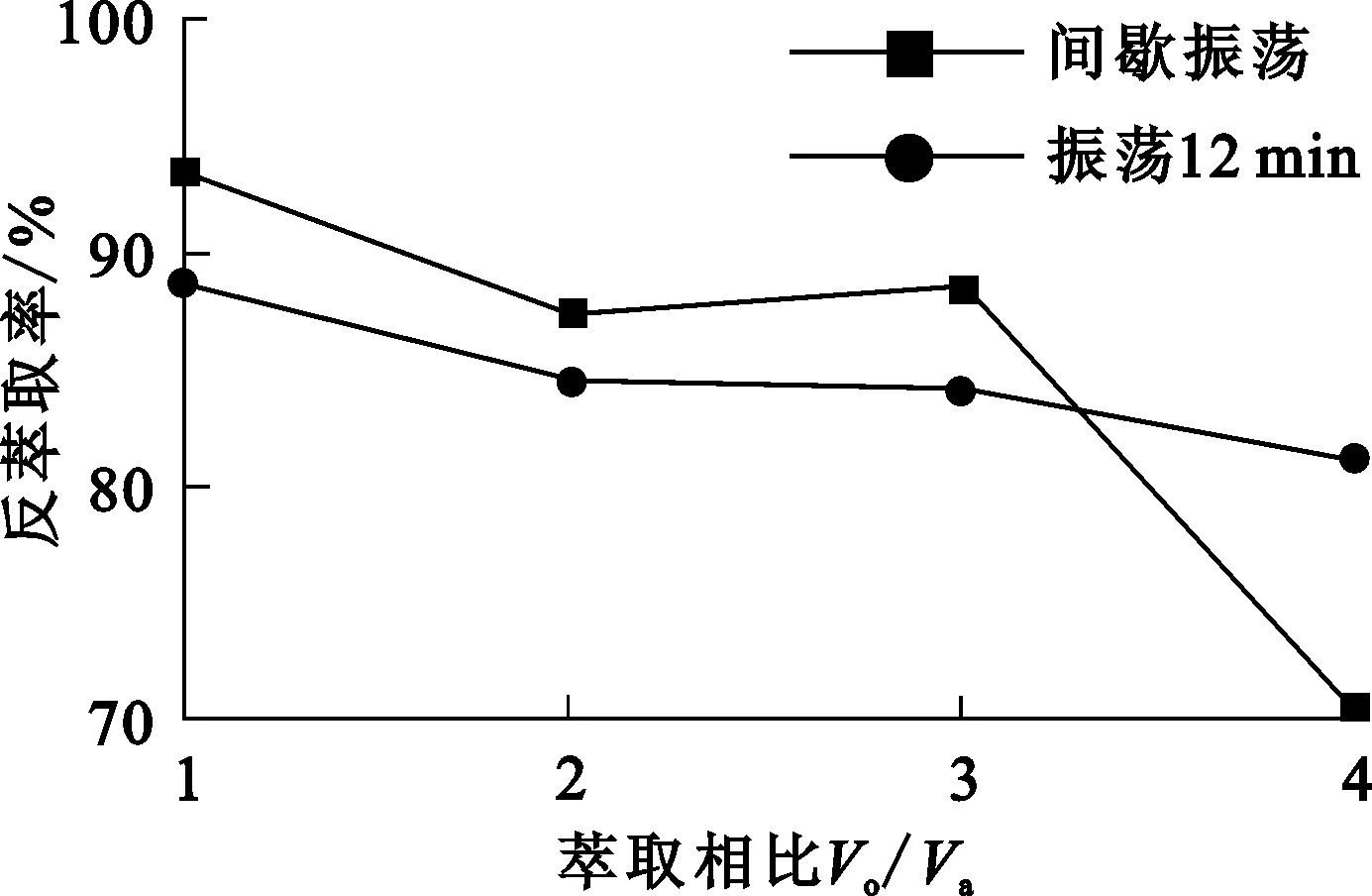
图3 萃取相比对Fe3+反萃取的影响

3 结论
用4 mol/L盐酸溶液可以从P204有机相中反萃取Fe3+,但其反萃取率相对较低,仅为28%左右。体系中加入4倍理论量的硫代硫酸钠,可有效促进盐酸反萃取Fe3+。在相比Vo/Va=3/1时,先加入盐酸振荡反应4 min,再加入硫代硫酸钠间歇振荡12 min,可取得较好反萃取效果,Fe3+反萃取率达90%。
试验中可考虑加入适量NaCl,有效提高Cl-浓度、降低溶液中H+浓度,减少酸雾的形成。得到的反萃取液可循环使用,富集Fe2+后用于制备FeCl2产品,回收剩余盐酸,也是下一步研究的方向。
