大鼠比目鱼肌梭内肌细胞钙超载模型的建立
2018-10-15赵雪红樊小力曹健朱娟霞
余 蕾, 赵雪红, 樊小力, 曹健, 朱娟霞
(1. 西安医学院 基础医学部, 西安 710021; 2. 湖北文理学院 医学院, 襄阳 441053; 3. 西安交通大学 医学部, 西安 710016)
近年来,中国航天事业实现了快速发展,随着2016年10月神州十一号飞船升空,我国已先后有14名宇航员进入太空。然而中长期的太空飞行可导致宇航员肌肉萎缩,这不仅影响了宇航员在航天飞行过程中的作业能力,待其返回地面后肌肉萎缩无法立即缓解,出现平衡障碍、无法站立等情况,又将严重影响其地面上的工作与生活[1-2]。既往研究发现,在模拟失重条件下,肌梭自发放电减少,传向中枢的神经冲动减少,肌紧张减弱,肌肉活动减少,肌梭的超微结构呈退行性改变,胞内出现钙超载[3-6]。以往在体研究中发现模拟失重情况下可同时出现肌梭内高钙及肌梭传入放电减少的现象,然而两者之间是否存在直接联系未见报道,而体研究存在诸多影响因素,无法直接说明Ca2+对肌梭结构和功能的影响。到目前为止,肌梭结构特殊未见到离体肌梭的钙超载模型,为此,本研究采用Ca2+导入剂Ionomycin 将Ca2+转入梭内肌细胞,建立梭内肌细胞钙超载模型,并利用激光扫描共聚焦技术实时观测肌细胞内游离Ca2+浓度的变化,为研究钙超载在肌萎缩发生、发展过程中的作用,尤其是钙超载对肌梭的影响提供一种新的实验模型。
1 材料与方法
1.1 实验动物与药品
实验动物选用无疾病、健康活泼的SD品系雄性大鼠,体重在220~250 g之间,购自西安交通大学实验动物中心。根据体重配对原则,实验动物被随机分2 μmol/L Ionomycin(Ion2)组和5 μmol/L Ionomycin(Ion5)组,每组均设正常自体对照,每组动物6只。
Fluo-3/AM 原液:将0.5 mg Fluo-3/AM 粉末避光溶于0.5 mL的二甲基亚砜(DMSO),分装后-20℃避光存放备用。使用时用Hanks′液稀释Fluo-3/AM 原液至浓度为10 μmol/L即可。
Ionomycin原液:避光取1 mL的二甲基亚砜(DMSO)溶解1 mg Ionomycin 粉末,分装后-20℃避光存放备用。使用时用Hanks′液稀释Ionomycin原液至所需浓度即可。
1.2 大鼠比目鱼肌单一肌梭标本的制备
使用乌拉坦(1.5 g/kg) 腹腔注射麻醉大鼠,分离并取出一侧比目鱼肌,置于Leiboviz′s 15 (L-15)培养基中[7],持续通氧。以聚光灯为光源,在双目解剖显微镜和倒置显微镜下,利用分离针分离肌梭。因肌梭与梭外肌平行排列,分离时应沿着肌肉长轴逐步剥离肌梭周围的梭外肌、血管等组织,直至分离出完整的肌梭,注意保持肌梭形态完整和梭囊表面光滑。将分离出的肌梭平铺展开,并贴于改良的细胞培养盒底部的经明胶-多聚赖氨酸处理过的载玻片上。
1.3 比目鱼肌梭内肌纤维Ca2+荧光强度的测量
将Fluo-3/AM原液用Hanks′液避光稀释为终浓度10 μmol/L,加入盛有肌梭样本的培养盒,常温避光孵育45 min后,用Hanks′液冲洗2遍,随后在激光扫描共聚焦显微镜(Leica,TCS Sp2,Germany)下观察标本,设置激发波长为488 nm,发射波长为550 nm,调整显微镜聚焦,对肌梭标本进行观察。设置扫描参数,每30 s扫描1次,连续扫描12 min,于连续扫描的第2分钟给予Ionomycin,观察随后的10 min内梭内肌纤维Ca2+荧光强度的动态变化。每个肌梭只用于一种浓度的Ionomycin液的观察。
1.4 统计分析
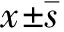
2 结果
Fluo-3/AM是一种对Ca2+敏感的荧光探针,它可通过细胞膜进入细胞,继而与胞浆中的游离Ca2+结合,并且在激发光的作用下显示荧光,其荧光强度与细胞内游离Ca2+(结合了Fluo-3)浓度成正比,因此测得的荧光强度可作为反映细胞内游离Ca2+浓度的指标。正常情况下,大鼠比目鱼肌梭内肌细胞内呈现一定的荧光强度,且均匀分布。给予Ionomycin后大鼠比目鱼肌梭内肌细胞内Ca2+浓度明显升高,且随着Ionomycin浓度的增加,Ca2+浓度达峰所需时间缩短,达峰后Ca2+浓度衰减所需时间延长。
A:给药前; B:给予2 μmol/L Ionomycin后; C:给药前; D:给予5 μmol/L Ionomycin后
图1大鼠比目鱼肌梭内肌细胞Ca2+荧光共聚焦显微图像
Fig 1 Images of confocal laser scanning microscopy of soleus intrafusal muscle cell calcium in rats
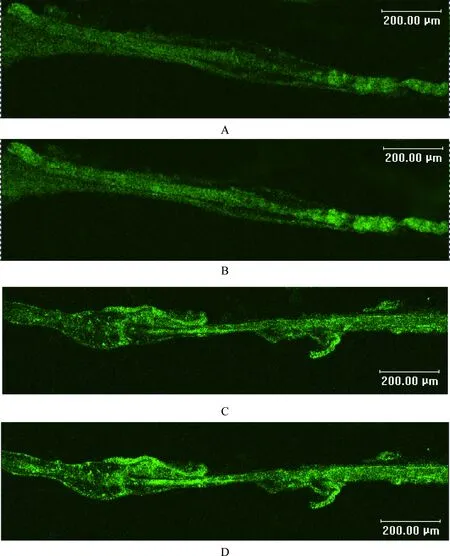
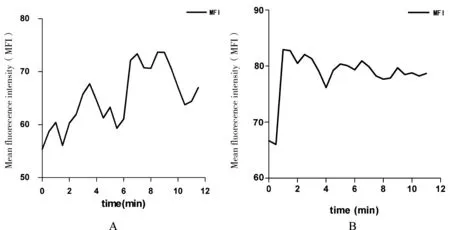
Ion2组:实验选取18例肌梭标本,观察发现正常比目鱼肌梭内肌细胞内呈现一定的荧光强度,且荧光均匀地分布于梭内肌纤维,其MFI为54.82±2.12。给予2 μmol/L Ionomycin后,荧光强度大幅波动后逐渐升高,(5.54±0.69) min后达峰,其MFI为68.32±3.79。与给药前相比,MFI增加了24.6%,差异有统计学意义(P<0.01,见图1)。达峰后荧光强度在高水平维持时间较短(见图2),达峰后(2.67±0.43)min,MFI最大增值(即给药后MFI的峰值减去给药前的基础MFI值)降低50%(见图3)。
Ion5组:实验选取18例肌梭标本,观察发现正常比目鱼肌梭内肌细胞内MFI为63.64±3.35。给予5 μmol/L Ionomycin后,荧光强度立即升高,(2.23±0.64)min后达峰,其MFI为82.18±4.81。与给药前相比,MFI增加了29.1%,差异有统计学意义(P<0.01,见图1)。达峰后荧光强度可在高水平维持相当长的一段时间(见图2),达峰后(6.26±0.87)min,MFI最大增值降低50%(见图3)。
A: Ion2组代表; B: Ion5组代表
图2大鼠比目鱼肌梭内肌细胞Ca2+荧光强度变化时程图
Fig 2 The time history curves of fluorescenee intensity of soleus intrafusal muscle cell calcium in rats
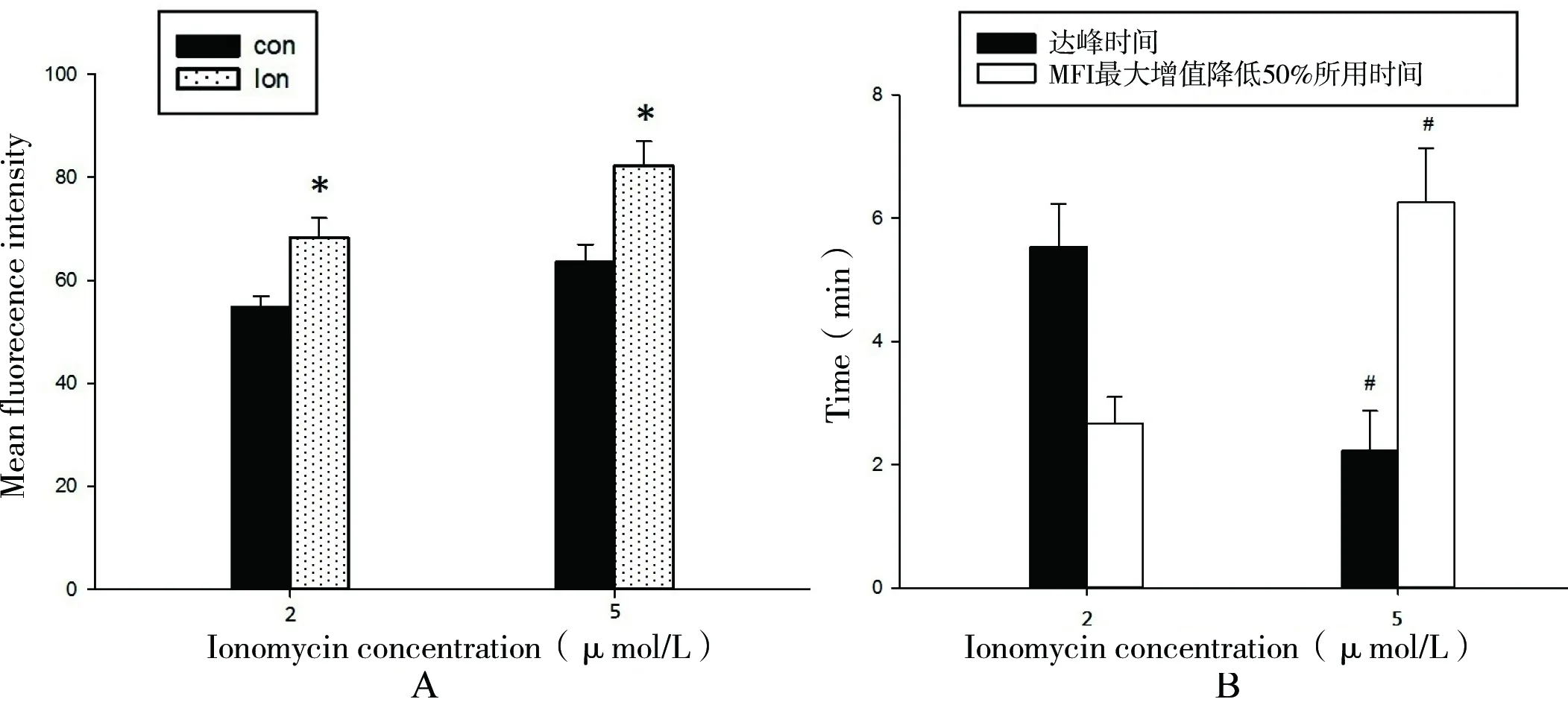
A: 荧光强度;*:P<0.01,与正常对照的MFI相比。B: 达峰及衰减所用时间;#:P<0.05,与2 μmol/L Ionomycin组相比
图3 Ionomycin对大鼠比目鱼肌梭内肌细胞Ca2+的影响
Fig 3 Elfects of ionomycin on intrafusal soleus muscle cell calcium in rats
3 讨论
Ca2+触发了骨骼肌细胞的兴奋-收缩耦联,从而启动了肌肉收缩的过程,它同时还作为第二信使参与基因转录、蛋白质代谢、细胞增生及维持肌纤维类型等多种细胞功能。细胞内存在一种钙结合蛋白,可以与胞内的游离Ca2+结合,从而降低细胞内的游离Ca2+浓度,起到缓冲及对抗胞内钙超载的作用[8]。研究发现,仅在模拟失重3 d时,梭内、外肌纤维胞浆游离Ca2+浓度即明显增多,且随模拟失重时间的延长而加重;至模拟失重14 d,肌细胞内出现钙超载现象,并可见到梭内肌纤维中钙结合蛋白D-28K的表达明显减少,与胞浆游离Ca2+的结合减弱,细胞抵抗钙超载的毒性作用减弱[4,9]。
Ca2+导入剂作为研究细胞内钙超载的实验工具,早已用于各种细胞的实验研究中,已成为研究各种细胞内钙调控机制的重要工具之一。其中最常用的Ca2+导入剂有拉纱洛西(lasalicid)、尼日尼亚菌素(nigericin)、A23187 和Ionomycin 等,它们都能与Ca2+形成复合物并通过细胞膜的脂质双层膜。随后的研究发现[10-11],除A23187 和Ionomycin 外,其他导入剂的专一性很差。Ionomycin可高效、专一的结合Ca2+,它可与Ca2+按照1∶1的比例结合并将Ca2+由胞外转运到胞内。与A23187相比,Ionomycin转运Ca2+进入细胞的能力明显更强。其作用机制包括经跨膜转运使胞外钙内流、动员胞内钙库释放钙、继发于钙库排空后的调控储存电容性通道[12-14]。更重要的是,Ionomycin 在转运Ca2+进入膜内的过程中,还可使细胞膜两侧的电位保持原来水平。业已证实,膜电位改变可对细胞的代谢、病理生理等方面产生重要影响,使研究受到其他因素的干扰,从而影响研究结果。故本实验采用Ionomycin 建立钙超载模型明显优于其他方法,且不影响电生理实验结果,故该模型适用于研究钙超载对肌梭电生理活动的影响。
Fluo-3/AM是一种对Ca2+敏感的荧光探针,它可通过细胞膜进入细胞,继而与胞浆中的游离Ca2+结合,并且在激发光的作用下显示荧光,其荧光强度与细胞内游离Ca2+浓度成正比,因此实验所测得的荧光强度可真实地反映细胞内游离Ca2+的浓度。实验中测得Ion2与Ion5两组肌梭正常情况下的基础荧光强度差异较大,这主要与肌梭个体差异性有关,每个肌梭内所含的梭内肌纤维数目、大小以及活性不尽相同,这就决定了梭内肌纤维内Ca2+荧光强度不同。然而由于实验采用的是自身对照,所以这种差异对实验结果影响不大。本实验发现,给予2 μmol/L Ionomycin后,梭内肌细胞内出现大幅度的钙振荡,而后Ca2+浓度升高,但在高水平维持时间较短;给予5 μmol/L Ionomycin,则可迅速使胞内Ca2+浓度增高,并维持相当长的一段时间(见图3),这与Jiang等[15]的报道相一致。大幅度钙振荡的形成可能是因为钙泵的激活对Ca2+的外排与Ionomycin对Ca2+的导入相互冲抵的结果。本实验Ion5组由于给予的 Ionomycin浓度较高,单位时间内携带的Ca2+也更多,对钙泵的活动有一定的抵消作用,胞内高钙状态维持时间较长,形成了较长时间的钙超载。
4 结论
本实验采用激光扫描共聚焦技术,通过给予Ca2+导入剂Ionomycin,观察Fluo-3/AM标记的梭内肌细胞内游离Ca2+浓度的变化。结果表明,2 μmol/L Ionomycin可以形成短期的钙超载,而5 μmol/L Ionomycin则可以形成长时间的钙超载。本实验成功地建立了梭内肌细胞钙超载实验模型,为进一步研究Ca2+对肌梭传入放电的影响奠定了良好的基础。
