膀胱癌细胞YTS-1的条件培养基诱导膀胱上皮细胞HCV29发生上皮间质转化和糖链表达变化
2018-10-15徐晓强郭佳关锋
徐晓强, 郭佳,2, 关锋,3
(1. 江南大学 生物工程学院, 无锡214122; 2. 常州大学 生物医学工程与健康科学研究院, 常州 213164;3. 西北大学 生命科学院, 西安 710069)
上皮间质转化(Epithelial mesenchymal transition,EMT)是肿瘤转移的重要过程[1],EMT过程中细胞形态由上皮向间质转变,伴随着上皮细胞标志蛋白E-cadherin表达减少,间质细胞标志蛋白fibronectin,N-cadherin表达上调,同时细胞行为向恶性转变。它赋予细胞转移和入侵的能力,包括干细胞特征、减少凋亡与衰老[2]。
糖基化修饰是一种最普遍的翻译后修饰,能够调控和介导多种细胞间和细胞与基质间的相互作用,在细胞黏附、信号传导、受体与配体互相识别等方面发挥着重要作用[3]。糖基化水平的改变与感染、炎症、癌症等众多疾病紧密相关,肿瘤的EMT过程通常也伴随着糖基化修饰的改变。黏蛋白类O-糖链的大量表达会导致结肠癌病人的不良预后并且使细胞发生EMT转化[4]。本实验室前期的研究发现了小鼠乳腺上皮细胞NMuMG经过转化生长因子β(transforming growth factor-β,TGF-β)的诱导能发生EMT过程,从而导致细胞高表达高甘露糖型以及唾液酸型N-糖链[5]。
癌症的发生通常受到肿瘤细胞与正常细胞间信息传递的影响,肿瘤细胞能够通过传递DNA,microRNA,mRNA,脂质以及与侵袭相关的蛋白等来改变正常细胞的行为[6]。条件培养基(Conditioned medium,CM)是将培养过细胞的培养基除去细胞留取的上清液,能够作为培养其他细胞或作为其他细胞培养基的添加成分,含有由细胞分泌的细胞因子如生长因子等。本研究以基质浸润性膀胱癌细胞YTS-1获取的条件培养基为研究对象培养膀胱上皮细胞HCV29,检测了细胞迁移,增殖和凋亡以及EMT标志蛋白的表达,同时通过基质辅助激光解吸飞行时间质谱(Matrix-Assisted Laser Desorption/ Ionization Time of Flight Mass Spectrometry,MALDI-TOF-MS)和凝集素芯片检测了细胞糖链表达谱的变化,发现恶性膀胱癌细胞获取的条件培养基能够诱导膀胱上皮细胞发生EMT转化并导致糖链表达的改变。
1 材料与方法
1.1 材料
人正常膀胱上皮细胞株HCV29和人浸润性膀胱癌细胞株YTS-1为美国华盛顿大学Hakomori教授馈赠;凝集素芯片所用到的37种凝集素购于美国Vector公司;fibronectin和N-cadherin抗体购于美国Santa Cruz公司;RPMI1640培养基购于美国HyClone公司、胎牛血清(Fetal Bovine Serum,FBS)购于以色列Biological Industries 公司;凋亡检测试剂盒和BCA试剂盒购于北京碧云天公司。
1.2 方法
1.2.1 细胞培养与条件培养基的提取
细胞株均使用含10% FBS并添加青霉素和链霉素的RPMI 1640培养基培养,于37℃,5% CO2的细胞培养箱中培养。恶性膀胱癌细胞YTS-1于正常培养基培养至70%汇合度后弃去培养基,无菌PBS清洗3遍,加入含1%胎牛血清的RPMI 1640培养基培养24 h后,取上清,0.22 μm滤膜(Millipore)过滤除菌待用。
1.2.2 蛋白免疫印迹
收集细胞,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗细胞3次,加入RIPA蛋白裂解液(含1%PMSF和0.1%抑肽酶),冰上裂解细胞30 min,14 000 r/min 离心15 min,取上清,BCA法测蛋白浓度。样品加入5×Loading Buffer,煮沸5 min,取20 μg蛋白,用10%的聚丙烯酰胺凝胶进行电泳。电泳后,将蛋白转移至0.22 μm PVDF膜,用5%脱脂奶粉37℃封闭1 h,一抗4℃孵育过夜,TBST漂洗5次,再将膜与辣根过氧化物酶HRP标记的二抗室温孵育1 h,TBST漂洗5次,采用Pro-Light HRP化学发光检测试剂显色,用ChemiDocTMXRS+成像系统进行图像采集及定量分析。
1.2.3 细胞迁移与增殖实验
细胞迁移:将适量的HCV29细胞接入6孔板中,在完全培养基中培养过夜,吸取培养基,分别用加样器枪头在每个孔中划线,用PBS冲洗3次,分别加入含1%血清的培养基和条件培养基,分别在培养24、48 和72 h时进行拍照。细胞增殖:细胞铺于96孔板,每孔100 μL约2000个细胞,实验组与对照组分别加入1%血清和Y-CM培养基, 24、48、72 h后加入MTT试剂,在37℃孵育4 h,加入150 μL DMSO后在490 nm测定吸光度。
1.2.4 细胞凋亡实验
PBS洗涤贴壁细胞1次,加入适量胰酶消化细胞,把细胞转移到离心管内,1000 r/min离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数,取50 000个重悬的细胞,1000 r/min离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC,轻轻混匀, 加入10 μL碘化丙啶染色液,轻轻混匀。室温避光孵育10 min,流式细胞仪检测荧光信号。
1.2.5 凝集素芯片
凝集素芯片实验由西北大学李铮教授课题组提供实验帮助,取37种市售凝集素点样于玻片固定,荧光染料cy3标记细胞提取的糖蛋白样品后与凝集素孵育,PBST漂洗后芯片扫描仪获取荧光和背景值等信息进行分析。
1.2.6 糖链的释放及MALDI-TOF质谱解析
蛋白于10 ku超滤管中浓缩,8 mol/L尿素,10 mmol/L二硫苏糖醇(DL-Dithiothreitol,DTT),10 mmol/L碘乙酰胺(Iodoacetamide,IAM)变性,加入PNGase F酶 (New England BioLabs; Ipswich, MA, USA)于37℃过夜酶切释放N-糖链,Sepharose 4B凝胶中清洗除盐后冷冻干燥。甲醇 ∶水=1∶1,取1 μL样品和1 μL DHB基质混合后点样,进行质谱分析,利用glycoworkbench软件数据库进行检索。
1.2.7 数据分析
用gel-pro和image pro plus进行凝胶电泳及细胞划痕定量分析。采用PraphPad Prism 6进行t检验分析,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 Y-CM能够诱导HCV29细胞高表达EMT标志蛋白
肿瘤细胞获取的条件培养基由于含有多种细胞因子从而可能导致上皮细胞发生表型的变化,实验发现Y-CM分别处理HCV29细胞24、48和72 h,Western Blot实验结果显示处理后的HCV29细胞高表达FN和N-cad(图1),因为FN和N-cad是间质细胞的标志蛋白,因此判断HCV29细胞在经Y-CM诱导后发生EMT转化。
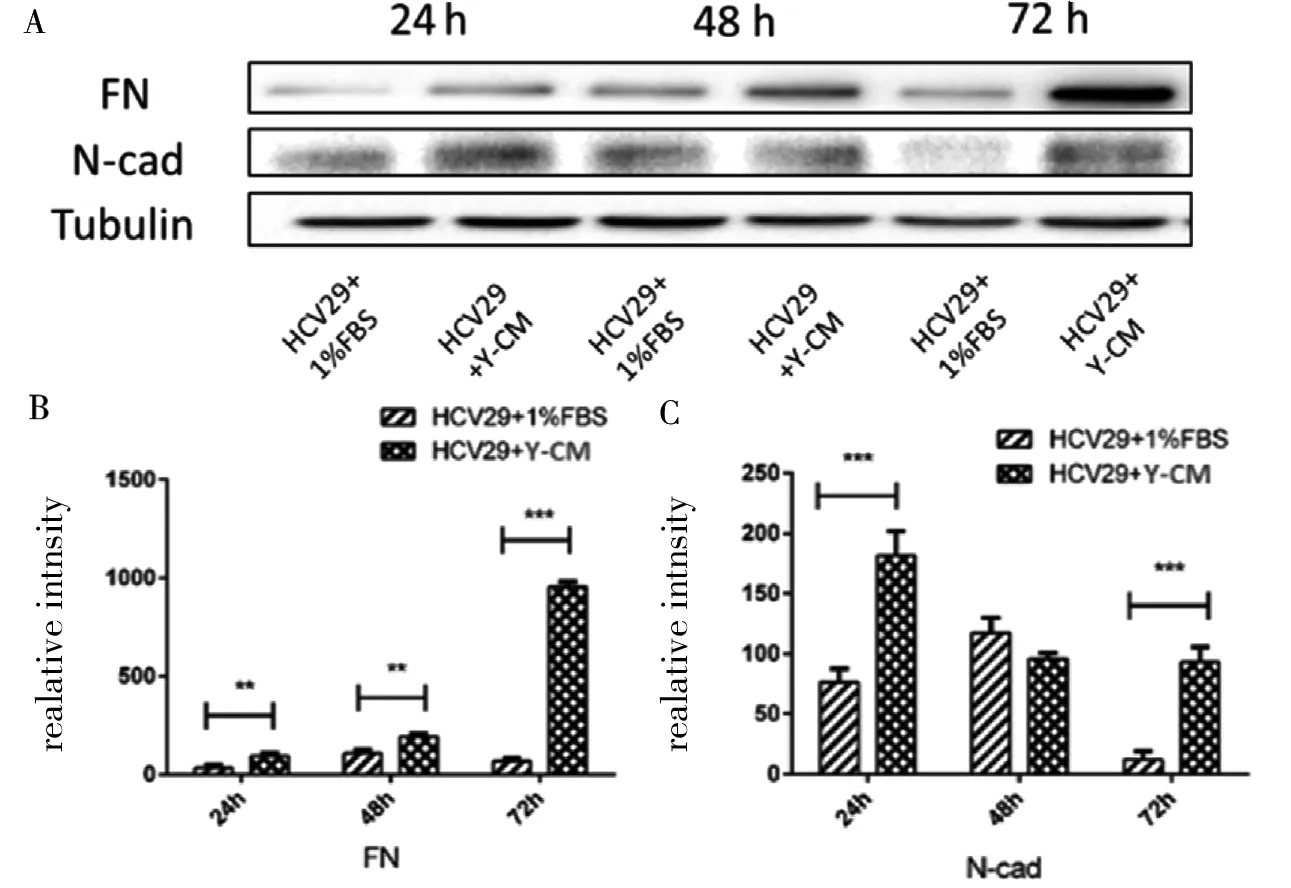
A:蛋白水平检测;B:FN表达量化图;C:N-cad表达量化图。*:P<0.05,**:P<0.01,***:P<0.001
图1 Y-CM处理HCV29细胞中EMT标志蛋白的表达
Fig 1 Expression of EMT marker
2.2 Y-CM能够促进HCV29细胞的增殖和迁移,抑制细胞的凋亡
MTT实验发现,经过Y-CM培养24、48和72 h后的膀胱上皮细胞HCV29增殖能力明显增强(图3-B),细胞划痕实验发现Y-CM培养24、48和72 h后细胞的迁移能力也明显增强(图2)。碘化丙啶(Propidium Iodide, PI)可以染色坏死细胞或处于凋亡晚期丧失细胞膜完整性的细胞,在细胞发生凋亡的早期,不同类型的细胞都会把磷脂酰丝氨酸外翻到细胞膜外侧,而Annexin V可以和外翻到细胞表面的磷脂酰丝氨酸结合,流式检测细胞凋亡发现Y-CM处理24 h后细胞的凋亡能力明显受到抑制(图3-A)。这些发现说明经过条件培养基处理后的HCV29细胞向恶性转变,而这些改变与发生EMT转变后的表型相一致。

A:Y-CM培养组与对照组划痕实验图;B:划痕实验量化图
图2 Y-CM对HCV29细胞迁移能力的影响
Fig 2 Effect of Y-CM on cell migration

A:流式细胞术检测Y-CM对细胞凋亡的影响;B:Y-CM对细胞增殖的影响
图3 Y-CM对细胞凋亡和增殖的影响
Fig 3 Effect of Y-CM on cell apoptosis and cell proliferation
2.3 MALDI-TOF-MS以及凝集素芯片检测细胞糖链的表达变化
N-糖基化修饰的改变伴随着众多癌症的发展过程。本实验利用了MALDI-TOF质谱检测了Y-CM培养24 h前后HCV29细胞N-糖链的表达情况,选取信噪比大于5的质谱峰利用GlycoWorkbench软件进行搜库并注释(表1)。其中4种糖链结构在对照组中而未在Y-CM处理组中发现,一种结构只在Y-CM处理组检测到,利用质谱峰的相对强度进行归一化后进行相对定量后,发现Y-CM培养组细胞表达甘露糖型N-糖链比例由79%下降至49.8%,而杂合型,复合型,岩藻糖和唾液酸型N-糖链含量都有不同程度的上升(图5)。为了验证质谱数据,本研究进一步进行了凝集素芯片检测。凝集素是一类从各种植物,无脊椎动物和高等动物中提纯的糖蛋白,不同来源的凝集素能够识别并结合不同糖型的糖缀合物。我们将市售的37种凝集素固定至玻片上,通过与细胞提取的蛋白孵育并显色,得到完整的糖链表达谱(图4),其中有7种糖链结构在Y-CM处理组中高表达,17种糖链结构在Y-CM处理组低表达。Y-CM培养的细胞提取蛋白与凝集素ConA(识别并结合高甘露糖糖型糖链)的结合能力相比对照组明显减弱,与凝集素SNA(识别并结合唾液酸)以及PHA-E(识别并结合平分型N-糖链,是杂合型N-糖链的主要类型)的结合能力上升,这些结果与质谱的解析结果相符合。
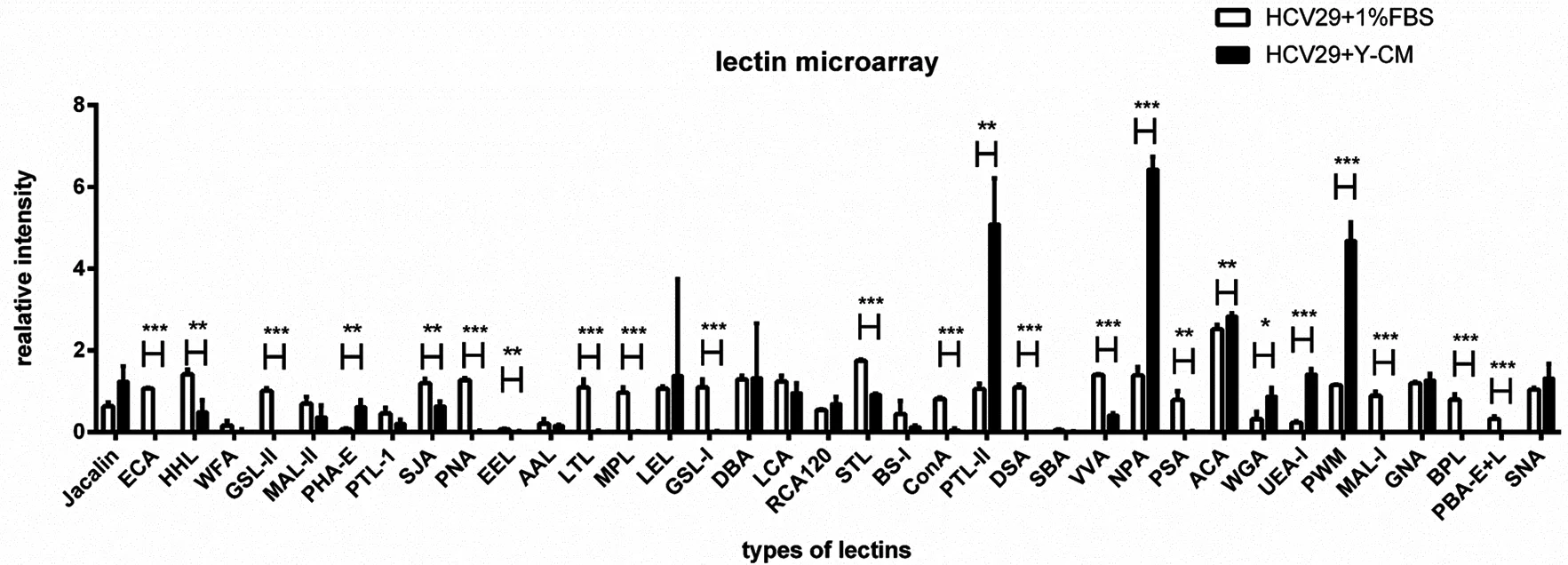
*P<0.05,**P<0.01,***P<0.001
图4凝集素芯片检测糖链表达
Fig 5 Glycan expression analyzed by lectin microarray
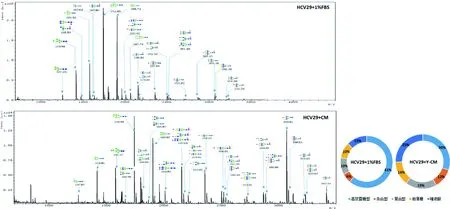
A:HCV29+1%FBS培养后N-糖链表达;B:HCV29+Y-CM培养后N-糖链表达;C:N-糖链表达量化分类图
图5质谱检测Y-CM对细胞N-糖链表达的影响
Fig 5 Alteration of N-glycan profiles in HCV29 induced by Y-CM
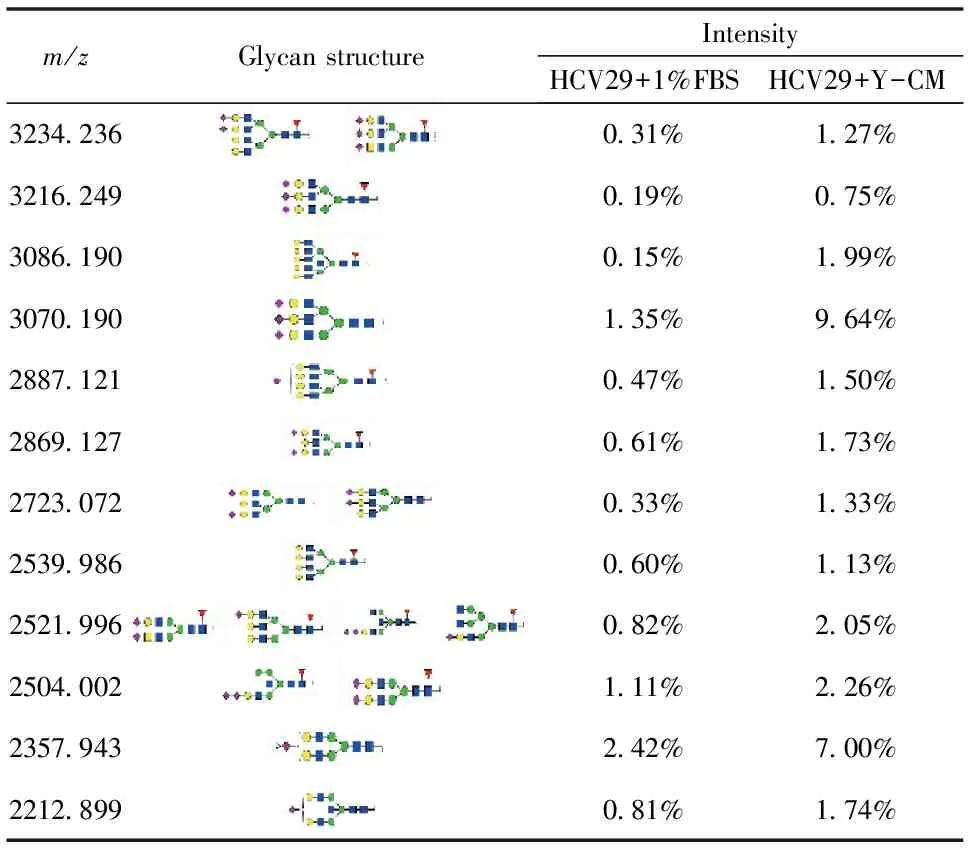
表1 对照组与Y-CM处理组细胞N-糖链结构及相对强度

续表1(Continued Table 1)
3 讨论与结论
细胞间物质和信息的传递是细胞必需的生理过程,条件培养基中包含了蛋白质、核酸、脂质以及各种细胞因子,这些物质能够在细胞间互相传递并发挥重要的作用[6]。Pawitan等[7]研究测试了不同干细胞来源的条件培养基,发现这些条件培养基一定条件下都可以促进组织修复,并且对多种疾病都有很好的治疗效果。Kasashima等[8]研究发现骨髓干细胞来源的条件培养基能够促进胃癌细胞的增殖和迁移。骨髓基质细胞与头颈鳞癌细胞共培养后得到的条件培养基能够诱导头颈鳞癌细胞发生EMT转化[9]。膀胱癌来源的成纤维细胞的条件培养基中TGF-β1的含量相比于正常的膀胱上皮细胞获得的条件培养基明显升高,并且能够提高膀胱癌细胞的侵袭能力[10]。本研究发现基质浸润性膀胱癌细胞来源的条件培养基能够诱导正常膀胱上皮细胞发生EMT转化并使细胞表型向恶性转变。
EMT过程常常伴随着糖基化修饰的改变,有研究发现TGF-β处理HCV29细胞能够诱导EMT过程并且改变细胞糖链的表达[11]。Mgat5基因是编码合成β1,6-GlcNAc分支 N-糖链的基因,有研究报道该基因的高表达是EMT过程所必需的[12]。癌胚胎纤连蛋白(oncofetal fibronectin,onfFN) 上的GalNAc型O-糖基化修饰在TGF-β诱导人的前列腺上皮细胞发生EMT转化后高表达[13],研究发现干扰GalNAc转移酶6和3能够抑制TGF-β诱导的EMT转化。本研究中Y-CM培养HCV29细胞后,细胞也发生了糖基化修饰的改变,质谱解析发现相比对照组,Y-CM处理组低表达高甘露糖型,高表达复合型、杂合型、岩藻糖以及唾液酸型糖链。2-脱氧葡萄糖(2-deoxy-D-glucose,2DG)是一种肿瘤细胞生长抑制剂,研究发现2DG处理结肠癌细胞后细胞高表达甘露糖修饰的糖蛋白[14]。有研究表明胃癌细胞高表达唾液酸型糖链,且表达量与细胞的侵袭和迁移能力呈正相关[15]。岩藻糖修饰在结肠癌细胞中高表达,且过表达岩藻糖基转移酶3和6能够促进TGF-β诱导的EMT转化[16]。糖基化修饰的改变是EMT转化的一个重要特征,本研究中发现的糖链变化特征与恶性肿瘤细胞的表达特征相符合。
综上所述,本研究揭示了恶性膀胱癌细胞获取的条件培养基能够改变膀胱上皮细胞表型并改变细胞的糖链表达谱,为后续研究条件培养基导致细胞发生糖基化修饰以及表型改变的分子机制提供了实验依据。
