凡纳滨对虾黄鳃病病原菌鉴定分析及组织病理学观察
2018-10-15陈正涛赵琳莹沈伟良徐胜威金中文陈彩芳
陈正涛, 赵琳莹, 沈伟良, 徐胜威, 金中文,陈彩芳
(1. 宁波市海洋与渔业研究院,宁波 315040; 2. 浙江万里学院,宁波 315100)
凡纳滨对虾属广温广盐性热带虾类,不仅在海水中广泛养殖,也可在淡水中养殖,在我国有30余年的养殖史,是我国最重要的养殖虾之一[1-2]。目前,已在我国山东、海南、福建等地区大规模养殖,取得了显著的经济效益[2]。然而,随着养殖规模的扩大、养殖密度的提高、养殖环境的污染以及养殖管理的滞后,对虾病害频发,目前严重制约着对虾养殖业的发展[3-5]。对虾细菌性病害中,黄鳃病对养殖危害极大。福建省也有报道指出黄鳃病发病率可达70%以上,流行时间也由7—8月份持续到7—10月份,每年对虾养殖因黄鳃病损失在15%左右[6]。对于对虾黄鳃病的研究目前仅限于病原及防治上,而且结果也不一致[6]。李玉钢等[7]研究对虾发现,丹东地区发生的黄鳃病致病菌是革兰氏阴性的黄色杆状细菌;陈月忠等[6]对福建省几个养殖区对虾研究发现,对虾黄鳃病病原复杂多样,症状和危害程度也有一定的差异,主要病原包括细菌、纤毛虫、丝状细菌、壳吸管虫和镰刀菌5种。另外环境因素是对虾发病的主要外因,其中氨氮、H2S等含量增加,黄鳃病发病率也随之增高。周宸等[8]研究长毛对虾(Penaeuspenicillatus)黄鳃病发现黄鳃病属细菌性败血症,弧菌、假单胞菌、产气单包菌等均可引起虾黄鳃病,一般为继发性疾病,病虾会出现鳃薄板坏死,肝胰腺分泌小管萎缩等病理变化。目前,有关凡纳滨对虾黄鳃病组织病理变化、致病菌回感实验以及相应的药敏试验的研究尚为少见,本研究从患黄鳃病的病虾血液和致病部位分离出病原菌,通过人工回接实验重新感染凡纳滨对虾,从病理学角度对病虾的鳃组织进行观察分析,为凡纳滨对虾黄鳃病的致病机理研究及防治提供理论基础。
1 材料与方法
1.1 材料
病虾和健康虾(普瑞莫苗,购自广东湛江,体长7~9 cm),DNA提取试剂盒(Tissue DNA Kit)购自Omega公司(上海);PremixTaq酶为TaKaRa公司(大连);迪夫快速染色液(上海翊圣生物科技有限公司),比浊管为康泰生物(温州)生产;培养基等其他试剂为分析纯试剂(上海生工,上海);细菌16S rDNA通用扩增引物由华大基因合成。
Brain Heart Infusion(BHI)培养基(g/L):蛋白胨 10.0, 氯化钠 5.0, 磷酸氢二钠 2.5, 葡萄糖 2.0, 脱水小牛脑浸粉 12.5 g, 脱水牛心浸粉5.0 g, pH 7.4 ± 0.2。 Mueller-Hinton(MH)培养基(g/L):牛肉粉 2.0, 可溶性淀粉 1.5 g, 酸水解酪蛋白 15.5 g, pH 7.4 ± 0.2。波恩氏液: 苦味酸饱和液(1.22%)75 mL, 甲醛(37%~40%) 25 mL, 冰醋酸 5 mL。
1.2 病原菌的分离
取患黄鳃病的病虾(图1-A),用75%酒精棉消毒后,取虾鳃组织剪碎划线接种于BHI培养基平板,另取20~40 μL虾血淋巴接种于BHI培养基平板,28℃恒温倒置培养24 h后挑取优势菌落进行分离纯化,获得纯化培养菌株。将纯化的菌株经扩大培养后用16s rDNA鉴定,同时用20%甘油-80 ℃超低温冰箱保存备用[9]。

a:血细胞(erythrocyte);b:致病菌(pathogenic bacteria)
图1患病对虾(A),人工感染发病初期对虾(B),患病对虾血涂片(C)
Fig 1 The diseasedLitopenaeusvannamei(A),the diseasedLitopenaeusvannameiof artificial infection(B),The diseasedLitopenaeusvannameiofblood film
1.3 病原菌16S rDNA测序鉴定
将纯化后的菌株,挑单菌落接种到2 mL MH液体培养基中,28℃ 200 r/min振荡培养12 h后离心收集菌体,按照细菌基因组DNA试剂盒说明书提取细菌DNA作为模板DNA。利用16S rDNA通用引物27F:5′-AGAGTTTGATCMTGGCTCAG-3′;下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′进行PCR扩增。PCR反应体系(25 μL):PermixTaq酶 12.5 μL,上下游引物(10 μmol/L)各1 μL, DNA模板1 μL,ddH2O 9.5 μL。反应条件:94℃预变性4 min;94℃变性1 min,54℃退火1 min,72℃延伸1 min,37个循环;72℃再延伸8 min。PCR产物送华大基因进行序列测定,将测序结果与NCBI 序列比对,鉴定病原菌。
1.4 人工感染试验
实验所用健康虾(体长7~9 cm),体表颜色正常,行动敏捷无病症。在25℃ ±1℃,盐度25‰暂养一周确认无病后进行人工感染试验。
实验分为14组(13个实验组,1个对照组,每组3个平行),实验组中,7组为单一菌(1号~7号菌)浸泡感染,6个为两种菌(3号+5号、3号+6号、3号+7号、2号+4号、2号+6号、4号+6号, 此6组的两株菌来自同一病虾)同时感染(各菌株信息见表1)。每个平行25尾虾,饲养于5 L锥形瓶中,实验水温25℃±1℃,每天投饵3次,换水1次。实验组浸泡分离的菌液,菌液浓度调整为1×107CFU/mL,每次换水后,继续添加菌液。每天观察凡纳滨对虾生长状况并做好记录至明显出现黄鳃病症状。试验中出现黄鳃病症的实验组做二次验证。
1.5 病理组织制作与观察
取感染试验中的对照组健康虾和患黄鳃病症的病虾各5只,取鳃组织用波恩氏液固定24 h后,转移至70%酒精保存。取鳃组织经脱水、透明、浸蜡和石蜡包埋后,通过切片机(Thermo公司,上海)连续切片(3~6 μm)后进行H-E染色,中性树脂胶封片,显微镜(徕卡显微镜,德国)观察记录。
1.6 药物敏感性测定
1.6.1 供试抗菌药物药敏试验中测定了20种抗菌药物:盐酸诺氟沙星(Norfloxacin hydrochloride)、硫酸新霉素(Neomycin sulphate)、吡哌酸(Pipemidic acid)、磺胺甲恶唑(Sulfamethoxazole)、磺胺二甲嘧啶(Sulfadimidine)、氨苄青霉素(Ampicillin)、氨苄西林钠(Ampicillin Sodium)、氧氟沙星(Ofloxacin)、磺胺嘧啶(Sulfadiazine)、甲氧苄啶(Trimethoprim)、氟甲喹(Flumequine)、盐酸土霉素(Oxytetracycline)、磺胺间甲氧嘧啶(sulfamonomethoxine)、诺氟沙星(Norfloxacin)、氟苯尼考(Florfenicol)、红霉素(Erythromycin)、甲砜霉素(Thiamphenicol)、盐酸金霉素(Chlortetracycline hydrochloride)、多西环素(Doxycycline)、恶喹酸(Oxolinic acid)。
1.6.2 定性试验选用纸片法在普通BHI培养基平板上测定待测菌株对20种抗菌药物的敏感性。28℃恒温培养24 h后观察是否有抑菌圈并记录抑菌圈直径大小。根据抑菌圈直径判断待测菌株对药物的敏感性[10]。
1.6.3 定量试验将供试药物采用适宜的溶剂溶解,配成药物浓度为256 mg/L。在96孔细胞培养板中加入150 μL的MH液体培养基,然后用移液器在第一个孔加150 μL配好的药,混合均匀后吸取150 μL到第二个孔,以此类推制成药物浓度分别为128 mg/L、64 mg/L、32 mg/L……0.001mg/L 的2倍稀释药物进行实验。最后加入病原菌至终浓度约105cfu/mL,28 ℃恒温培养5 d,观察并记录。无细菌生长的最低药物浓度,即为药物的最小抑菌浓度(minimum inhibitory concentration,MIC)。
2 结果
2.1 病原菌分离鉴定
从患黄鳃病的凡纳滨对虾鳃组织和血淋巴中分离优势菌株共7株,利用16S rDNA 测序方法进行鉴定,菌株分离及鉴定信息见表1。

表1 凡纳滨对虾黄鳃病病原菌的分离与鉴定
2.2 人工感染试验结果
人工感染试验中,试验组“3号+7号”试验组出现明显烂鳃,两次感染时间分别为11 d和16 d;对比人工感染和自然患病对虾发现其症状相似,鳃部呈黄色或土黄色(图1)。 其他试验组及对照组均未出现黄鳃情况。
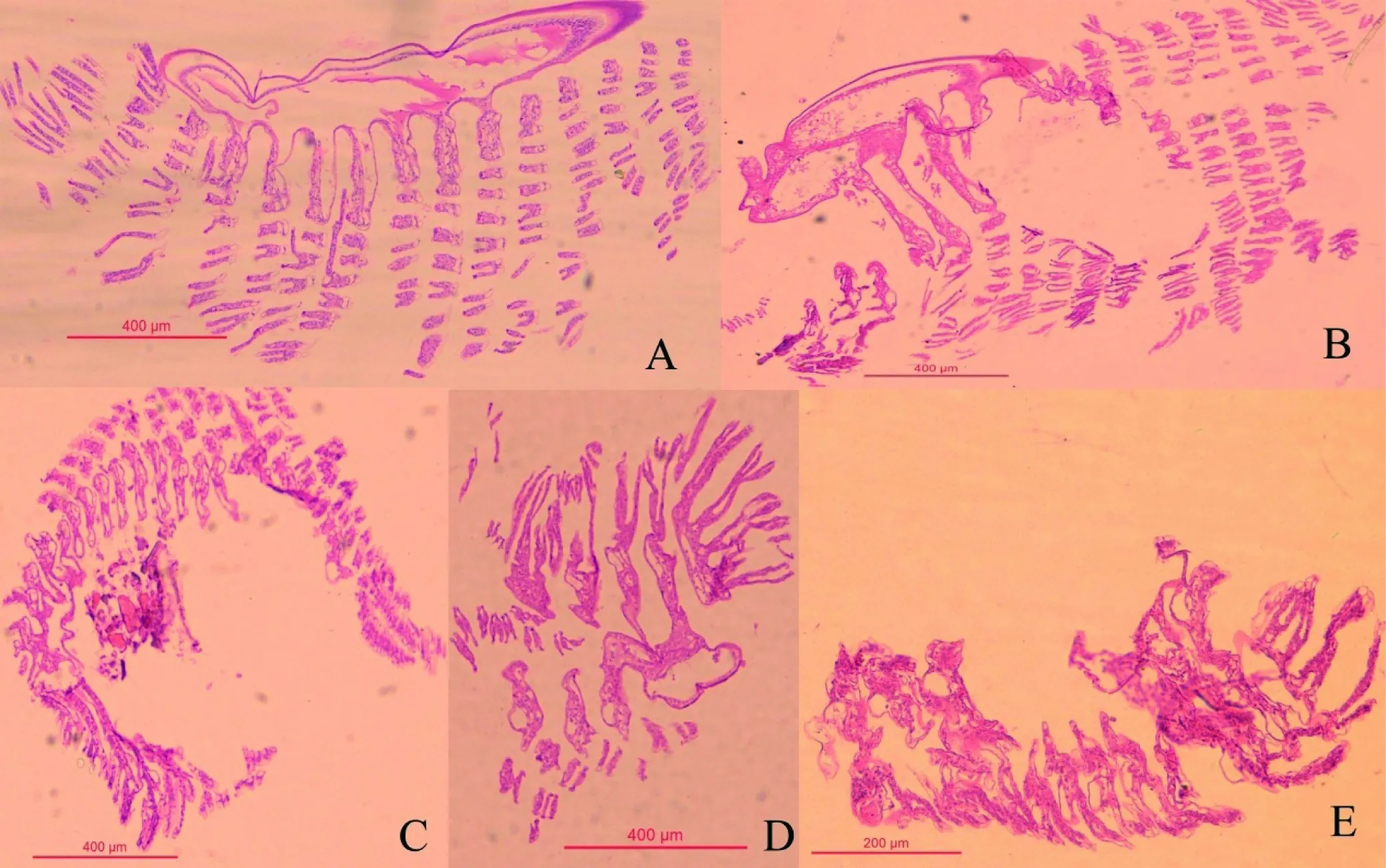
图2 正常虾(A), 发病初期(B), 发病中期(C), 发病后期(D), 发病末期(E)
2.3 组织病理结果
组织切片显示健康虾鳃结构完整、均匀,细胞结构正常(图2-A)。患病初期,鳃结构大部分完整,局部结构被破坏(图2-B);患病中期,鳃丝肿大,鳃组织间会有组织块出现(图2-C);患病后期,鳃组织松散,由鳃尖端向基部溃烂(图2-D)。 发病末期,鳃出现重度糜烂,鳃结构模糊(图2-E)。
2.4 药敏实验结果
采用纸片法测定3号菌和7号菌对20种抗菌药物的敏感性,结果显示3号菌对吡哌酸、氧氟沙星、氟甲喹、和恶喹酸等具有较高的敏感性,对磺胺二甲嘧啶、氨苄青霉素等不敏感;7号菌对氨苄西林钠、氧氟沙星和多西环素等具有较好的敏感性,对磺胺二甲嘧啶、氨苄青霉素、甲氧苄啶等不敏感。定量结果显示吡哌酸、氧氟沙星、氟甲喹对3号菌的最小抑制浓度分别为1、0.25和2 mg/L;氨苄西林钠、氧氟沙星和多西环素对7号菌的最小抑制浓度为0.008、0.5和1 mg/L(表2)。

表2 药敏试验结果
注:“/”表示未进行试验
3 讨论
有关凡纳滨对虾黄鳃病的研究,目前国内外还鲜见报道。本研究从患黄鳃病的凡纳滨对虾中分离了致病菌,并进行了鉴定。人工感染试验中,当罗尼氏弧菌和微小杆菌同时存在时,可以引起凡纳滨对虾出现黄鳃症状,基本确定凡纳滨对虾黄鳃病为细菌侵染患病,结果与周宸等[8]、李玉钢等[7]的研究结果类似。人工感染实验中两次感染时间不一致,说明感染周期可能与水中环境因素有关,而关于感染周期及致病机理还有待进一步深入研究。
对虾黄鳃病属细菌性败血症,细菌侵袭血液并在病灶处及血窦中显著增殖,在病变部位常会聚集大量的血细胞,并形成黑、红、黄3种色素沉积,产生黑色素沉积表现为黑鳃,黄色素沉积则为黄鳃[8]。1997年周凯等[11]通过对患黑鳃病中国对虾鳃组织电镜观察发现,在鳃组织的甲壳层和表皮层中有许多不同切面的杆状细菌,菌体周围的组织被破坏殆尽,细胞结构完全瓦解,寄主组织被腐蚀成许多圆形或不规则的空斑。通过石蜡切片发现病虾鳃丝充血,鳃组织严重坏死、断裂。鳃丝三级分支的末端有黑色素沉积,使鳃丝呈黑色条斑状。感染严重者的鳃丝大部分及鳃轴也发生黑变,鳃丝呈黑色条斑状。2002年吴惠仙等[12]研究患黑鳃病对虾鳃的黑色发现,是对虾受到病原体的感染或有害物质的刺激时出现的黑色素沉淀;用杀菌剂和抗生素能有效地抑制该病发生以及鳃丝发病部位严重病变,证明黑鳃病可能是由细菌引起的。我们在患黄鳃病凡纳滨对虾血液中发现了大量的弧菌(图1-C),从血淋巴中分离了罗尼氏弧菌,但是单独用罗尼氏弧菌人工感染试验时,对虾没有患黄鳃病,而用罗尼氏弧菌和微小杆菌同时感染时,却出现黄鳃症状。这种混合感染出现的对虾烂鳃病曾也多次报道过,1975年Lightner等[13-14]报道了溶藻弧菌(Vibrioalginolyticus)与鳗弧菌(vibrioangullarium)、好气单胞菌(Aeromonassp.)的合并感染导致美国海岸养殖褐虾(Penaeusaztecus)、白虾(Penaeussetiferus)的败血症黑鳃、褐斑综合征。2008年陈德寿[15]研究凡纳滨对虾,发现其黑鳃病致病原是弧菌和丝状弧菌混合感染形成的。研究发现微小杆菌具有较高的β-葡萄糖苷酶和蛋白水解酶活性,可以降解几丁质、纤维素及酚类等[16-17]。所以我们推测凡纳滨对虾黄鳃病可能是由微小杆菌破坏了鳃组织形成病灶,然后罗尼氏弧菌侵袭虾血液在病灶处迅速增殖,聚集大量的血细胞形成黄色素,导致凡纳滨对虾表现出黄鳃病症状。
目前,有关对虾的组织病变资料较少,而凡纳滨对虾烂鳃类疾病的病理文献甚为罕见。日本沼虾鳃丝患黑鳃病早期时,鳃丝内充斥血淋巴,使得鳃肿胀加粗;而当鳃丝感染病原体时间较长时鳃丝出现溃烂、断裂,血淋巴流失,鳃丝变细,某些鳃丝会出现溃烂[12]。中国对虾患黑鳃病感染初期鳃丝组织充血,被多量血淋巴细胞浸润,组织表面开始出现凹陷及黑色素沉积,随着感染的加重,黑色素沉积区逐渐扩大,表面的凹陷也逐步加深, 最终坏死断裂[11]。对虾黄鳃病组织病理与黑鳃病组织病理基本相似。陈月忠等[6]研究对虾黄鳃病,发现在发病初期,对虾鳃呈淡黄色,随着病情的发展,鳃丝更加肿大,呈松散状, 并由黄色渐变为黄褐色,形成斑块;之后鳃组织变脆,甚至糜烂。我们对患黄鳃病的凡纳滨对虾组织病理研究发现,在发病初期,鳃组织结构基本完整,鳃局部组织会出现溃烂(图2-B),随着病情发展,鳃丝肿大,鳃上会形成组织块(图2-C)。进入后期,鳃结构松散,组织变脆,从尖端向基部溃烂(图2-D)。发病晚期,鳃结构出现糜烂,显微镜下几乎无法辨认出鳃结构(图2-E)。这一结果同吴惠仙等研究结果基本一致[6]。
根据抗生素敏感试验结果,罗尼氏弧菌对吡哌酸、氧氟沙星、氟甲喹和恶喹酸等最为敏感,对盐酸诺氟沙星和诺氟沙星中度敏感,对磺胺二甲嘧啶、氨苄青霉素等不敏感;微小杆菌对氨苄西林钠、氧氟沙星、多西环素和氟甲喹等具有很好的敏感性,对磺胺二甲嘧啶、氨苄青霉素、甲氧苄啶等不敏感。从筛选出对致病性菌高度敏感的药物来看,可考虑将氧氟沙星和氟甲喹作为治疗凡纳滨对虾黄鳃病备选药物,为今后进一步药物疗效和安全使用奠定基础,用于日后对虾养殖业的病害防控指导。
