高通量测序技术进行流产组织染色体拷贝数检测的结果分析
2018-10-15张钏郝胜菊张庆华冯暄林晓娟刘芙蓉周秉博闫有圣
张钏,郝胜菊*,张庆华,冯暄,林晓娟,刘芙蓉,周秉博,闫有圣
(1.甘肃省妇幼保健院,甘肃省出生缺陷防控研究重点实验室,兰州 730050;2.国家卫生计生委科学技术研究所,北京 100081)
自然流产是指妊娠不满28周、胎儿体重不足1 000 g,妊娠自行终止;妊娠12周之内终止称为早期流产。自然流产的发生率为15%~40%,而其中80%以上为发生在12周内的早期流产[1]。临床上,胚胎或胎儿已经死亡,却一直滞留于宫腔内不排出,称为稽留流产[2]。自然流产的病因十分复杂,孕早期的流产原因中,约有60%为胚胎染色体异常引起[2]。目前,对流产绒毛进行核型分析,是检测染色体异常的重要方法。但绒毛细胞采样及培养要求高,培养成功率低,分辨率也低,难以得到满意的结果[3-5]。本研究通过高通量测序进行染色体 DNA 拷贝数(Genomic copy number variations,CNVs)检测和常规染色体核型来进行流产原因分析,探讨高通量测序技术在流产染色体检测中的应用价值。
资料方法
一、资料来源
收集2015年11月至2017年11月在甘肃省妇幼保健院产科门诊确诊的自然流产、稽留流产组织以及绒毛组织,共计266例。患者年龄介于14~43岁,胚胎停育孕周介于孕4~26 周之间,自然流产患者样本190例、稽留流产组织40例、绒毛组织36例。流产(或引产)前B超检查均提示胚胎(胎儿)停止发育或有严重畸形,所有标本均在患者知情同意的原则下采集,然后进行绒毛细胞培养及染色体核型分析,同时将所有266例流产样本提取基因组DNA后进行高通量测序。检测均获患者及家属知情同意并签署知情同意书。
二、方法
1.绒毛细胞的培养及染色体核型分析:在严格无菌的条件下进行宫腔镜清宫术,采集胚胎绒毛标本,按照本中心建立的常规方法进行细胞培养、收获、制片、G显带,核型分析。
2.高通量测序:基因组DNA提取使用德国QIAGEN公司生产的基因组DNA提取试剂盒,按照试剂盒说明书进行。DNA浓度控制在 50~250 ng/μl,-20℃保存。采用高通量测序文库构建试剂盒(北京贝瑞和康)完成CNV文库构建,操作严格按照试剂操作说明书进行。主要步骤包括:DNA末端修复,通用测序引物及样本识别标签(Barcodes)连接,文库构建产物纯化。构建完成 的文库采用美国KAPA SYBR FAST qPCR试剂盒对文库进行准确定量。构建成功的文库根据每个样本文库的浓度进行混合(Pooling),将混合的文库在本实验室建立的NestSeq CN500高通量测序仪平台上进行大规模测序,最小精度在100 Kb,测序深度1 X。测序结果经信息分析,将每个测序 Reads匹配到其所在的染色体上。随后做相应标准化Z值分析,通过Z值进行染色体异常判定。通过检索 DECIPHER、OMIM、ClinVar、DGV等数据库进行CNV临床意义的确定。
结 果
一、染色体核型分析结果
200例绒毛细胞获得培养成功,66例由于是稽留流产或者孕周偏大培养失败。共检测出染色体核型异常79例,其中单体17例、三体61例、双重三体1例(表1)。
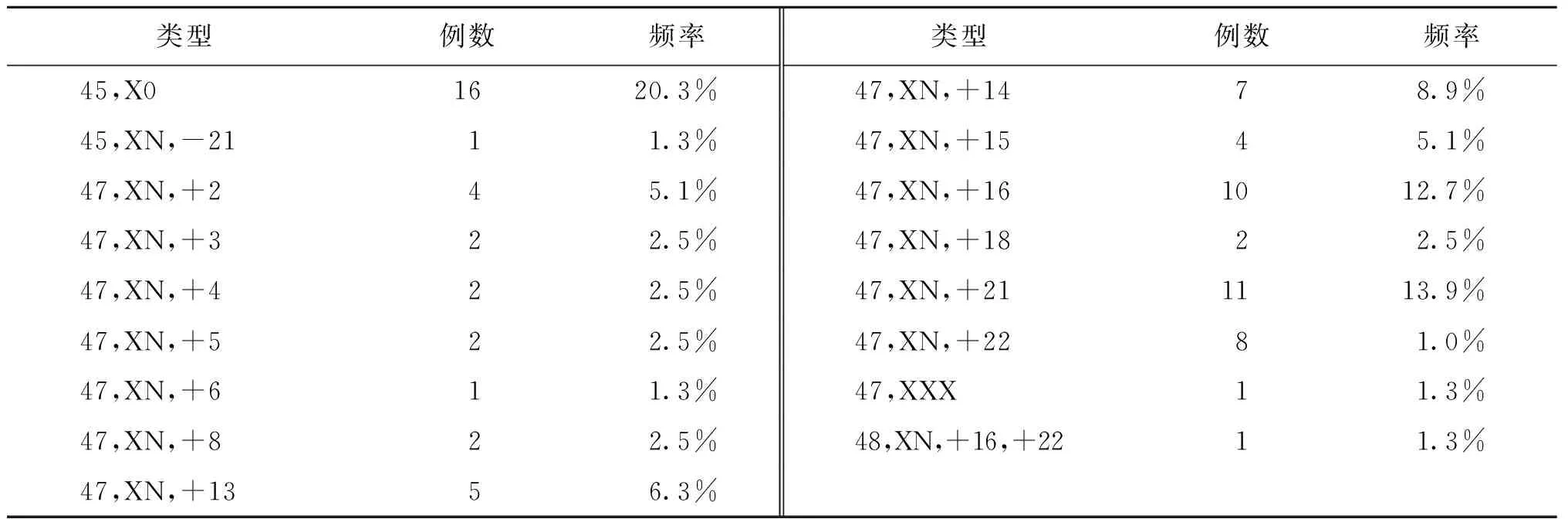
表1 染色体核型分析结果
二、CNVs分析结果
266例基因组DNA标本中,4例由于DNA降解而检测失败,其余标本均检测成功。共检测出CNVs改变155例,其中致病性CNVs改变119例,包括非整倍体112例,其中单体26例、三体83例、双重三体3例(表2);致病性缺失或者重复7例(表3)。此外检出致病性未知CNVs 2例(表3)、多态性改变CNVs 34例。
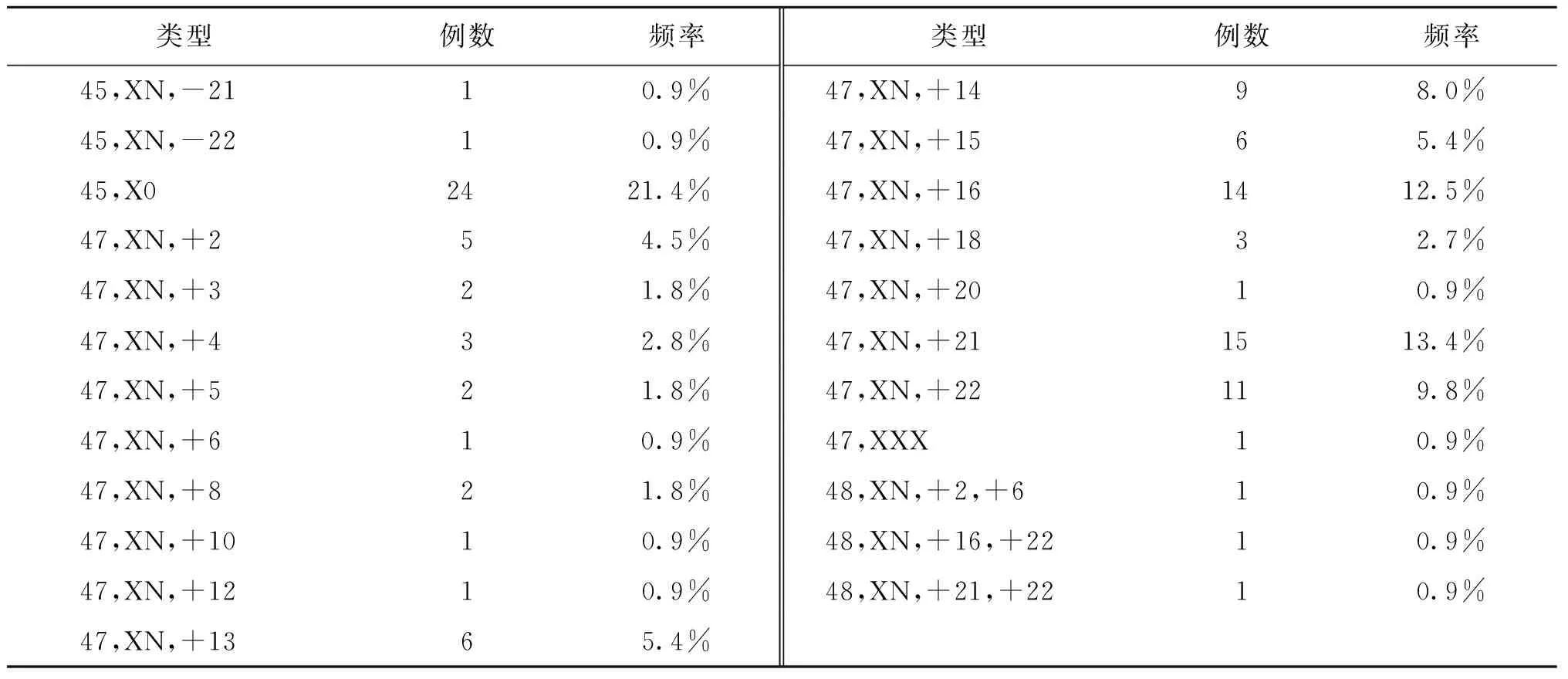
表2 CNVs分析非整倍体检测结果
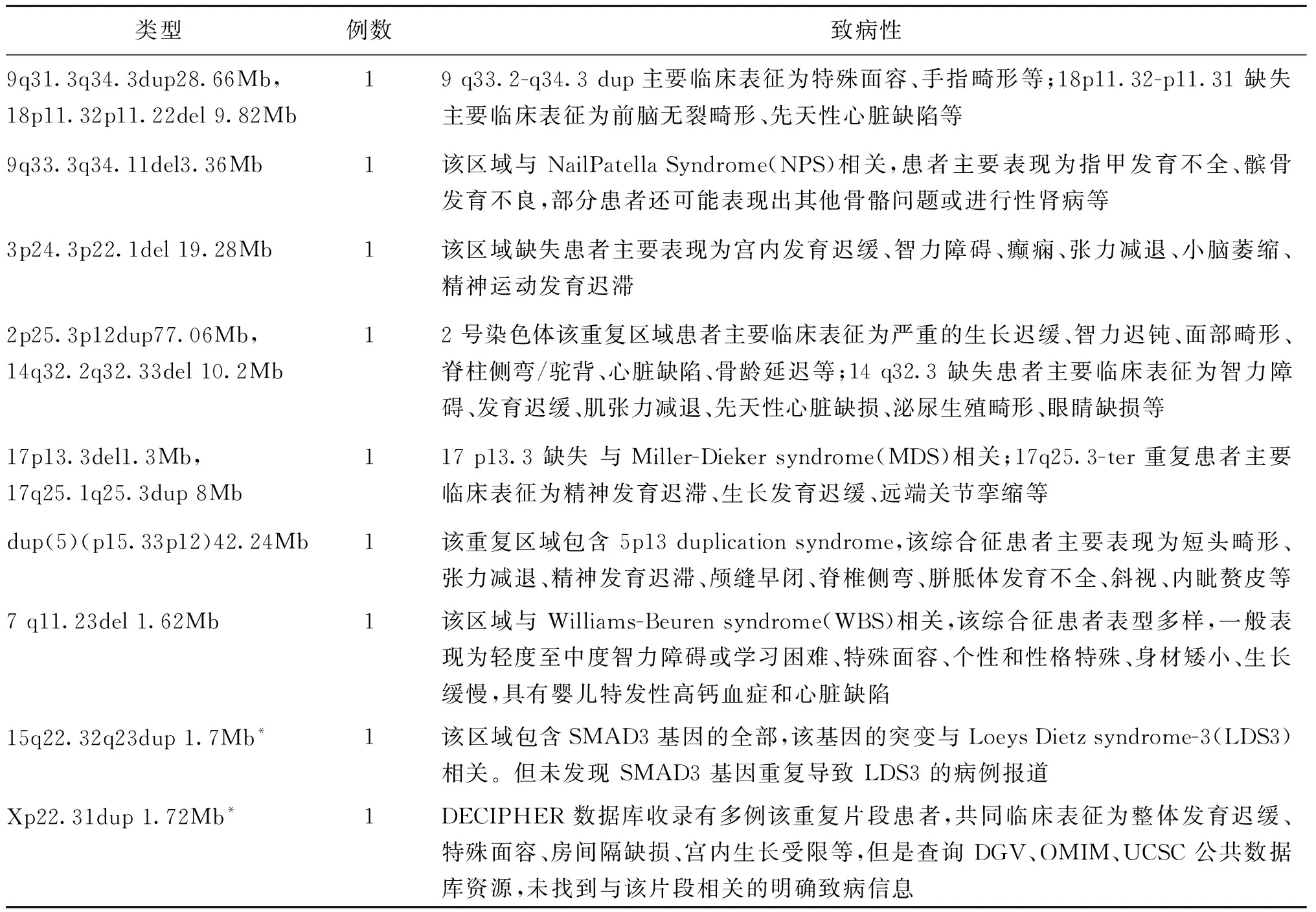
表3 致病性CNVs与致病性未知CNVs分析
注:*为致病性未知CNVs
讨 论
染色体异常包括数目和结构异常,其中数目异常包含整倍体改变和非整倍体改变,染色体非整倍体中三体较为常见;结构异常包括缺失、重复、倒位、易位、插入、环状染色体和等壁染色体等。这些变异均会产生相应的遗传学效应,可能会导致变异个体表型发生严重改变,甚至死亡[6]。
常规G显带核型正常的细胞中也存在亚显微结构变异,包括染色体的微缺失、微重复等各种类型的CNVs[7]。基因组中约有 4.8%~9.5%变异属于CNVs,其中99%以上的 CNVs 是良性的,但剩余的 1%常导致严重的染色体疾病[8]。CNVs可能通过干扰基因表达影响妊娠,最终导致胎儿死亡和流产。CNVs 的可能致病机制包括CNVs的剂量效应及位置效应[9-10]、造成某些隐性致病基因的暴露[11-12]、产生新的融合基因或者打断某个与疾病相关的基因[13]。
本文研究了266例流产样本的拷贝数变异,无论核型分析还是高通量测序分析结果,流产物的拷贝数变异均以非整倍体改变为主。核型分析异常检出率为39.5%,其中,21号染色单体1例、X染色体单体16例、三体61例、双重三体1例;三体中21-三体最常见,其次为16-三体、22-三体、14-三体、15-三体等。高通量测序分析异常检出率为45.4%,其中单体26例[21.8%;(45,XN,-21)和(45,XN,-22)各1例,(45,X0)24例];三体83例(69.7%),三体分布情况与核型分析一致;双重三体3例(2.5%);致病性缺失或者重复7例(5.9%)。
本文研究对象中,262例样本的拷贝数变异检测成功,除发现非整倍体改变112种外,发现CNVs 43种,检出率为16.4%。其中致病性CNVs 7例(16.3%)、致病性未知CNVs 2例(4.7%)、多态性改变CNVs 34例(79.1%)。可见,对流产物进行拷贝数变异分析可提高异常检出率,更好地发现流产的遗传学病因。
用原位荧光杂交技术进行流产物分析意义不大,检出率低[14],而细胞培养和核型分析,培养成功率较低[3-5]。虽然流产绒毛细胞培养和核型分析成功率较低,但目前染色体核型分析仍是临床最基本的遗传学检查。高通量测序技术可覆盖全基因组进行拷贝出变异分析,除了可以发现非整倍体改变外,还可发现致病性及可能致病性CNVs,可明显提高异常检出率。临床上,可采用染色体核型分析与高通量测序技术相结,以全面地发现染色体异常改变,从而查明流产的遗传学病因,减轻患者的心理负担,为再次妊娠提供临床建议和遗传咨询。
