FMR1基因CGG重复序列频度与反复生育失败或卵巢早衰妇女的相关性研究
2018-10-15陈蔚琳金力武淑英张军腊晓琳米鑫童英杨悦
陈蔚琳,金力*,武淑英,张军,腊晓琳,米鑫,童英,杨悦
(1.中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730;2.北京大学第三医院,北京 100191;3.首都医科大学附属北京安贞医院,北京 100029;4.新疆医科大学第一附属医院,乌鲁木齐 830054;5.北京儿童医院顺义妇儿医院,北京 101300;6.空军总医院,北京 100142;7.民航总医院,北京 100123)
脆性X智力低下1号基因(Fragile X Mental Retardation 1,FMR1)位于性染色体X的末端Xq23.7,其启动子区存在着以CGG为单位的动态三联重复。根据不同的扩增概率,美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics,ACMG)将CGG重复序列分为四大类[1]:CGG重复数在5~44之间定义为“正常型”;45~54之为“中间型”或者“灰区”;55~199之间为“前突变”(premutation,PM);200以上为“全突变”(full mutation,FM)。全突变的临床表型即为脆性X综合征(Fragile-X Syndrome,FXS),在临床上有典型的遗传性智力低下或自闭症等表现,常见于男性。女性因为有两条X染色体,所以常表现为一条X染色体的随机失活,故智力低下表型较少,但可遗传至子代。女性PM携带者也可以在遗传至子代时发生全突变,分娩FXS儿,而自身表型正常。此外由于CGG重复序列翻译所形成的物质可能以某种方式干扰了胎儿卵巢FMR1基因的转录,引起该突变基因的携带者在出生时即存在卵母细胞数量和质量的下降,其卵巢功能的临床表型具有高度的异质性[2],可发生脆性X相关的卵巢储备能力下降(Fragile X Associated Diminished ovarian reserve,FXDOR),表现为不明原因不孕症或生育力下降,如反复不明原因流产或IVF失败等。也可能表现为脆性X相关的原发性卵巢早衰(Fragile X Associated Premature Ovarian Insufficiency,FXPOI)[3],即出现小于40岁的闭经。所以目前认为FMR1是导致卵巢储备功能下降甚至卵巢早衰的重要突变基因之一。灰区主要指那些在遗传中基因表达的CGG重复缺乏稳定性的类型,而关于灰区的临床意义目前的数据缺乏统一性,有研究发现“灰区”与正常核型的患者比较,前者的预期绝经年龄早(约7年),不孕症及月经周期异常的发生率高,卵巢早衰发生率高,而且非整倍体妊娠流产的发生率高[4]。但也有研究认为它并不能用来预测卵巢储备功能[5-6]。
我国大陆关于FMR1基因的研究起于1986年的家系报道[7],之后由于筛查手段的限制一直没有开展大规模的筛查研究。2015年Huang等[8]报道了我国的第一个较大人群的FMR1基因筛查结果,1 113例汉族人群(534男性和579女性)中有1例女性PM携带者。2014年我国学者也针对卵巢功能低下女性进行了FMR1基因的分布研究,但因为样本量较小,仅在117名卵巢功能低下的女性中,发现了一名患有不孕症的FMR1基因PM携带者,未发现“灰区”[9]。以上为数不多的来自中国的报道提示,FMR1基因的中国人群的筛查资料目前仍是空白,而关于其在卵巢功能低下女性的分布更是贫乏。因此本次研究通过FMR1基因CGG重复序列的检测,对首次从基因水平探究中国大陆反复生育失败妇女和卵巢功能异常的原因具有非常重要意义,在此特殊人群中进行的一次较大样本量的筛查,为进一步获得FMR1基因在我国的正常人群的分布数据,提供先期研究数据和研究路径。
资料与材料
一、研究人群
2016年8月至2017年12月开展了全国多中心的横断面研究,入选人员为18~45岁的育龄妇女。
入选者根据异常生育史和卵巢功能分为3组,分别为:A.不明原因反复生育失败妇女,包括反复妊娠失败或IVF反复失败者(2次以上),不孕症;B.卵巢早衰患者(40岁之前绝经),除外手术或药物性原因;C.家族中有自闭症、不明原因智力低下儿出生史的妇女。
本研究通过北京协和医院医学伦理委员会同意(伦理证书编号HS-856);入选患者均签署知情同意书。
二、试验方法
DNA提取:每位受试者采取2 ml静脉全血,外地单位冻存统一快递,北京市单位当日快递送至北京大学第一医院检验科进行DNA提取,使用QIAamp全血DNA提取试剂盒(Qiagen,德国),实验步骤严格按照试剂盒说明书进行。
CGG重复数的测定:使用AmplideX试剂盒(Asuragen,美国),采用荧光PCR技术,并用毛细管电泳仪进行扩增产物的分析。PCR体系包含11.45 μl的高GC扩增缓冲液、1.5 μl的FAMM标记FMR1引物(包含F引物、R引物和CGG第三引物,其中R引物是唯一的荧光标记引物,引物序列见表1)、0.05 μl的高GC聚合酶溶液。PCR体系在分装进96孔PCR板之前进行混匀和离心。每个PCR孔加入20 ng/μl的DNA模板2 μl,用膜封装后混匀并离心。将PCR板放入ABI 7500扩增仪进行扩增。样本扩增条件:98℃热变性5 min;25个循环(97℃ 35 s,62℃ 35 s,72℃ 4 min);72℃最后延伸 10 min。PCR结束后,产物在进行琼脂糖凝胶电泳或毛细管电泳前避光保存于-15℃到-30℃之间。扩增产物分析采用ABI的3730XL毛细管电泳仪和Genemapper4.0分析软件(3730XL Genetic Analyzers,Life Technology,日本)。
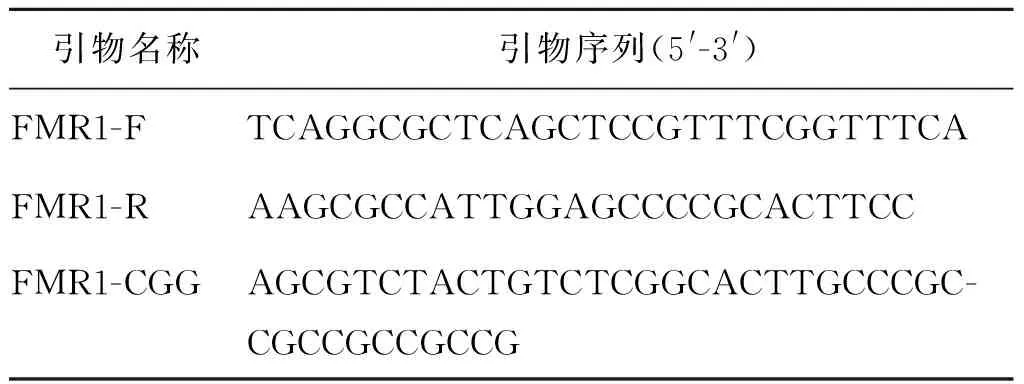
表1 FMR1引物序列
三、统计方法
所有统计数据均应用SPSS 17.0进行处理。在同一个体中FMR1的两个等位基因(CGG)重复次数相对少者定义为allele-1,相对多者定义为allele-2。按照国际惯例[5],本研究取allele-2的重复数进行统计分析。
结 果
一、CGG重复序列分布情况
本研究共入组2 334例反复生育失败及卵巢功能异常妇女。其中,A组2 216例,年龄(31.17±4.76)岁(18~47岁);B组70例,年龄(31.54±6.60)岁(18~46岁);C组48例,年龄(33.70±4.72)岁(25~45岁)。
共发现39种不同的CGG重复数,最小20,最大200。最常见的CGG重复次数是30(718例,占33.8%)和29(669例,占28.7%),占总的等位基因中62.5%;第三个常见的CGG重复次数是36(357例,占15.3%)。CGG重复次数<29者共88例(3.94%),而>36者共130例(5.82%)。具体CGG重复序列分布见图1。

图1 CGG重复序列分布情况
二、研究人群前突变(PM)及灰区分布情况
总受检人群中共发现16例PM和15例灰区,未发现全突变(FM)。PM在总人群的发生率为1∶146,其中A组6例(发生率1∶369)、B组2例(发生率1∶35)、C组8例(发生率1∶6);研究中灰区的患者均在A组,组内发生率为1∶148。本研究中不同组的PM及灰区分布见表2。各组PM患者的CGG重复数见表3,重复数>100的两例均分布在C组。

表2 研究人群的前突变及灰区分布情况[n(‰)]

表3 研究人群前突变核型的CGG重复数
三、FMR1基因型分析
根据两个等位基因(CGG)重复次数的不同,FMR1基因分为3种基因型:两个等位基因重复次数均在正常范围内称为“野生型”;其中一等位基因在正常范围内,而另一个等位基因重复次数超出正常范围的称为“突变杂合型”(简称杂合型);两个等位基因均超出正常者称为“突变纯合型”(简称纯合型)。本研究组的FMR1基因异常均为突变杂合型,无纯合型。
讨 论
一、FMR1基因在卵巢储备功能中的分子学机制
卵巢储备功能直接关系到妇女生育能力和妊娠结局,它是卵巢皮质内原始卵泡发育成可受精卵母细胞的能力。卵巢储备能力下降是指卵巢内存留的卵泡的质量和数量下降。FMR1基因是导致卵巢储备能力下降的重要基因,而目前关于CGG重复序列扩增对于FMR1基因表达的调控机制,以及如何影响到卵巢功能的分子机制目前尚不清楚。当CGG重复序列小于45时,FMR相关蛋白和FMR mRNA的功能稳定。而在PM和“灰区”携带者中,由于翻译的错误而导致两者的不匹配,FMR1相关蛋白水平下降而FMR1mRNA水平上升,从而发生细胞毒性作用,致使出生前卵泡池的卵泡数量下降。而出生后mRNA诱导的卵巢的颗粒细胞毒性及间质细胞中FMR多糖甘氨酸[10]的作用,使得卵泡的成熟障碍,凋亡加速,推测可能是女性胚胎期和生后两个时期的叠加作用,而导致FXDOR和FXPOI的发生[11]。不过在卵巢早衰的动物模型中发现PM对始基卵泡没有作用,而是作用于后期卵泡的成熟和凋亡[12]。所以FMR1基因可能继FSH、抑制素B及抗苗勒管激素之后,成为预测卵巢储备功能的指标。
二、FMR1基因CGG重复数在不明原因反复生育失败或卵巢早衰人群分布
不明原因反复生育失败是卵巢储备功能低下的一种表型,故本研究A组和B组涉及的人群均为卵巢功能异常人群。在该人群中最常见的CGG重复次数是30(33.8%)和29(28.7%),占总的等位基因的62.5%;第三个常见的CGG重复次数是36(15.3%)。所以最终表现为CGG重复数的“双峰现象”。我们的结果与亚洲人种的CGG分布状况基本相似[13-14]。环比大多数针对西方人群的研究均显示“单峰”聚集,30和29是最常见的CGG重复数[15-16]。而亚洲人种还有34-36的集中趋势亚峰,而非29-30次单峰。此外CGG重复数<29和≥36的比例在亚洲人种中也显著偏低[17]。
三、FMR1前突变和灰区在不明原因反复生育失败或卵巢早衰人群分布情况
本研究在总受检人群中共发现16例PM和15例灰区,未发现FM,因此,在该人群中PM的发生率为1∶146。2014年的系统回顾[18]中PM在女性的发生率为1∶150~300,男性发生率为1∶400~850。FMR1基因PM发生率在不同种族和地域差异较大。但是如果按照人种区分,高加索人群中表现了较高的PM发生率,比如西班牙1∶251[19]、法国1∶246[20]、美国1∶382[21]、伊朗1∶113[22];而目前发现东亚人种的PM发生率明显低于以上数据,如中国台湾15年3 911例低危人群的PM发生率为1∶1 955[23],韩国5 800例女性筛查结果为1∶781[24],而在日本的946例筛查中竟没有发现一例PM携带者[25];而在中国大陆汉族人群(2 000例)的筛查中PM的发生率也与其他东亚人群类似,仅为1∶1 113[8]~1∶1 325[26]。相比之下,本研究在不明原因反复生育失败或卵巢早衰的人群中筛查,发生率明显高于正常人群的筛查,凸显FMR1基因在该组人群中筛查意义的深远。
本研究PM发生率最高的是家族中有自闭症、不明原因智力低下儿出生史的妇女组,高达1∶6(8/48),提示对这样的人群进行FMR1基因的筛查是非常有必要的,对有FXS儿出生史的妇女再次妊娠时需进行FMR1基因的产前诊断,避免再次FXS儿的出生。截至到目前,本研究已经成功帮助2名曾分娩FXS患儿的孕妇进行了产前诊断,成功地阻断第二胎FXS患儿的出生,并发表了相关报道[27]。来自于韩国的15年的数据[24]也显示高危妇女组PM的发生率高达1∶7.25,而对比低危妇女发生率仅为1∶1 955,与我们的数据非常相似。本研究中卵巢早衰组的PM发生率也较高,达1∶35,而反复生育失败组的PM发生率仅为1∶369,但后者的发生率仍高于上述文献报道的中国妇女一般人群的PM发生率[8,26]。通过这两组与卵巢功能下降相关的病例数据,进一步证明了FMR1基因对于卵巢功能及人类的生育能力所具有的影响。而针对这一组存在卵巢功能异常的PM患者来说,生育计划咨询就显得尤为重要,这部分患者不但存在着生育的异常,表现为不孕症、反复生育失败、IVF促排卵低反应及较低的妊娠率,而且即便是成功妊娠后也要积极支持妊娠同时建议进行产前诊断,如绒毛穿刺或是羊水穿刺,以了解胎儿的FMR1基因情况,及时阻断FXS患儿的出生。所以对于表现为低生育力的育龄妇女来说,FMR1基因的测定不仅能从基因层面解释可能的原因,同时在基因水平做到的优生优育及计划生育,优化我国人口素质,应该推荐将其列入FMR1基因筛查人群。
本研究PM携带者CGG重复数>100者均出现在C组,即家族中可疑FXS患儿组,而卵巢早衰组和反复生育失败组的CGG重复数均在55~100之间,这个也符合很多文献发现的FXPOI的CGG重复数规律,即CGG重复次数与绝经年龄不存在线形或曲线关系,处于中等度重复数的PM携带者(80~100)发生FXPOI的风险更高,在CGG处于59~99范围内时FXPOI的风险呈上升趋势,而在CGG重复数>100后,发生风险反而下降。同样进行促排卵时,CGG重复数>100者的卵巢反应率及妊娠率反而更高[28]。研究发现除了CGG重复数外,AGG的插入的减少也参与了卵巢功能的下降[29]。
本研究中共发现“灰区”患者15例,发生率为1∶148,且均出现在反复生育失败的A组。但与东亚地区的正常人群“灰区”发生率相比并没有明显增高的趋势,如韩国1∶143[24]、中国香港1∶88[26],所以说“灰区”对于生育力的评估作用是值得商榷的。针对“灰区”妇女来说,不推荐进行产前诊断。而基于其在扩增时的不确定性,仍应建议她们在生育年龄时尽早完成生育计划。
综上所述,本研究通过测定中国反复妊娠失败和卵巢早衰妇女FMR1基因的分布情况,获得了我国特殊人群的流行病学数据,为临床从基因水平诊治卵巢储备功能下降及卵巢早衰患者打开了新的视窗,FMR1基因无论是作为评估卵巢储备功能的生物学指标,抑或是帮助医生指导PM携带者的生育计划及产前诊断方面都具有非常深远的意义,为提高人口素质、降低出生缺陷提供切实的方法;同时也为进一步在我国多地展开更大样本的正常人群的筛查提供了先期的经验。
