弥漫性大B细胞淋巴瘤中MYD88基因突变及其临床病理相关性分析
2018-10-15于宝华蒋翔男朱晓丽李小秋
于宝华,薛 田,张 岩,蒋翔男,朱晓丽,李小秋
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymohoma,DLBCL)是非霍奇金淋巴瘤中最常见、高度恶性的一种类型。近年来虽然DLBCL的治疗取得了明显改善,但部分患者仍有较高的复发和死亡风险。因此,深入探讨其发生机制、寻找新的分子靶点成为亟待解决的问题。近年来研究发现,MYD88基因在DLBCL中有一定的突变率。MYD88基因编码蛋白为衔接蛋白,可通过Toll-like受体活化核转录因子κB(nuclear transcription factor κB,NF-κB)通路从而促进肿瘤细胞生存[1]。MYD88最常见的突变形式是位于Toll-like受体结构域L265P位点的体细胞突变。该基因在免疫隔离部位DLBCL中的突变率较高,如中枢神经系统(central nervous system,CNS)、睾丸等[2],但不同文献报道的突变率从0%~94%不等;该突变与DLBCL临床病理特征相关性的报道也较少[3],且在中文文献中罕见相关报道。本研究拟通过对121例发生在不同部位DLBCL中的MYD88基因突变进行探讨,并分析其临床病理相关性,旨在更好地了解MYD88 L265P突变在DLBCL中的意义。
1 资料和方法
1.1 临床资料
收集复旦大学附属肿瘤医院病理科2017年9月—2018年6月诊断的DLBCL患者121例,所有病例均有足够量的高质量组织标本可供进一步检测。所有患者均由2名经验丰富的淋巴造血组织专科病理医师复核、确诊。通过查阅电子病例档案及电话随访获得临床资料。
1.2 免疫组织化学检测
所有标本均经3.7%中性甲醛溶液固定,常规脱水,石蜡包埋,3~4 μm连续切片,H-E染色。采用全自动免疫组织化学仪BenchMark XT(美国Roche公司)染色。所用一抗包括CD20、CD3、CD5、Bcl-2及Ki-67(美国Roche Ventana公司),CD10、Bcl-6及MUM1抗体(丹麦Dako公司),以及MYC抗体(英国Abcam公司)。参考试剂盒说明书和全自动免疫组织化学仪标准流程操作。根据Hans分型法将DLBCL分为生发中心样(germinal center B-cell-like,GCB)型和non-GCB型两组[4]。同时满足≥40%肿瘤细胞表达MYC蛋白及≥50%肿瘤细胞表达Bcl-2蛋白者视作双表达[5]。
1.3 MYD88基因突变检测
经常规固定、脱水、石蜡包埋的肿瘤组织样本制备成4~6 μm厚的切片,经二甲苯脱蜡、梯度浓度乙醇去除二甲苯和流水水化。核酸提取按照DNA提取试剂盒(德国Qiagen公司)说明书进行。提纯后的核酸模板加入PCR混合液,采用PCR扩增MYD88基因。针对L265P位点突变的PCR引物序列为:上游引物5’-GGGG-ATGGCTGTTGTTAA-3’,下游引物5’-GCAGGGGTTGGT-GTAGTC-3’。PCR扩增产物经琼脂糖凝胶电泳鉴定和PCR纯化试剂盒(QIA quick PCR purification kit,德国Qiagen公司)纯化后,在ABI3730XL测序仪(美国ABI公司)上进行测序验证。具体操作参考仪器及配套试剂盒说明书。
1.4 统计学处理
采用SPSS 20.0统计学软件进行数据分析。相应的相关性分析采用χ2检验、Pearson检验及Spearman检验。P<0.05为差异有统计学意义。
2 结果
2.1 MYD88突变及其与临床参数的相关性
121例DLBCL患者中,38例检测到MYD88 L265P位点突变,突变率为31.4%(图1)。MYD88突变患者中,男性50例,女性71例,男女比例为1.0∶1.4。年龄17~85岁,平均58.1岁(中位年龄60岁)。年龄≥60岁组MYD88突变率为40.3%(25/62),显著高于<60岁患者组(13/59,22.0%)(P=0.030)。男性患者中该基因突变率(17/50,34.0%)与女性患者中的突变率(21/71,29.6%)差异无统计学意义(P=0.609,表1)。
本组患者中20例发生在结内,98例发生在结外,其余3例原发灶不明。MYD88突变主要发生在结外部位,包括乳腺12例(12/13,92.3%)、男性生殖系统10例(10/11,90.9%;其中睾丸9/10,前列腺1/1)、女性生殖系统5例(5/6,83.3%;其中卵巢2/2、宫颈3/3、子宫体0/1)、CNS 4例(4/6,66.7%)、淋巴结2例(2/20,10%)、皮肤1例(1/2,50%)、口咽环1例(8.3%,其中口咽部1/3、扁桃体0/9)、腹膜后1例(1/1,100%)、鼻腔1例(1/2,50%)和原发不明1例(1/3,33.3%)。其余部位未检测到MYD88突变,包括胃肠道(0/25)、脾(0/3)、纵隔及肺(0/6)、鼻咽(0/2)、肾上腺(0/1)、外阴及阴道(0/2)、眼眶(0/2)和骨及软组织(0/4)。统计分析结果显示,MYD88基因突变与患者的发病部位显著相关,结外者(35/98,35.7%)显著高于结内者(2/20,10%)(P=0.024,表1)。
2.2 MYD88突变与病理参数的相关性
本组患者形态均为DLBCL,非特指性(图2)。118例有分型信息的患者中,55例为GCB型,63例为non-GCB型。Non-GCB型DLBCL患者中,MYD88突变率为39.7%(25/63),显著高于GCB型(10/55,18.2%)(P=0.010)。发生于结外的DLBCL患者中,MYD88基因在non-GCB型中的突变率为47.1%(24/51),显著高于GCB型(8/44,18.2%)(P=0.003);而结内DLBCL患者中,MYD88基因突变与免疫分型没有显著相关性(P=0.776,表1)。
Bcl-2蛋白表达阳性组中MYD88突变率为39.0%(30/77),Bcl-2阴性组中为12.5%(5/40),差异有统计学意义(P=0.003)。Bcl-2/MYC蛋白双表达组中MYD88突变率(19/46,41.3%)显著高于非双表达组(16/70,22.9%)(P=0.034,表1)。Ki-67增殖活性与MYD88基因突变显著相关,高增殖活性组(Ki-67指数≥80%)中MYD88突变率高达38.8%(33/85),而低增殖活性组中仅为6.3%(2/32)(P<0.001)。但该基因突变与MYC蛋白及CD5表达均无相关性(P=0.581,P=0.759,表1)。

图 1 MYD88 L265P位点突变Fig.1 MYD88 L265P mutation in DLBCLA CTG (leucine) codon was changed to a CCG (proline) codon (arrow)
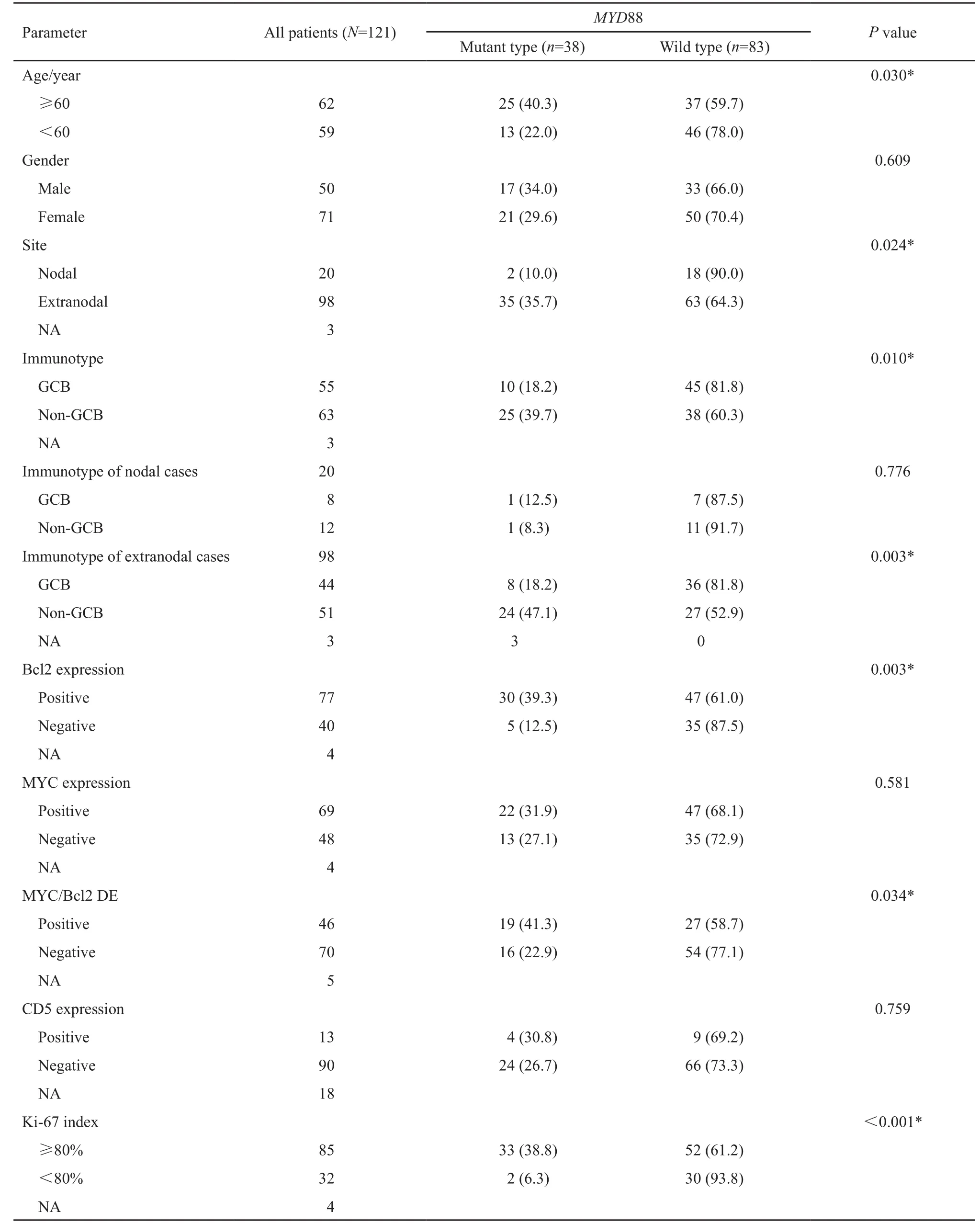
表 1 121例DLBCL患者中MYD88 L265P突变与临床病理参数的相关性Tab. 1 The correlation between MYD88 L265P mutation and clinicopathological parameters in 121 cases of DLBCL[n (%)]
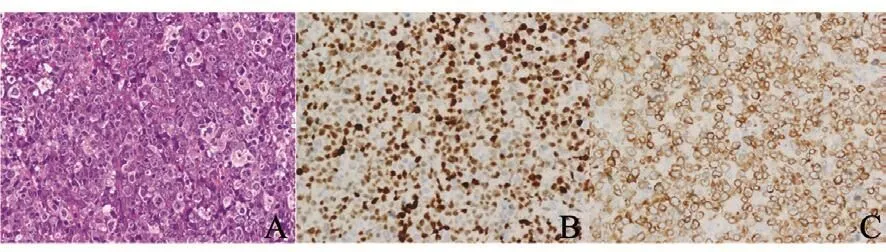
图 2 1例有MYD88 L265P突变的宫颈原发DLBCL,同时伴有MYC/Bcl2双表达Fig. 2 A representative case of primary cervical DLBCL harboring MYD88 L265P mutation and MYC/Bcl2 doubleexpressionA: Large atypical lymphoid cells were diusely infiltrated (H-E, ×400).B and C: Immunohistochemical stainings for both MYC (B) and Bcl2 protein (C) were positive (EnVision, ×400)
3 讨论
DLBCL是一组临床和生物学上均具有异质性的肿瘤。虽然相当一部分患者可获得较好的疗效,但仍有部分患者发生耐药或复发。对于预后较差的患者,深入探讨其分子生物学机制具有重要的临床意义。近来有学者根据DLBCL基因型、表观遗传学及临床特征的不同将其分为4型,其中一型(MCD型)以MYD88和CD79B基因突变为主要特征,提示MYD88基因突变在DLBCL发生、发展、治疗及预后评估中可能具有重要作用[6]。既往文献报道,MYD88基因在DLBCL中的突变率有较大差异(0%~90%),该差异可能与患者选择、所用检测技术不同以及是否仅检测L265P突变还是检测外显子3~5所有突变有关[7-8]。Lee等[3]通过Meta分析表明,2 736例DLBCL患者中,该基因突变率约29.0%。
DLBCL中MYD88基因突变与发病部位显著相关,尤其好发于免疫隔离部位如CNS及睾丸等,另外乳腺、女性生殖系统及原发皮肤者也有较高的突变率[3,9-10]。本研究结果与既往文献报道大致相似,女性生殖系统、睾丸、乳腺及CNS均显示较高的突变率(66.7%~92.3%)。Zheng等[8]认为,CNS中高突变率可能与肿瘤细胞的微环境相关。具有MYD88突变的DLBCL患者可能在其外周血单核细胞中也有低频的相同突变,提示MYD88突变阳性的癌前细胞可能起源于CNS之外,并且在经过适应CNS环境的额外基因异常打击之后发展成CNS淋巴瘤[8]。原发淋巴结内DLBCL中该基因突变率非常低,文献报道为0%~38%(中位值为10%),本研究结果(10%)在该范围内[3,11]。大部分文献报道胃肠道DLBCL中MYD88基因罕见或无突变[7,12],但个别文献也曾报道有较高的突变率(11%)[2];本组数据中,25例胃肠道DLBCL中均未检测到突变,与大部分文献报道相似。另外,纵隔、脾脏等部位突变情况均未见文献报道,本组患者中均未检出突变;但由于病例数较少,有待扩大样本量进一步验证。MYD88基因突变在不同部位DLBCL中的差异提示这些部位的DLBCL可能具有不同的发病机制,至少一定程度上与组织微环境相关[13]。
早在2011年,Ngo等[1]首次报道MYD88 L265P突变在活化B细胞样(activated B-cell -like,ABC)型DLBCL中高达29%,而在其他亚型DLBCL中非常罕见。该突变可导致IRAK4激酶活化、IRAK1磷酸化、NF-κB通路及JAK/STAT3通路活化,从而促进肿瘤细胞生存,提示MYD88信号通路可能是ABC型DLBCL发生、发展过程中不可或缺的重要因素[1]。随后多数研究证实,MYD88突变与DLBCL分子分型呈显著相关,但阳性率报道不一,在ABC型DLBCL中突变率为21.6%~31.2%,而在GCB型中突变率主要集中在6.0%~9.7%范围内[2]。本研究结果显示,non-GCB型DLBCL中MYD88突变高于GCB亚型,与大部分文献报道相似,尤其是在结外DLBCL中;GCB型DLBCL中MYD88突变率为18.2%,高于既往多数文献报道,但与Rovira等[7]的结果(18%)相似。
MYD88与DLBCL中MYC、Bcl-2蛋白表达关系的相关文献报道极少。Rovira等[7]报道MYD88突变型DLBCL中MYC/Bcl-2双表达率显著低于野生型,而Dubois等[14]认为ABC型DLBCL中MYC/Bcl-2蛋白双表达及MYC单一基因表达与MYD88突变均不相关。本研究结果显示,MYD88突变型中MYC/Bcl-2双表达率(54.3%)显著高于野生型(33.3%)。该结果虽然与上述文献报道结果不符,但与MYC/Bcl-2双表达者常见于ABC亚型且预后较差等相一致[15-16]。另外,本研究结果显示,单一Bcl-2蛋白表达也与MYD88基因突变显著相关,而单一MYC蛋白表达与该基因突变并无相关性。Dubois等[14]曾报道ABC型DLBCL中Bcl-2过表达更多见于MYD88突变者中,具有MYD88突变的GCB型DLBCL也倾向于Bcl-2过表达,与本研究结果大致相符。MYD88突变与MYC、Bcl-2表达的相关性及其内在机制值得进一步深入研究探讨。
约10%的DLBCL中有CD5蛋白表达,CD5+DLBCL具有较高的临床侵袭性和较高的CNS复发频率[17]。Takeuchi等[17]报道40例CD5+DLBCL中MYD88突变率为33%。本组CD5+患者中该突变率为30.8%,但CD5表达并未显示出与MYD88突变的相关性。由于本组患者中CD5+者较少,有待积累更多病例进一步研究证实。
关于MYD88基因突变在DLBCL中预后价值的研究报道较少且存在争议。部分研究认为该基因突变与DLBCL患者预后无相关性,包括原发乳腺及CNS的DLBCL[8,10,17-19]。但也有研究认为MYD88基因突变者预后较差,并且可以作为原发皮肤DLBCL(腿型)的独立预后因子[7,9,19]。2017版造血与淋巴组织肿瘤世界卫生组织(World Health Organization,WHO)分类中也指出原发皮肤DLBCL(腿型)中MYD88突变与预后差相关[5]。本组患者随访时间较短,需要积累更多病例并延长随访时间进一步分析MYD88突变与DLBCL患者预后的相关性。
MYD88突变型DLBCL可能对抑制NF-κB或JAK/STAT通路的靶向药物具有较高的敏感性,目前正在研究中的药物包括布鲁顿酪氨酸激酶(Bruton’s tyrosine kinase,BTK)和PI3K抑制剂,具有MYD88突变的ABC型DLBCL患者对BTK选择性抑制剂依鲁替尼反应较好[20]。因此,MYD88突变状态可能是一项较好的DLBCL患者治疗反应的预测因素[3,7]。
综上所述,MYD88 L265P突变好发于年龄≥60岁、ABC(non-GCB)起源及特殊结外部位(包括乳腺、中枢神经系统及生殖系统等)的DLBCL,并且具有较高的增殖指数及MYC/Bcl-2蛋白双阳性率;其预后价值有待积累更多病例进一步分析。MYD88基因突变有望为揭示DLBCL发病机制、靶向治疗提供理论依据,并且可能成为靶向治疗反应的有效预测因子。
