小干扰RNA下调PLK1表达对食管腺癌细胞肿瘤生物学行为的影响
2018-10-15杜媛鲲赵永波米源陈阁廖海江王雷
杜媛鲲,赵永波,米源,陈阁,廖海江,王雷
(河北医科大学 1. 期刊社,石家庄 050017; 2. 第四医院胸心外科,石家庄 050011)
食管癌在全球所有恶性肿瘤的发病率占第8位,死亡率占第6位,其中我国是食管癌高发区,每年新发病率和死亡率均居世界第1位。食管癌的病理类型主要包括食管鳞癌和食管腺癌,虽然近年来食管鳞癌的死亡率有所下降,但食管腺癌的发病率上升了3~4倍,且患者就诊时多数为进展期,即使采取手术联合放化疗等综合治疗,仍然容易复发转移,5年生存率低于20%[1-2]。polo样激酶1 (polo-like kinase 1,PLK1) 属于广泛存在于真核生物细胞内的丝氨酸-苏氨酸激酶家族之一,作为细胞有丝分裂关键的调控因子,在启动、维持和完成有丝分裂的过程中起着重要的作用,尤其是在细胞周期的G2/M阶段发挥重要调控作用。近年来多项研究证实PLK1在前列腺癌[3]、胰腺癌[4]、胃癌[5]和肺癌[6]等多种恶性肿瘤中高表达,抑制其表达可以通过减少细胞增殖、促进凋亡等机制起到显著抗肿瘤作用。目前国内外关于PLK1的表达调控与食管腺癌发生发展关系的研究较少,所以本研究通过小干扰RNA (small interfering RNA,siRNA)调控PLK1在食管腺癌OE33细胞中的表达,探讨了PLK1与食管腺癌细胞生长和侵袭的影响及可能的分子机制,旨在为以PLK1为靶点的食管腺癌的基因治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂及细胞株:人食管腺癌细胞株OE33购自英国Sigma-Aldrich公司,胎牛血清购自美国Gemini公司,RPMI 1640 培养液购自美国Corning公司,Silencer® Select PLK1 siRNA、control siRNA、TaqMan®PLK1引物和探针 (Hs00983227_m1) 以及TaqMan®GAPDH (Hs02758991_g1) 购自美国Life Technologies公司,Transwell膜嵌套、Matrigel胶购自美国BD公司,Opti-MEM培养基、Lipofectamine® RNAiMAX转染试剂盒购自美国Invitrogen公司,TaqMan®基因表达预混液购自美国Applied Biosystems公司,iScript® cDNA合成试剂盒、Tris/甘氨酸缓冲液、Tris/甘氨酸/蛋白电泳缓冲液、Mini-PROTEAN TGX预制胶购自美国Bio-Rad公司,总RNA提取试剂盒购自德国Qiagen公司,E-cadherin、N-cadherin、PLK1、GAPDH、C-myc一抗均购自美国Abcam公司,ECL化学发光试剂盒、Pierce-BCA蛋白分析试剂盒购自美国Thermo Scientific公司,PVDF膜购自美国Millipore公司。
1.1.2 主要仪器设备:Synergy-HT多功能酶标仪购自美国Bio-Tek公司,ABI Prism 7900HT型荧光定量PCR仪购自美国Applied Biosystems公司,小型Trans-Blot®转印槽购自美国Bio-Rad公司,NanoDrop 8000全光谱紫外-可见光分光光度计购自美国Thermo Scientific公司。
1.2 实验方法
1.2.1 细胞培养和转染:OE33细胞采用含10%胎牛血清的RPMI 1640培养基在37 ℃、CO2维持在5%左右的恒温恒湿培养箱中培养,显微镜观察细胞生长情况,待细胞融合达80%左右进行传代培养。将呈对数生长期且生长状态良好的OE33细胞按3×105/孔接种于6孔板上,待细胞融合生长达到50%~60%时更换无血清培养基,设立空白对照组 (Control组) ,并按照Lipofectamine® RNAiMAX转染试剂说明书进行PLK1 siRNA干扰引物的转染,每组各设3个副孔,转染时每孔PLK1 siRNA及空白对照Control siRNA的终浓度均为100 nmol/L,于转染6 h后更换新的培养基并置于培养箱中继续培养至48 h。
1.2.2 实时荧光定量PCR法检测转染前后PLK1基因的表达:
1.2.2.1 总RNA的提取 PBS洗涤转染48 h后的OE33细胞,参照总RNA提取试剂盒说明书提取每组样本总RNA,将纯化的RNA放在NanoDrop 8000全光谱紫外可见光分光光度计仪器中检测RNA浓度。
1.2.2.2 逆转录合成cDNA 参照iScript® cDNA合成试剂盒的说明书进行每组样本cDNA的反转录。总反应体系40 μL:iScript 逆转录酶2 μL,iScript反应混合液8 μL,总RNA 500 ng,其余加RNase水配齐至40 μL,置于Veriti® 96-Well Thermal Cycler仪器中,在25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min的条件下进行cDNA合成,所得cDNA在-20 ℃保存备用。
1.2.2.3 实时荧光PCR扩增 用无RNase水将合成的每组cDNA稀释10倍作为模板。按照10 μL/孔的反应体系:Taqman 基因表达预混液5 μL,TaqMan®PLK1物和探针0.5 μL或TaqMan® GAPDH引物和探针0.5 μL、样本cDNA 4.5 μL,加入到美国ABI 荧光定量PCR仪专用384孔板上 (冰上) ,瞬时离心后于ABI 7900HT PCR仪中在95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s的条件下进行PCR扩增,40个循环。将ABI7900仪器输出数据按照2-ΔΔCt法进行数据分析。
1.2.3 蛋白印迹法检测沉默PLK1基因后相关蛋白的表达:PBS洗涤转染48 h后OE33细胞,将6孔板置于冰上,每孔分别加入含有蛋白酶抑制剂的M-PER细胞总蛋白提取试剂100 μL,收集样本的总蛋白提取液并离心取上清,此上清即为样本的细胞总蛋白。BCA法测定样本的总蛋白浓度。于小型 Trans-Blot®转印槽中加上Tris/甘氨酸/蛋白电泳液,在Mini-PROTEAN TGX预制胶中行每组样本蛋白上样,电泳工作条件200 V 50 min。用双蒸水短暂冲洗凝胶,用水和转膜缓冲液冲洗凝胶15 min后于Tris/甘氨酸缓冲液中转至PVDF膜 (冰浴) ,工作条件100 V 1 h。室温含5%脱脂奶粉的TBST液封膜1 h,根据目的蛋白不同分子量剪膜,分别加入一抗PLK1 (1∶1 000) ,一抗C-myc (工作浓度为1∶1 000) ,一抗N-cadherin(1∶500) ,一抗 GAPDH (1∶20 000) ,一抗E-cadherin(工作浓度为1∶10 000) ,置于4 ℃环境下摇床孵育过夜。第2天收集一抗后用TBST洗膜3次,每次10 min,加入二抗室温孵育1 h,TBST洗膜3次,每次10 min,ECL试剂均匀滴于PVDF膜上5 min,用X线感光片在暗室曝光显影、定影,使用Image软件测量目的蛋白相对表达量 (显影条带) 。
1.2.4 流式细胞术检测转染PLK1基因后细胞周期的变化:将转染48 h的OE33细胞PBS洗涤,胰酶消化贴壁细胞,收集细胞制备成单细胞悬液,冷PBS漂洗,加1 mL PBS吹打均匀重悬细胞,缓慢加入4 ℃70%冰乙醇5 mL (置振荡器上旋转搅拌) ,固定30 min以上。冷PBS漂洗3次去除乙醇,重悬细胞后加含40 μg碘化丙啶和100 μg RNaseA的PBS,避光4 ℃染色30 min。400目尼龙网过滤,采用Muticycle AV分析软件对DNA细胞周期进行拟合分析,检测每组样品的DNA含量,碘化丙啶激发波长为488 nm。
1.2.5 Transwell侵袭实验:将Matrigel胶放到4 ℃冰箱过夜,待其变为液态。把Matrigel基质胶的聚碳酸酯膜平铺于Transwell小室的下室上面。收集转染后的OE33细胞用无血清培养基悬浮细胞,调整细胞计数,加入到Transwell小室的上室。下室加含10%血清的培养液,然后继续放到37 ℃ 5% CO2恒湿温箱内孵育,24 h后用棉棒擦去上层基质胶和未迁移的细胞,甲醇固定聚碳酸酯膜30 min,结晶紫染色10 min,流水漂洗,晾干膜,倒置显微镜高倍视野下观察穿膜细胞数,随机取4个视野并计算平均值。
1.3 统计学分析
2 结果
2.1 实时荧光定量PCR方法检测PLK1基因沉默后PLK1基因表达量的变化
PLK1 siRNA组PLK1 mRNA表达水平为 (0.26±0.02) ,较Control组 (1.00±0.02) 显著降低,差异有统计学意义 (t = 51.16,P < 0.001) 。
2.2 Western blotting检测蛋白表达
应用Image软件测量OE33细胞PLK1、E-cadherin、N-cadherin和C-myc蛋白表达。PLK1 siRNA组PLK1、N-cadherin、C-myc蛋白表达较Control组均显著减少(PLK1:0.26±0.02和1.00±0.02,P < 0.001;N-cadherin:0.51±0.02和1.00±0.02,P < 0.001;C-myc:0.24±0.03和1.00±0.04,P < 0.001) ,差异均有统计学意义;PLK1 siRNA组E-cadherin (1.78±0.02) 蛋白表达较Control组(1.00±0.03) 显著增加 (t = -40.30,P < 0.001) ,差异有统计学意义。见图1。
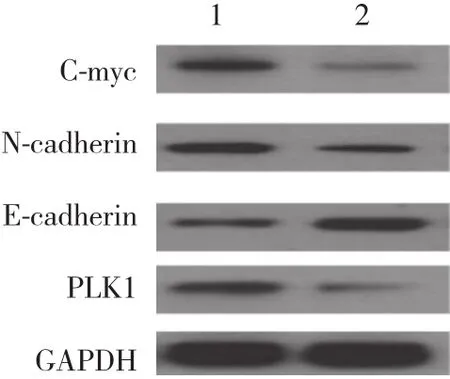
图1 Western blotting检测OE33细胞中PLK1、E-cadherin、N-cadherin和C-myc蛋白表达Fig.1 PLK1,E-cadherin,N-cadherin,and C-myc expression of OE33 cells determined by Western blotting
2.3 流式细胞术检测细胞周期的影响
结果显示:PLK1 siRNA组G2/M期细胞为 (14.63±1.36) %,与Control组 (7.47±0.38) %比较显著增高,差异有统计学意义 (t = -8.81,P = 0.001) ;S期细胞为(44.77±0.64) %,与Control组 (51.37±0.45) %比较降低,差异有统计学意义 (t = 14.68,P < 0.001) ;G1期细胞为 (40.60±1.15) %,与Control组 (41.17±0.81) %比较 ,差异无统计学意义 (t = 0.70,P = 0.524)。见图2。
2.4 Transwell侵袭实验
与Control组穿膜细胞数 (115±3.51) 相比,PLK1 siRNA组穿膜细胞数 (76±3.51) 明显减少,差异有统计学意义 (t = -13.49,P = 0.000) ,见图3。
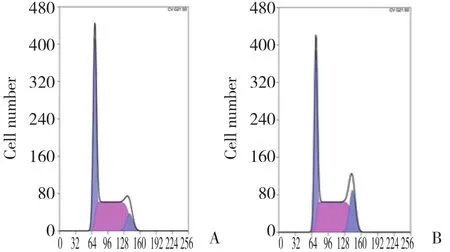
图2 流式细胞术检测细胞周期的变化Fig.2 Cell cycle changes determined by flow cytometry
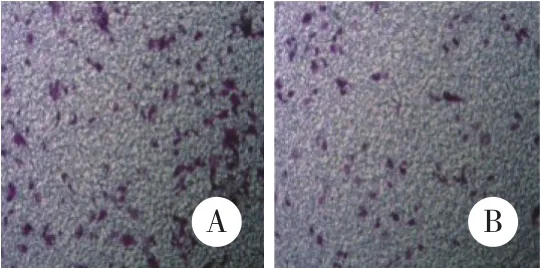
图3 siRNA沉默PLK1基因后OE33细胞侵袭能力的变化 ×400Fig.3 Effect of siRNA PLK1 on OE33 cell invasion ability determined by the Transwell invasion assay ×400
3 讨论
PLK1在多种人类肿瘤中过表达和高度活跃,与肿瘤细胞生长与增殖所必需[7],不但能直接作用于细胞的恶性转化,而且可以通过磷酸化G2/S表达蛋白和Topors抑制p53的活性,帮助DNA受损的细胞逃逸监测点的阻滞,以增加染色体不稳定,最终导致肿瘤的发生。此外也有研究[8]发现,PLK1与肿瘤侵袭转移以及预后密切相关,鉴于PLK1在肿瘤发生发展中起着重要作用以及PLK1抑制剂可以通过阻滞有丝分裂来诱导细胞凋亡,PLK1可以作为一个潜在的有效抗肿瘤靶点[9]。目前尚不清楚PLK1调节食管腺癌细胞生物学行为的确切机制,由于近年来针对基因采取的精准医疗显示出良好的抗肿瘤前景,因此本研究通过应用RNA干扰下调OE33细胞的PLK1基因表达,观察其抗肿瘤效果。研究结果显示,转染PLK1 siRNA 48 h后的OE33细胞内源性PLK1 mRNA和蛋白表达均显著下调,明显低于Control组,提示OE33细胞中存在高表达,特异性的PLK1 siRNA可以显著下调食管腺癌细胞内源性PLK1的表达。
细胞周期包括细胞分裂期 (M 期) 和间期2个阶段,本研究应用流式细胞术对转染PLK1 siRNA后OE33细胞的周期分布变化进行分析。结果显示,PLK1 siRNA组较Control组相比可将更多细胞阻滞于G2/M期,从而调控肿瘤细胞的增殖。这与AMANI等[10]采用PLK1靶向抑制剂BI 6727处理神经胶质瘤细胞,发现可以通过显著阻滞细胞于G2/M期,导致肿瘤细胞增殖和凋亡增加的结果一致。为进一步探讨食管腺癌细胞PLK1表达和周期变化的可能机制,本研究对细胞周期相关蛋白C-myc表达进行检测。C-myc是细胞周期的关键因子也属于原癌基因,其作为转录因子可调控细胞周期相关蛋白Cyclin D1、Cyclin E等表达促进胞DNA复制,诱导细胞增殖[11]。TAN等[12]研究发现,肿瘤细胞中可能存在PDK1-PLK1-Myc通路,PLK1是PDK1/Myc通路中的核心成份,PDK1通过激活PLK1后进一步激活Myc,共同维持肿瘤的生长增殖和分化。本研究发现沉默PLK1基因后C-myc蛋白表达下降,表明在食管腺癌细胞中PLK1信号通路激活后诱导细胞恶性转化的途径之一,可能是通过上调C-myc表达对细胞周期进行调控,从而促进细胞异常增殖。
上皮-间质转化指上皮细胞在特定条件下转化为间质细胞的过程,在此过程中表现为E-cadherin等上皮表型标志下调[13],N-cadherin和Vimentin等间质表型特征分子[14]表达上调等特征,通过此转化导致肿瘤细胞侵袭与转移能力显著增强[15]。CAI等[8]研究发现,PLK1可以通过调节AKT途径促进胃癌细胞的转移和上皮间质细胞转化的能力。本研究表明,抑制PLK1表达后可导致E-Cadherin蛋白表达上调以及N-Cadherin蛋白表达下调,从而促进了上皮-间质转化过程。并且Transwell侵袭实验进一步显示,敲掉PLK1基因后可导致细胞侵袭能力明显下降,穿膜细胞数明显减少,分析其原因可能是PLK1通路通过诱导食管腺癌细胞的上皮-间质转化过程促进侵袭转移。
综上所述,本研究发现PLK1在食管腺癌细胞的生长增殖和诱导上皮-间质转化、促进侵袭转移的过程中发挥重要作用,PLK1可能成为食管腺癌分子靶向治疗的一个有吸引力的靶标。
