宫内发育迟缓对大鼠胰腺中Ngn3表达及内分泌细胞发育的影响
2018-10-15徐春卓辛颖
徐春卓,辛颖
(中国医科大学附属盛京医院小儿内分泌遗传代谢科,沈阳 110004)
宫内发育迟缓 (intrauterine growth retardation,IUGR) 一般是指出生时的体质量 (birth weight,BW)低于同胎龄、同性别平均体质量的第10百分位数或2个标准差新生儿[1]。IUGR是围产期致死率的主要原因之一,约占死亡率的5%~10%[2]。胰岛结构的产生、发育、增殖、成熟以及胰岛素合成与分泌中任何程序出现错误,都可能使血糖升高并可导致糖尿病发生风险增加[3-5]。妊娠期是胰腺发育的关键时期,胰腺良好发育是实现其功能作用的基石,因此胰腺发育期是探讨糖尿病发病机制的关键时期。
在胰腺发育过程中,内分泌细胞产生于Ngn3标记的胰腺祖细胞[6]。Ngn3 属于碱性螺旋-环-螺旋bHLH (basic helix-loop-helix) 转录因子家族成员,研究[7]认为Ngn3是内分泌祖细胞标记物,对于内分泌细胞的命运具有决定作用。研究[8]发现Ngn3在内分泌细胞产生、再生、重编程方面发挥至关重要的作用。Ngn3突变小鼠内分泌缺失,4种胰岛细胞和内分泌前体细胞在各个阶段都出现缺失,小鼠在围生期死于糖尿病[9]。由此可见,Ngn3正常表达对于维持内分泌结构与功能至关重要。本研究采用全孕期低蛋白饲料喂养的营养不良法建立IUGR大鼠模型,检测IUGR组大鼠Ngn3蛋白表达情况,验证IUGR对内分泌祖细胞发育的影响,从胰腺发育的角度探讨糖尿病发病机制。
1 材料与方法
1.1 动物模型建立
选取体质量230~280 g、健康雌性、处女Wistar大鼠 (长生公司) ,由实验动物中心SPF级别适应性饲养5 d,雌雄 (4∶1) 大鼠合笼,确认已受孕的大鼠 (共36只) 根据喂养饲料 (北京华阜康公司) 不同随机分成2组:全孕期低蛋白饮食组 (18只) ,标准饲料饮食组 (18只) 。标准饲料饮食组蛋白含量为22%,其子鼠为CON组;低蛋白饮食组给予8%蛋白,其子鼠为IUGR组。随机选取孕第15.5天 (E15.5) 、第18.5天(E18.5) 、新生第1天 (P1) 低蛋白饮食组和标准饲料饮食组大鼠,剖宫产或自然娩出胎鼠或新生鼠,记录IUGR组体质量低于CON组体质量2个标准差的胎鼠或新生鼠,确定为E15.5、E18.5、P1 IUGR子鼠造模成功。
1.2 标本采集及处理
E15.5、E18.5时的胎鼠由孕鼠采用异氟烷麻醉,剖宫产取出;新生鼠自然分娩所得。称重,符合IUGR标准的在解剖显微镜下迅速分离胰腺组织;将分离胰腺置于4%多聚甲醛中48 h,以备石蜡包埋使用。
1.3 组织形态学观察
石蜡包埋胰腺组织,将蜡块切成3.5 μm切片,每组每只大鼠胰腺标本取2张胰腺石蜡切片,HE染色,采用Eclipse 80i图像分析系统的医学图像分析软件,每张切片随机选取1~2个高倍视野,观察胰腺腺泡、导管及胰岛发育情况。
1.4 免疫组织化学染色
脱蜡水化,柠檬酸盐微波7 min煮沸修复,3%过氧化氢封闭内源性过氧化物酶,PBS水洗后用山羊血清封闭,一抗Ngn3 (1∶30,英国Abcam公司) 4℃冰箱孵育12h后室温复温,二抗37 ℃孵育,辣根酶标记的链酶亲和素37 ℃孵育,DAB显色,苏木素染核,脱水,透明,封固。镜下观察细胞,出现棕黄色颗粒为阳性表达。
1.5 统计学分析
2 结果
2.1 IUGR组和CON组胎鼠与新生鼠体质量比较
采用全孕期低蛋白饮食方法制造IUGR大鼠动物模型。结果显示,IUGR组体质量均明显低于CON组 (均P < 0.05) ,E15.5、E18.5、P1 IUGR子鼠造模成功。见表1。
2.2 胎鼠和新生鼠胰腺组织形态学观察
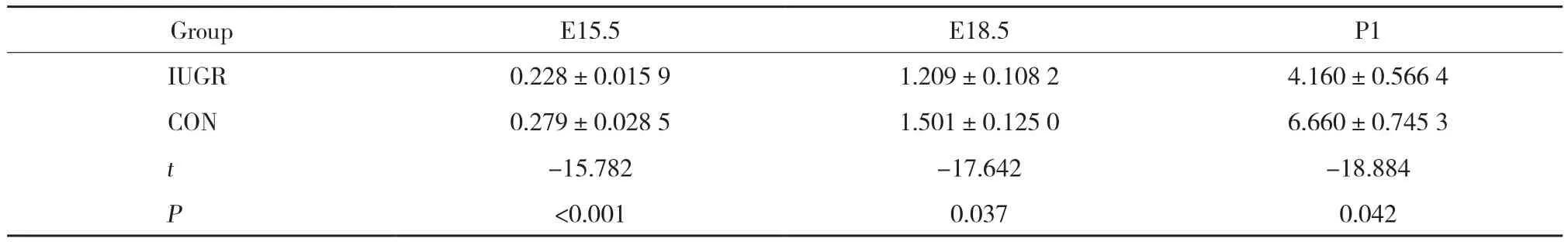
表1 IUGR 组和CON组胎鼠及新生大鼠体质量比较 (g)Tab.1 Comparison of body weights between embryonic and newborn rats in the IUGR and CON groups (g)
结果显示,CON组E15.5时,胰腺腺泡、导管结构已出现,腺泡、导管数量较多、体积稍大,排列密集;E18.5时,胎鼠β细胞开始聚集,胰岛结构初步形成;P1时可见胰腺内外分泌部的典型结构已形成,胰岛数量较多,面积较大,胰岛结构饱满、清晰。IUGR组与CON组比较,E15.5时腺泡导管结构体积小、数量少,排列较松散,E18.5时组织弥散,P1时则胰岛数量及面积减少,分布相对不规则、散乱。见图1。
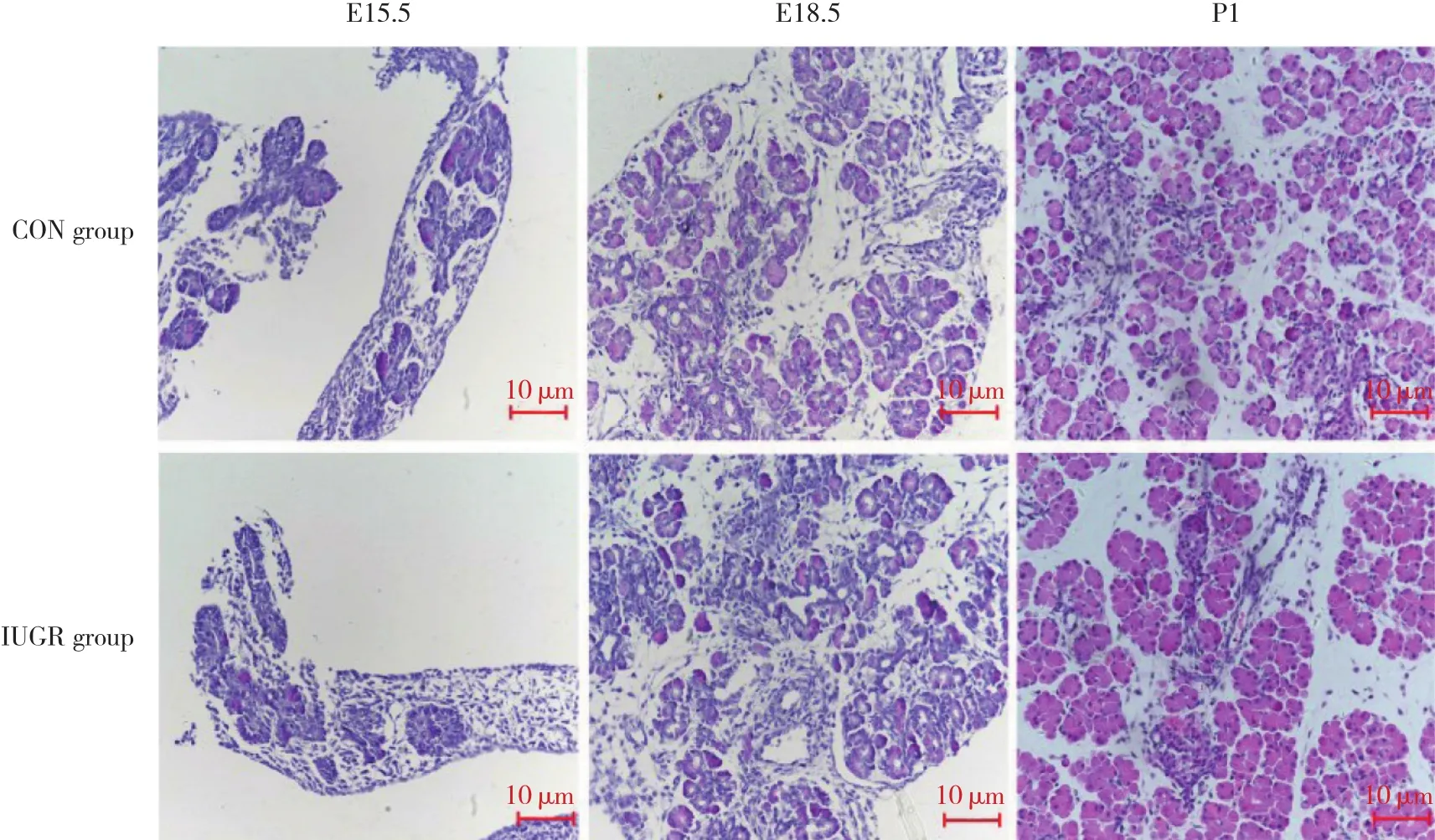
图1 CON组和IUGR组不同发育阶段胰腺光镜检测结果 HE染色Fig.1 Light microscope observations of pancreatic tissues in control and IUGR rats HE
2.3 胎鼠和新生鼠发育各时期胰腺组织中Ngn3蛋白表达位置
通过免疫组织化学染色方法观察2组Ngn3蛋白在E15.5、E18.5、P1时分布情况,结果显示,E15.5时胰腺组织中Ngn3主要表达在胰腺导管、内分泌细胞和腺泡;E18.5时Ngn3主要表达在胰腺导管、初步形成的小胰岛,少量表达腺泡中;P1时Ngn3表达在胰腺的胰岛中,少量表达在导管、腺泡中。CON组Ngn3蛋白阳性反应部位的平均密度值随着发育逐渐下降,对照组Ngn3蛋白阳性反应部位的平均密度值与E15.5、E18.5比较P1时下降明显 (P < 0.01) 。IUGR组E15.5、 E18.5时低于CON组,差异有统计学意义 (均P < 0.05) ;P1时 Ngn3蛋白阳性反应部位的平均密度值低于CON组,但差异无统计学意义 (P >0.05) ,见图2、表2。
3 讨论
胎儿期与新生儿各器官发育、增殖、功能完善过程受营养物质的调节,营养物质的数量和 (或) 质量是保证正常发育的基础。妊娠期是各器官发育的关键时期,此时营养不良将造成器官形成、发育及功能成熟的程序化错误。本研究通过采用全孕期低蛋白饲料喂养的营养不良法,发现E15.5、E18.5及新生仔鼠体质量明显减低,表明IUGR模型建立成功。研究[10]表明妊娠中晚期不利营养环境会导致胰岛内分泌结构发生永久性改变。结果显示,HE染色方法发现不同发育阶段胰腺各细胞成分形态上逐渐成熟,与CON组比较,IUGR组胚胎期胰腺组织更加弥散,新生期胰岛数量及面积减少,分布相对不规则、散乱,说明IUGR可使发育期胰腺结构改变。
RUKSTALIS等[11]认为Ngn3是胰腺胰岛分化和再生的主要调节器。在胚胎胰腺发育过程中,Ngn3对于内分泌的形成是必不可少的,近来KRENTZ等[12]发现Ngn3被细胞周期蛋白依赖性激酶磷酸化后降解,而G1期延长可使磷酸化水平下降,趋使内分泌分化,由此可见细胞周期延长可使Ngn3降解减少,反之表达量相对升高,对于诱导内分泌分化是至关重要的。AZZARELLI 等[13]发现在发育过程中Ngn3多位点磷酸化可调节胰腺内分泌分化,同时在病理情况下维持成熟胰岛β细胞功能。本研究发现Ngn3蛋白在胰腺发育的二次分化时表达高,此后随着胎龄增长表达量逐渐降低,与以往结果一致,体现其在胚胎胰腺发育期的重要作用,这一现象可能与泛素化、类泛素化及蛋白酶体降解有关,也可能与Ngn3细胞增殖能力逐渐下降有关[14]。CARPINO等[15]研究表明胚胎胰腺导管中Ngn3 (+) 细胞可以被认为是内分泌祖细胞,具有促进胰岛素分泌的作用。本实验通过组织化学染色发现在胚胎期Ngn3主要表达在胰腺的导管中,说明胚胎期位于胰腺导管中的Ngn3细胞具有分化为内分泌细胞的潜能。

表2 2组Ngn3阳性反应部位平均密度值比较Tab.2 Comparison of Ngn3 mean density between two groups
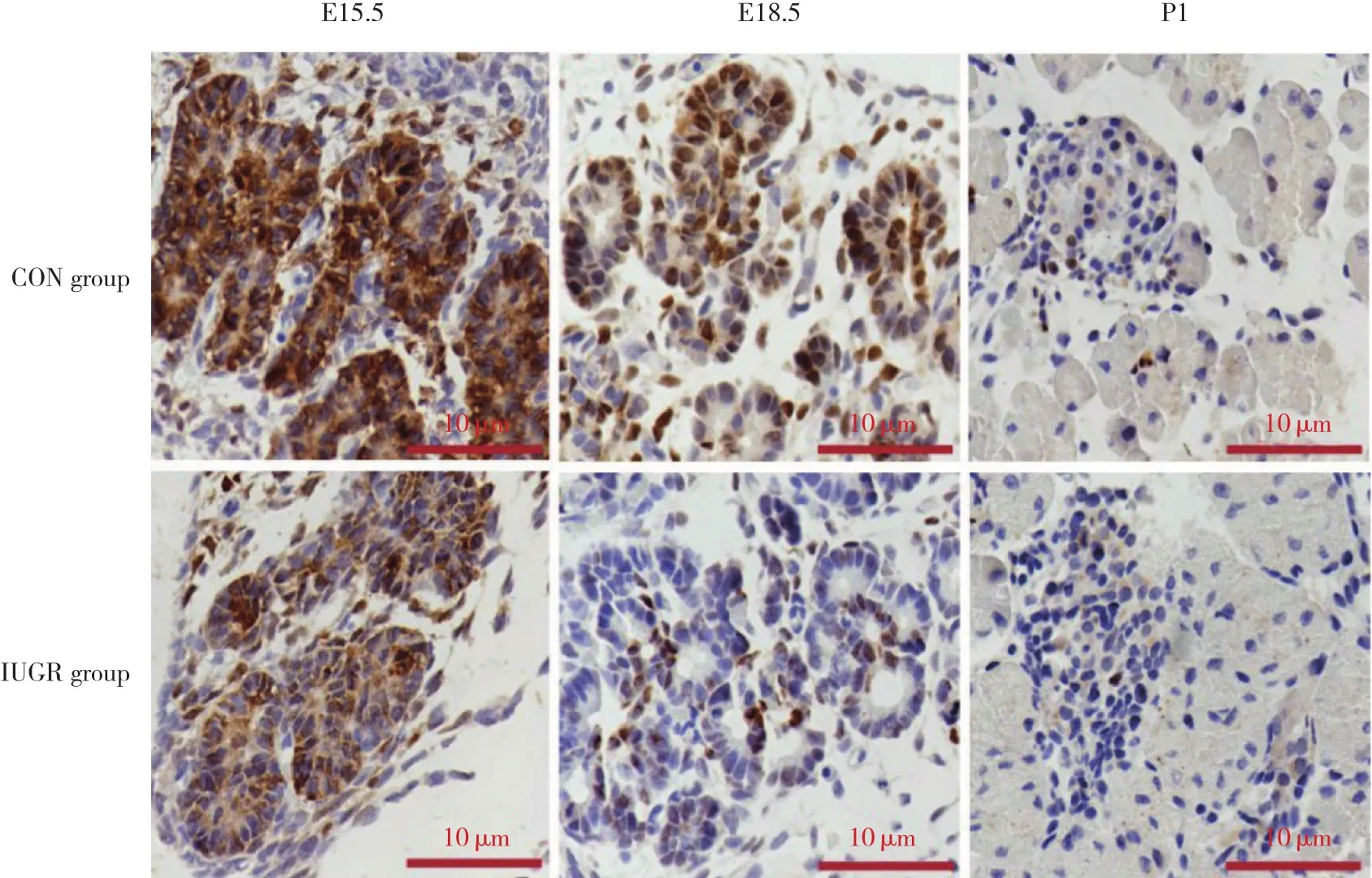
图2 胚胎期和新生儿期IUGR组及CON组大鼠胰腺中Ngn3蛋白分布Fig.2 Immunohistochemical localization of Ngn3 in control and IUGR rats at different developmental stages
研究[16-17]发现Ngn3对于内分泌分化不是必需的,但是其合适剂量对于保证内分泌命运却是至关重要的。本实验检测了IUGR组E15.5、E18.5及新生期Ngn3蛋白的表达情况,发现其表达量明显下降,且与CON组比较差异具有统计学意义,说明IUGR严重影响Ngn3蛋白的表达量,导致内分泌祖细胞减少,胰腺内分泌发育异常。
综上所述,孕期全程低蛋白饮食的营养不良可致大鼠发生IUGR,并影响胰腺中Ngn3的表达,Ngn3表达下降可能导致胰腺β细胞分化及功能成熟障碍,进而导致胰腺发育不良,胰岛数量及面积相应减少。然而胰腺发育的过程极其复杂,并非单个基因的作用,是受多个基因及调控网络共同作用的结果,因此IUGR如何对胰岛β细胞发育及功能造成影响还有待进一步探索。
