五味子多糖的酶解辅助提取及其对小鼠肠道菌群的影响
2018-10-13王琳高辰哲崔石阳刘冬刘丹仪韩建春
王琳,高辰哲,崔石阳,刘冬,刘丹仪,韩建春,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨150030)
五味子一般指木兰科植物五味子的成熟果实,具有抗疲劳[1]、镇痛[2]、抗氧化[3]与调节肠道菌群[4]等生物功效,为中医常用滋阴强肾药,广泛应用于肝炎、神经衰弱等病症的治疗[5]。五味子中含有多糖、木质素、挥发油等生物活性成分[6],其中多糖已经有研究证实具有多种功效[7]。近年来的研究发现,多糖具有抗肿瘤、抗病毒、增强免疫力、抗血脂、抗辐射、免疫调节等功效,对多糖的提取和活性研究成为了新的热点[8]。传统多糖的提取方法以水提醇沉为主,但存在提取率较低的缺陷。复合酶法提取多糖因其破坏细胞壁效果好,提取条件温和,正逐渐受到广大研究者的重视,将复合酶法应用于五味子多糖的提取目前研究较少。
肠道内的菌群具有辅助营养吸收、生物拮抗、免疫调节等作用,可以为宿主的肠道形成一道天然屏障[9]。有研究表明,多糖可以促进肠道中有益菌的生长,产生短链脂肪酸,抑制有害菌的生长[10]。五味子多糖已经被发现具有抗肿瘤[11]、降脂[12]、抗氧化[13]等功能,而五味子多糖能否对肠道菌群产生影响目前尚无明确报道。
本研究采用复合酶辅助提取五味子多糖,优化五味子多糖的提取条件,并通过建立小鼠肠道菌群紊乱模型,对比不同剂量五味子多糖的摄入对小鼠肠道菌群的影响,初步揭示五味子多糖对肠道菌群的调节作用,为其在肠道紊乱防治方面的应用提供思路。
1 材料与方法
1.1 材料与试剂
五味子:黑龙江省北安市农贸市场。
石油醚、苯酚、浓硫酸、氯仿:盛达生化科技有限公司;盐酸林可霉素注射液:河南福森药业有限公司;BBL琼脂培养基、伊红美蓝琼脂、Pfizer肠球菌选择性琼脂、MRS琼脂培养基:青岛海博生物技术有限公司。
木瓜蛋白酶(活力50 000 U/g):北京奥博星生物技术有限责任公司;果胶酶(20 000 U/g)、纤维素酶(活力5 000 U/g):上海蓝季科技发展有限公司;3种酶按质量比1∶1∶1混合成复合蛋白酶。
1.2 仪器与设备
DHP-9162电热恒温培养箱、LDZX-50 KB立式压力蒸汽灭菌器、LRH-250型生化培养箱:上海一恒科技有限公司;FD-1型冷冻干燥机:上海田枫实业有限公司;JD500-2型电子天平:沈阳天平仪器有限公司;TGL-16 C型高速离心机:江苏牡丹离心机制造有限公司;SW-CJ-1 F超净工作台:苏州江东精密仪器有限公司;索氏抽提器:上海比朗仪器制造有限公司;UV-2401型紫外可见分光光度计:日本岛津公司;GFSJ-8高速粉碎机:安丘市经欣粉体加工设备有限公司;HYQX-II厌氧培养箱:宁波赛福实验仪器有限公司。
1.3 五味子多糖的提取
选取干燥的成熟五味子果实,使用高速粉碎机粉碎,40目筛网过筛得五味子干粉。使用石油醚索式抽提12 h后取出,将溶剂挥发干净,得到预处理的脱脂样品。各组样品取5 g脱脂样品,加入蒸馏水调节浓度达0.05 g/mL,在搅拌条件下,各组使用柠檬酸-氢氧化钠-盐酸缓冲溶液调节不同的pH值,注意调节过程缓慢搅拌,保证最终pH值的稳定准确。各组分别添加相应体积的复合酶液,在一定温度下600 r/min匀速搅拌指定时间。加入溶液体积3%的双氧水4℃静置脱色处理一夜,使用截留分子量为3 600 u的透析袋4℃透析48 h,透析液冷冻干燥得到五味子多糖冻干粉。以提取温度、提取时间、提取pH值、复合酶添加量为主要因素变量,经过单因素初筛后进行正交试验。
1.4 多糖含量与得率的测定
使用徐世忱等[14]的苯酚-硫酸法并做部分改动。取2 mL样液(若检测时吸光值超过0.9则将样品按一定比例稀释至2 mL)依次加入1 mL含6%苯酚的乙醇溶液、5 mL浓硫酸,常温静置10 min,以葡萄糖为标准物,在490 nm波长处测定标准物质量浓度与吸光度的对应关系,制备标准曲线,计算总糖含量。
采用3,5-二硝基水杨酸比色法[15],取2 mL样液(若吸光值超过0.9,则按一定比例稀释至2 mL)至25 mL具塞试管中,加入2 mL含有3,5-二硝基水杨酸的显色剂,在沸水浴中加热2 min后迅速冷却,加水至刻度混匀,测定在波长540 nm下的吸光度,制备标准曲线,计算还原糖含量。
多糖含量/mg=总糖含量(mg)-还原糖含量(mg)多糖提取率/%=样品中多糖含量(mg)/样品质量(mg)×100
1.5 试验动物处理
采用同一批次、健康的昆明小鼠(KM mice,品系编码202)120只,购自北京维通利华实验动物技术有限公司,5周龄~8周龄,雄性,体重18 g~22 g。适应性饲养一周后,将小鼠随机分为5组:空白对照组、紊乱自然恢复组、多糖低剂量干预组、多糖中剂量干预组及多糖高剂量干预组。实验开始,紊乱自然恢复组和各多糖干预组使用300 mg/mL盐酸林可霉素灌胃,每天灌胃2次,每次0.3 mL,持续3 d,建立肠道菌群紊乱模型,空白组使用相同体积的生理盐水灌胃[16]。小鼠在实验期间均自由采食、取水,按照表1方案,每天定时对各组小鼠灌胃持续14 d,不同剂量的多糖使用生理盐水预先溶解,当天现用现配。

表1 小鼠处理方案Table 1 Treatment of mice
1.6 样品的采集与处理
1.6.1 样品采集
灌胃14 d后,颈部脱臼处死小鼠,无菌条件下,收集回盲部末端6 cm以内的盲肠内容物,置于干燥灭菌试管中,无菌取1 g样品加入9 mL生理盐水,震荡至盲肠内容物完全分散。
1.6.2 盲肠内容物菌液稀释
每份样品分别取装有9 mL生理盐水的带塞试管8支,灭菌后放置到室温待用。取震荡完全分散的盲肠内容物1 mL加入到生理盐水中,依次10倍稀释至第8 支,稀释度为 10-8[17]。
1.6.3 接种
如表2所示,在不同的选择性培养基上涂布相应稀释度的样品100 μL,每个稀释度重复3个平行,按照表3所示培养条件分别进行培养。

表2 细菌接种稀释度Table 2 Bacterial dilution

表3 肠道主要菌群培养条件Table 3 Culture conditions of main intestinal flora
1.7 菌群培养与计数
使用平板活菌计数法进行计数,选择单板单菌落数在30个~300个之间的稀释倍数计数,计算菌落总数,结果以对数形式表示[18]。
1.8 统计学方法
用Statistix 8.0软件进行数据分析,3次重复独立实验的结果表达为平均值±标准偏差(means±SD),方差分析(ANOVA)使用Tukey模式,各干预组与对照组、紊乱自然恢复组的比较采用单因素方差分析法,P<0.05表示有显著性差异,P<0.01为差异极显著,采用Sigmaplot软件进行作图。
2 试验结果与分析
2.1 酶解辅助提取单因素试验
设定提取温度(30、35、40、45、50、55 ℃),提取时间(20、40、60、80、100、120 min),提取 pH 值(4、4.5、5、5.5、6、6.5),复合酶添加量(0.5%、1%、1.5%、2%、2.5%、3%)(相对于底物),4个变量中的3个保持不变,分别研究单因素指标不同对多糖得率造成的影响,结果如图1所示。

图1 不同因素对五味子多糖得率的影响Fig.1 Effect of different factors on the yield of polysaccharides
由图1A可知,温度对于多糖得率有一定影响,适当升高温度可以增加多糖得率,这是由于温度升高提高多糖类物质的布朗运动水平,使其加速扩散到周围溶剂中,同时适当的温度也可以增加酶的活性,加快了细胞壁的破坏从而促进多糖溶出。当温度过高时,虽然能提高多糖的溶解效率,但酶的活力受到抑制,对多糖得率也造成了一定损失,为了保证较高的多糖得率,选择40、45、50℃作为后续正交试验多糖提取温度变量。
由图1B可知随着提取时间的延长,多糖的得率得到提高,当时间超过80 min时,多糖的得率不再显著变化。这主要是因为五味子多糖随着时间的延长逐步溶解入水中,同时,由于复合酶的作用,使五味子细胞壁受到破坏,更多的多糖类物质逐渐溶出。而随着时间的延长,溶剂中多糖浓度越来越高,浓度差变小减慢了多糖进入溶剂的速度,多糖溶解入水中的速度逐渐减缓,而酶解的底物也逐渐消耗殆尽,对于多糖溶出的促进作用越发不明显[19]。再延长提取时间对于提取率没有显著的促进作用,会造成时间和能源的浪费。综合时间和提取率,选择60、80、100 min作为后续正交试验的提取时间变量。
由图1C可知,pH值对于多糖的得率有显著影响,当pH值为5.5时,多糖得率达到最佳。表明此pH值条件下的复合酶活力较高,多糖溶出率也较高。随着pH值提高或降低,酶活随之下降,从而影响了多糖得率,这可能与多糖亲水基团及疏水基团的暴露有关系。因此,选择5.0、5.5、6.0作为后续正交试验的提取pH值变量。
由图1D可知,当复合酶用量达到提取液质量的2.0%时,多糖得率最高达到11.8%。随着复合酶用量的增加,相同时间内更多的五味子细胞壁被酶解破坏,造成了多糖的溶出。而当复合酶添加量达到一定程度时,更多的酶制剂对改善多糖得率的效果微乎其微,这可能是由于复合酶含量相对于底物过高,底物过早被消耗而造成了酶制剂的浪费[20]。为了让酶解有效率且不过分浪费酶制剂,选择了1.5%、2.0%、2.5%添加量作为后续正交试验的复合酶变量。
2.2 正交试验结果及分析
五味子多糖提取工艺优化正交试验水平表见表4,正交试验设计及结果见表5。
由表5可知,影响酶解辅助提取五味子多糖的主次因素为:提取复合酶添加量>pH值>酶解时间>酶解温度。K值得最适条件为A2B2C1D1,以最佳提取条件进行验证试验,在最佳条件下,五味子多糖提取率为11.5%,没有A2B2C3D1条件下获得的五味子多糖得率高,因此试验选用A2B2C3D1条件,即提取温度45℃、提取时间80 min、提取pH 6.0、复合酶添加量1.5%。
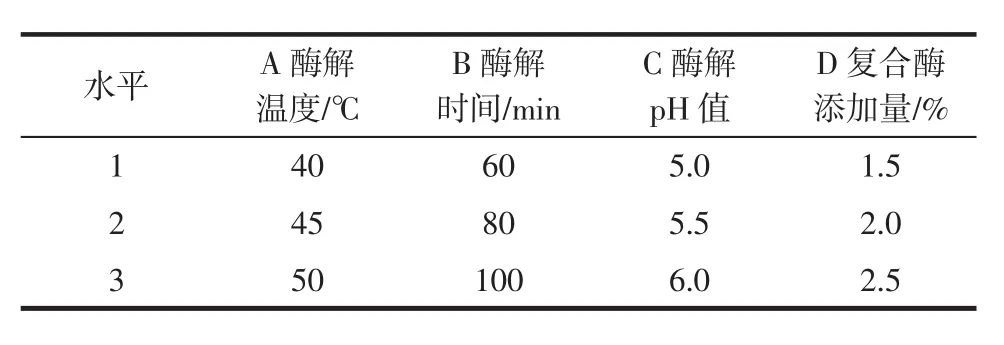
表4 五味子多糖提取工艺优化正交试验水平表Table 4 Factors and coded levels used in the orthogonal array design for optimization of polysaccharide from Schisandra chinensis extraction
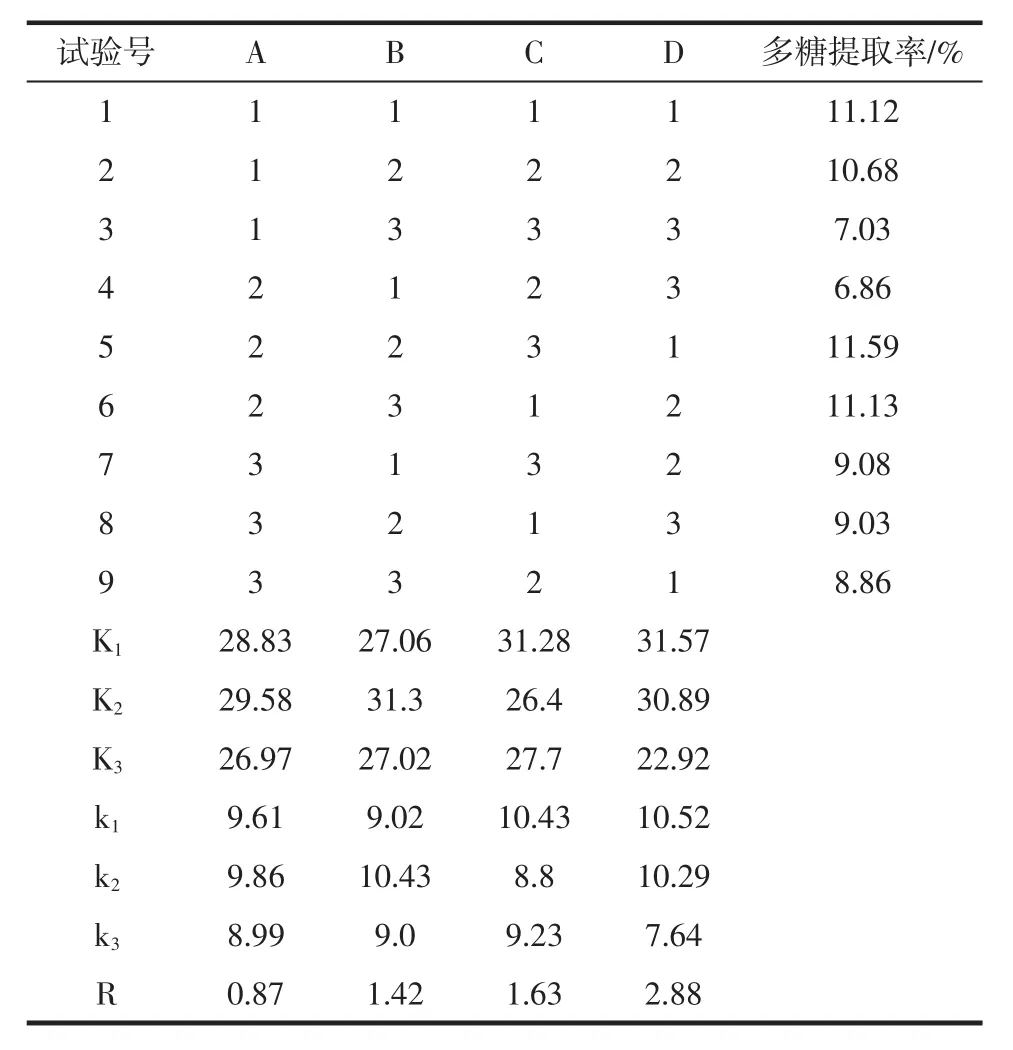
表5 五味子多糖提取工艺优化正交试验设计及结果Table 5 Orthogonal array design scheme and corresponding results for optimization of polysaccharide from Schisandra chinensis extraction
2.3 五味子多糖的摄入对小鼠肠道菌群的影响
2.3.1 摄入五味子多糖对双歧杆菌的作用
经过超滤、冻干等步骤的操作,最终能够得到的五味子粉末多糖纯度经检测可达到92.32%。
分别使用不同剂量的五味子多糖灌胃造模小鼠0、7、14天后,连同空白对照组和紊乱自然恢复组,研究不同剂量五味子多糖的摄入对于小鼠肠道内双歧杆菌含量的影响,如图2所示。
由图2可知,五味子多糖有助于提升小鼠肠道内双歧杆菌的含量,持续摄入五味子多糖,小鼠肠道内双歧杆菌逐渐增多,而且随着多糖摄入量的提高,小鼠肠道内双歧杆菌的含量有所提高。双歧杆菌具有抑制致病菌、免疫调节、抗肿瘤以及调节肠道内环境的作用,本研究结果显示五味子多糖能够促进益生菌之一——双歧杆菌的生长,且促进作用与多糖摄入剂量呈正相关。
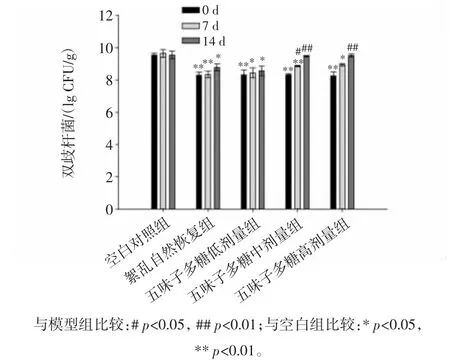
图2 各组小鼠肠道内双歧杆菌数量Fig.2 The quantity of Bifidodacterium on intestinal flora of mice in each group
2.3.2 摄入五味子多糖对乳杆菌的作用
分别使用不同剂量的五味子多糖灌胃造模小鼠0、7、14天后,连同空白对照组和紊乱自然恢复组,研究不同剂量五味子多糖的摄入对于小鼠肠道内乳杆菌含量的影响,如图3所示。
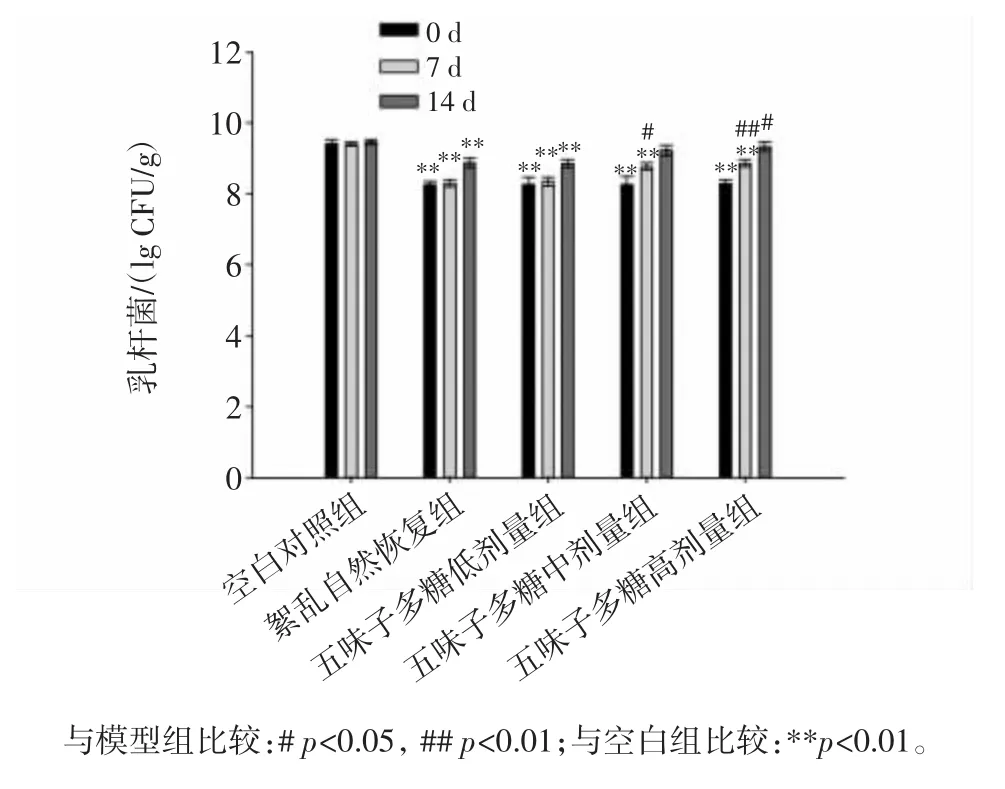
图3 各组小鼠肠道内乳杆菌数量Fig.3 The quantity of Lactobacilus on intestinal flora of mice in each group
由图3可知,第7天,对比紊乱自然恢复组,中剂量组小鼠肠道内乳杆菌的数量有极显著增加,第14天,高剂量组小鼠肠道内乳杆菌的数量显著增加,持续摄入五味子多糖可以提高小鼠肠道内乳杆菌的含量,高剂量的五味子多糖长时间饲喂能够显著提高小鼠肠道中的乳杆菌含量,且促进作用与多糖摄入剂量呈正相关。
2.3.3 摄入五味子多糖对肠球菌的作用
分别使用不同剂量的五味子多糖灌胃造模小鼠0、7、14天后,连同空白对照组和紊乱自然恢复组,研究不同剂量五味子多糖的摄入对于小鼠肠道内肠球菌含量的影响,如图4所示。

图4 各组小鼠肠道内肠球菌数量Fig.4 The quantity of Enterococcus on intestinal flora of mice in each group
由图4可知,灌胃盐酸林可霉素后,紊乱自然恢复组小鼠肠道内肠球菌数量极显著升高,从第7天开始,五味子多糖中剂量组小鼠肠道内肠球菌数量显著降低,第14天时,低、中、高剂量组小鼠肠道内肠球菌数量均极显著降低,持续摄入五味子多糖可以显著降低小鼠肠道内肠球菌的含量,且存在剂量效应关系。
2.3.4 摄入五味子多糖对大肠杆菌的作用
分别使用不同剂量的五味子多糖灌胃造模小鼠0、7、14天后,连同空白对照组和紊乱自然恢复组,研究不同剂量五味子多糖的摄入对于小鼠肠道内大肠杆菌含量的影响,如图5所示。
由图5可知,灌胃盐酸林可霉素后,小鼠肠道内大肠杆菌数量显著升高,喂食五味子多糖后小鼠肠道内大肠杆菌数量呈下降趋势,在第14天时,中、高剂量五味子多糖组小鼠肠道内大肠杆菌数量分别显著、极显著降低,持续摄入五味子多糖可以显著降低小鼠肠道内肠球菌的含量,且存在剂量效应关系。
2.4 五味子多糖对小鼠体重的影响
实验期间各组小鼠体重变化见图6。
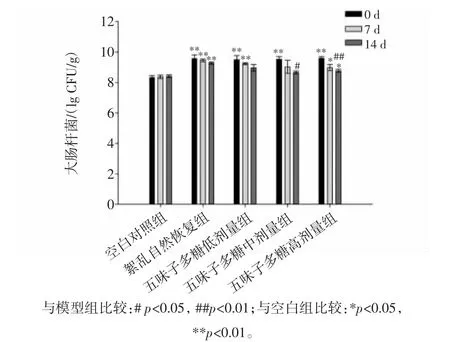
图5 各组小鼠肠道内大肠杆菌数量Fig.5 The quantity of Escherichia on intestinal flora of mice in each group
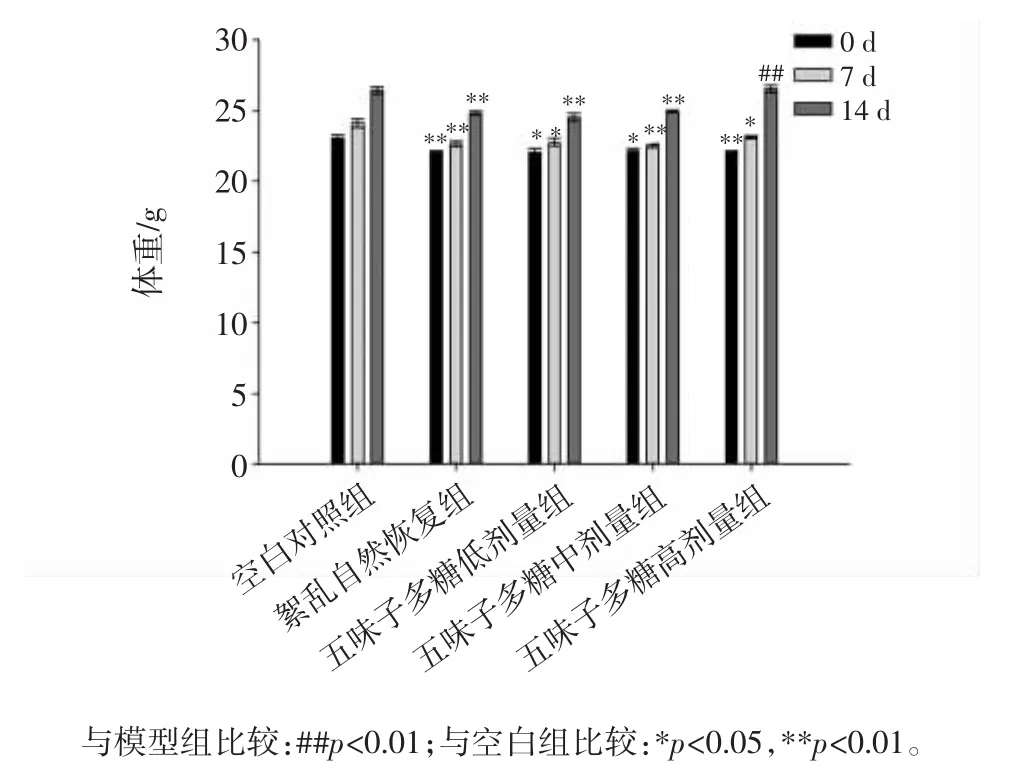
图6 实验期间各组小鼠体重变化Fig.6 The body weight of mice in each group during the experiment
由图6可见,小鼠喂食期间体重的变化可见,同空白组比较,紊乱自然恢复组小鼠体重极显著降低,不同剂量五味子多糖对小鼠体重的影响有差异,其中高剂量组小鼠体重变化与空白组相似,可见,不同剂量五味子多糖在发挥调节肠道菌群作用的同时对小鼠机体的生长有一定的影响
3 结论与讨论
健康的人体内存在大量微生物,长期与机体保持平衡。肠道内菌群形成微生态系统,以保护机体免受各种疾病的损伤。当人体肠道的菌群紊乱时,益生菌会大量减少,有害菌会大量增殖,破坏肠道环境。肠道内双歧杆菌、乳杆菌等有益菌共同保护机体免受外界环节的干扰,适当提高肠道内有益菌的数量可以更好的为机体设立防御系统。
通过单因素和正交试验可知,酶解辅助提取五味子多糖的最佳条件为提取温度45℃、提取时间80 min、提取pH 6.0、复合酶添加量1.5%,复合酶添加量对酶法提取五味子多糖影响最大,多糖提取率达到11.59%,五味子粉末多糖纯度经检测可达到92.32%。
与空白对照组比较,紊乱自然恢复组内双歧杆菌、乳杆菌数量均显著减低,肠球菌、大肠杆菌数量极显著增加,表明成功建立了肠道菌群失调小鼠模型,破坏了小鼠肠道内菌群形成的微生态系统。在此条件下摄入五味子多糖,肠道内双歧杆菌、乳杆菌等有益菌数量显著增高,肠球菌、大肠杆菌等条件性致病菌的数量显著降低,且均存在剂量效应关系,同时对小鼠机体的生长有一定的影响。表明五味子多糖确实能够在一定程度上调节因盐酸林可霉素导致的肠道紊乱,且高剂量的多糖对以上指标的改善效果最好。这可能是由于肠道内有益菌利用多糖进行代谢后产生了乳酸、乙酸等短链脂肪酸,降低了肠道内的pH值,从而抑制肠球菌、大肠杆菌的生长。
