海南黑山羊幼畜诱导卵泡发育与体外胚胎移植的应用研究
2018-10-13张家新赵华林林奕全王运俅刘春洁周广悦郭志勤史梅英韩雪华朱建明
易 华 ,张家新 ,张 通 ,赵华林 ,林奕全 ,王运俅 ,刘春洁 ,周广悦 ,王 琛 郭志勤,史梅英,韩雪华,朱建明*
(1.海南三亚雪古丽现代生态农业综合开发有限公司,海南 三亚 572000;2.内蒙古农业大学动物科学学院,内蒙古自治区动物遗传育种与繁殖重点实验室,呼和浩特 010018;3.新疆畜牧科学院,乌鲁木齐 830000)
幼畜体外胚胎移植(Juvenile In Vitro Embryo Transfer,JIVET)是诱导卵泡超数发育结合活体取卵、卵母细胞体外成熟、体外受精和胚胎移植等技术环节生产扩繁优秀纯种后代的技术体系,该技术体系已从实验室逐步转入了生产应用。目前,在羊的繁殖体系中,利用JIVET技术挖掘和利用优秀母畜的遗传潜力,在相对较短的时间里,从一只母羊获得更多遗传稳定的后代,相比传统的方法快几倍、甚至几十倍,大大提高了优良种羊群的繁殖效率,已成为我国肉羊良种繁育体系建设的重要繁殖生物技术之一[1-3]。
海南黑山羊是中国热带地区规模化养殖的优良山羊品种资源,成年羊不经激素处理活体采卵平均每只仅能获得2~8枚卵母细胞,经激素处理平均每只能获得10~20枚卵母细胞。羔羊卵巢上储备着大量的卵源细胞,有腔卵泡的数量在出生后4~8周龄达到高峰,且对促性腺激素刺激敏感[4-5]。幼畜体外胚胎生产效率低,很大程度上与羔羊卵母细胞体外核质成熟不同步有关。生理性减数分裂抑制剂C型钠肽(C-type natriuretic peptide,CNP)在抑制卵母细胞减数分裂诱导卵母细胞体外核质同步成熟过程中发挥了重要作用[6-7]。
目前,关于海南黑山羊JIVET技术的研究报道较少,本研究以海南黑山羊幼龄羔羊为研究对象,采用JIVET技术快速扩繁黑山羊后代,比较了供体羔羊激素处理方案、羔羊卵母细胞体外成熟体系并进行了幼畜体外胚胎移植,旨在挖掘和利用优秀母羊的早期繁殖潜力,促进黑山羊JIVET技术的应用推广。
1 材料与方法
1.1 试剂与药品
TCM-199 培养液、含 Ca2+、Mg2+磷酸盐缓冲液(Dulbecco's Phosphate-Buffered Saline,DPBS)、青链霉素合剂(Penicillin-Streptomycin,PS)均为Gibco公司产品;促卵泡生成素(FSH)、促黄体生成素(LH)购自于 Vetoquinol公司;雌二醇(E2)、胎牛血清(FBS)、透明质酸酶(Hya)、牛血清白蛋白(BSA)、聚乙烯醇(PVA)均购自于Sigma公司。孕马血清促性腺激素(PMSG)购自于宁波三生生物科技公司。
1.2 试验方法
1.2.1 供体羔羊超数诱导卵泡发育处理
选择35~45日龄健康无疾病的海南黑山羊供体羔羊进行激素处理,采用间隔12 h对供体连续4次或6次进行等剂量肌肉注射FSH,同时比较了最后一次注射FSH有无给予250 IU PMSG注射的效果。依据卵巢上卵泡发育数量、回收的卵丘细胞-卵母细胞复合体数以及体外受精后胚胎的卵裂率和囊胚率筛选最佳海南黑山羊羔羊激素超排方案。
1.2.2 采集卵丘卵母细胞复合体
供体羔羊肌肉注射速眠新进行全身麻醉,按体重0.023~0.033 mL/kg注射,供体麻醉后在手术架上仰卧保定。外科手术打开腹腔,引出卵巢,采用无菌10 mL注射器12#针头从卵巢表面抽取卵泡,采卵前需在注射器中预先抽取1~2 mL采卵液,在体视显微镜下挑选出含有卵丘细胞比较完整、胞质均匀的卵丘卵母细胞复合体(Cumulus Oocyte Complexes,COCs)用于体外成熟(In Vitro Maturation,IVM)。采卵液成分为:TCM-199+1 mg/mL BSA+0.7 mg/mL肝素钠。
1.2.3 卵细胞体外成熟
将洗涤后的COCs进行随机分组,常规法:将挑选COCs转入成熟液中进行常规24 h、26 h、28 h体外成熟;“双阶段”法:将挑选的COCs放入200 nM CNP抑制液中孵育4 h,然后再移入成熟液中进行体外成熟,培养环境为38.5℃,5%CO2:95%空气、饱和湿度。CNP预培养液成分:TCM-199+CNP+0.1%BSA,成熟液成分为:TCM-199+10%(v:v)FBS+1%(v:v)PS+10 μg/mL FSH+10 μg/mL LH+1 μg/mL E2+100 nM半胱胺+1%青链霉素合剂。
1.2.4 体外受精和体外培养
将新鲜精液300 μL轻轻加入已平衡 2 h以上含有 700 μL受精液中(受精液:SOF+2%发情绵羊血清(OSS)+6 IU/mL肝素钠)的2个EP管底部,置于培养箱中孵育上游40 min。然后将上游液中的精液转移到1.5 mL的EP管中,在1 300 r/min的条件下室温离心4 min,弃掉上清液,再次加入1 mL受精液离心洗涤,再次弃掉上清液,留约200 μL精液沉淀,轻轻吹打混匀,将精液密度调整为约1×106个/mL。使用0.1%透明质酸酶将成熟的卵母细胞外周的卵丘颗粒细胞部分吹打去除,并转移到受精液培养滴中。将混合均匀的悬液的精液加入受精液内与卵母细胞共同培养。
精子和卵子共同孵育24 h后,将假定的受精卵转移到体外胚胎发育液中,用移液器反复抽吸吹打受精卵,去除黏附在颗粒细胞上的精子和外周颗粒细胞。将受精卵用发育液洗涤3次后,按50枚/孔的密度转移到Nunc四孔培养板内。培养条件为:5%CO2、5%O2、90%N2、38.6℃饱和湿度的密封气袋内。受精后48 h统计卵裂率,在168 h统计囊胚率。
1.2.5 受体羊的选择及处理
选择繁殖性能良好,发情周期正常,无繁殖机能疾病,经检疫无传染病,健康、膘情在七成以上,经产黑山羊或当地麻羊作为受体羊。受体羊同期化发情处理方法:采用阴道埋植海绵栓,撤栓24~72 h发情,采用试情公羊确认发情移植。
1.2.6 胚胎移植
对受体羊进行手术,根据黄体发育情况确定能否移植胚胎,使用移植管吸取胚胎,进行输卵管移植。将有黄体一侧的输卵管伞部拔开,找到管口后,将装有胚胎的移植器从此插入3~4 cm,然后将胚胎轻轻推出即可,注意移植时保护黄体。
1.2.7 受体羊的饲养管理
对于完成移植的受体羊要由专人饲养和管护,每天注意观测受体母羊健康状况,发现异常情况要通知羊场负责人或兽医及时处理。移植后一个情期时要对移植羊群进行试情,返情羊要及时进行人工配种或公羊自然交配,减少空怀羊的损失。
1.2.8 统计分析
采用SPSS软件中的ANAVO进行单因素方差分析和显著性检验。P<0.05表示差异显著。
2 结果与分析
2.1 供体羔羊激素处理方案的比较
如表1所示,采用间隔12 h对供体羔羊连续6次等剂量肌肉注射FSH,在最后一次注射FSH的同时肌肉注射250 IU PMSG,获得的卵泡数、卵母细胞数和卵母细胞体外受精后卵裂率均显著高于其他实验组。但囊胚率在各组之间没有显著差异(P>0.05)。因此,后续试验均采用6次等量注射FSH结合肌肉注射250 IU PMSG的处理方案。
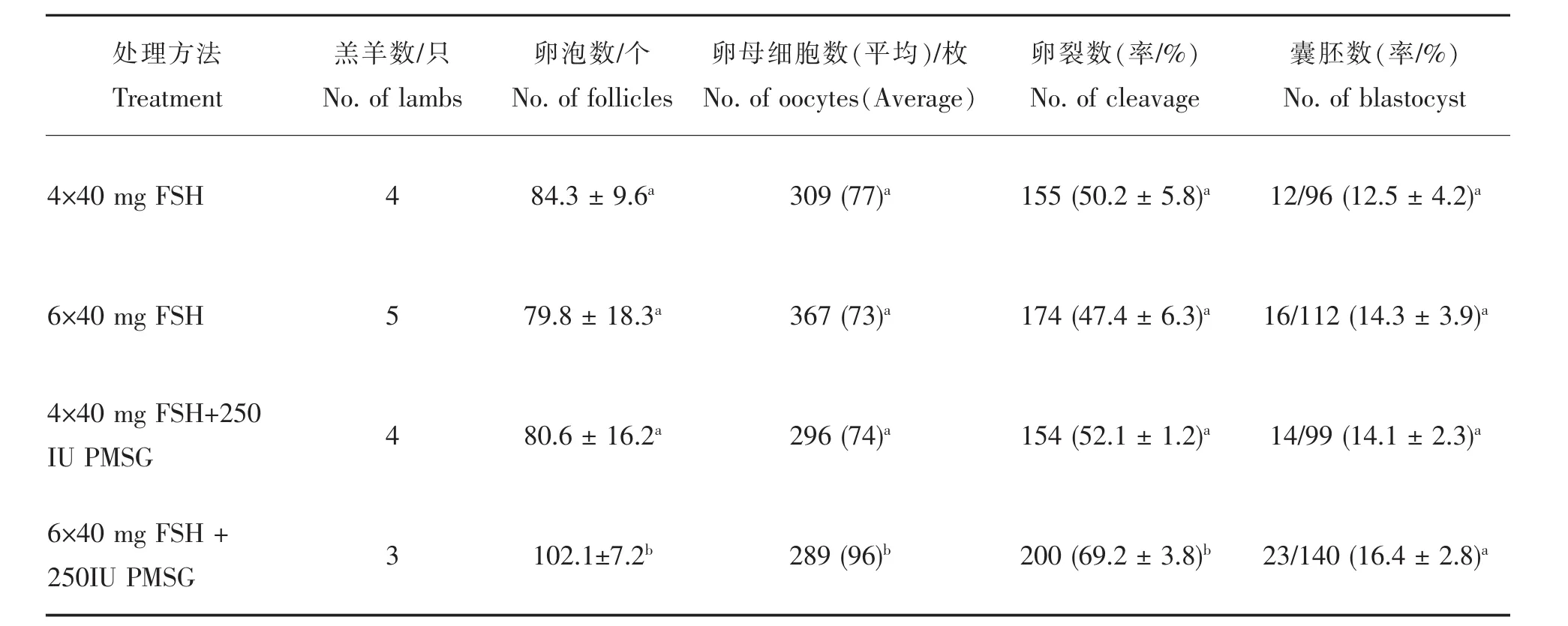
表1 供体羔羊激素处理方案的比较
2.2 羔羊卵母细胞体外成熟体系的研究
以常规卵母细胞体外成熟24 h(标准)、26 h和28 h为对照组,研究了200 nM CNP预孵育羔羊COCs 4 h,然后体外成熟24 h、26 h和28 h受精胚胎发育能力。如表2所示,200 nM CNP预孵育4 h然后体外成熟26 h的卵母细胞体外受精胚胎的卵裂率和囊胚形成显著优于常规成熟组和其他实验组卵母细胞(P<0.05)。200 nM CNP预孵育COCs 4 h,然后体外成熟28 h后的卵裂率和囊胚率显著降低(P <0.05)。

表2 CNP预处理对羔羊体外受精胚胎发育能力的影响
2.3 幼畜体外胚胎移植效果
2016-2018年通过处理共计28只海南黑山羊羔羊进行幼畜体外胚胎移植,获得可用胚胎1 257枚,平均每只羔羊获得可用胚胎44枚,完成海南黑山羊幼畜体外胚胎移植81只,平均受胎率为37.66%,繁育健康后代35只,平均产羔率为42.9%,见表3。
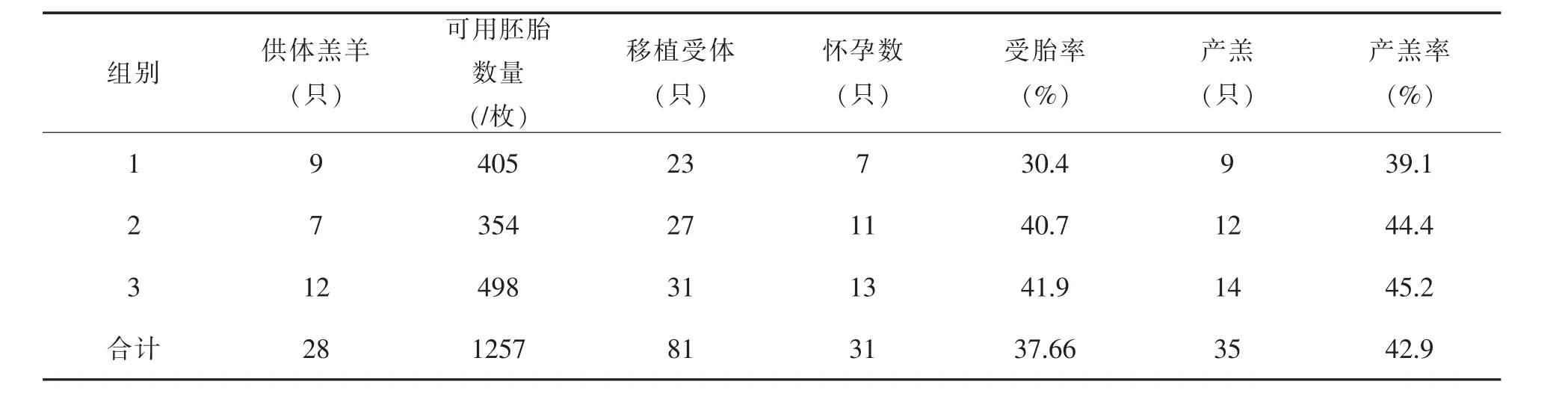
表3 海南黑山羊幼畜体外胚胎移植结果
3 讨 论
海南黑山羊具有耐高温、耐粗饲、抗病力强、肉品质好等优点,是中国热带地区规模化、集约化、产业化养殖宝贵的优良山羊品种资源,也是我国黑山羊重要的遗传资源[8]。随着肉羊产业结构的调整以及胚胎体外繁育技术的发展,高效快繁技术是加速品种改良进程,提高良种化种群的有效手段。幼畜体外生产胚胎生产技术体系作为一种高效良种快繁技术之一,尽管在国内外应用该技术获得了健康后代,但幼畜诱导卵泡效果不稳定、胚胎产出效率低仍是一个普遍问题[9]。
本研究选择海南黑山羊幼羔为研究对象,利用JIVET技术生产后代,比较了不同激素处理方案诱导卵泡发育效果、羔羊卵母细胞体外成熟体系并进行了胚胎移植。结果发现,给予6×40 mg FSH等量注射,总剂量为240 mg,最后一次FSH处理时同时给予250 IU PMSG处理的羔羊,获得的卵泡数、卵母细胞数、卵母细胞体外受精后卵裂率表现最优。200 nM CNP预孵育4 h然后体外成熟26 h的卵母细胞体外受精胚胎的卵裂率和囊胚形成显著提高了羔羊卵母细胞的发育潜力,通过胚胎移植获得黑山羊健康后代35只,平均产羔率为42.9%。总之,本研究为开展海南黑山羊幼畜体外胚胎移植、提高黑山羊繁育效率奠定了基础。
幼龄羔羊卵巢内分泌调节机制并未发育完全,卵巢上储备着大量的有腔卵泡且对外源促性腺激素刺激敏感。本研究采用间隔12 h连续4次或6次肌肉注射等量FSH的方法,同时比较了最后一次注射FSH有无给予250 IU PMSG注射的效果。结果发现,总剂量240 mg FSH注射结合250 IU PMSG处理的羔羊,获得的卵泡数、卵母细胞数和卵母细胞体外受精后胚胎卵裂率效果最优。本研究结果与Kelly等[11]人在绵羊幼龄羔羊给予4×40 mg FSH等量注射,最后一针FSH同时给予PMSG处理获结果类似。因此,推断6次肌肉注射等量FSH的方法,能够刺激幼畜卵巢上排卵前卵泡生长发育成熟同时给予卵母细胞在体内卵泡微环境中足够长的在体内发育时间。此外,PMSG处理提高了卵泡发育数和体外受精后的卵裂率,这表明PMSG有着明显的促进卵泡发育、成熟的作用。
与成年羊体外胚胎生产相比,限制JIVET技术在生产实践中应用效率主要因素是羔羊卵母细胞的体外发育能力远不如成年羊[12]。在我们的研究中,采用生理性减数分裂抑制剂C型利钠肽预孵育成年羊卵丘卵母细胞复合体,然后进行第二阶段的体外成熟,构建了“双阶段”体外成熟培养体系,显著提高了卵母细胞的发育能力[7]。本研究发现,200 nM CNP预孵育4 h然后体外成熟26 h的卵母细胞体外受精胚胎获得了卵裂率和囊胚率都显著提高。Romero等[13]人在幼鼠中也发现C型利钠肽类似的作用。这些结果表明,C型利钠肽通过暂时抑制细胞核成熟进程,延长卵母细胞体外成熟时间,促进了核质同步成熟以及发育潜能的获得。
4 结 论
目前,国内外JIVET技术研究仍停留在实验阶段。本研究通过海南黑山羊胚胎移植获得了35只健康后代,平均产羔率达42.9%。与成年羊体外胚胎移植效果相比,幼龄羔羊体外胚胎产出效率低仍然是一个普遍问题。海南黑山羊JIVET技术体系仍需要科研工作者不断地摸索、改善和提高。
总之,更好地发掘、发挥海南黑山羊JIVET技术体系在繁育体系中作用,对于促进海南黑山羊良种扩繁具有重要的意义。
