超声耦合亚临界水提取螺旋藻粗蛋白及其抗氧化活性研究
2018-10-13胡双飞张学武范晓丹
胡双飞,张学武,范晓丹
(华南理工大学食品科学与工程学院,广东广州 510640)
螺旋藻,亦称“节旋藻”蓝藻门属、段殖藻目、颤藻科的低等原核生物,主要有两个品钝顶节螺旋藻(Spirulinaplatensis,S. platensis)和极大节螺旋藻(Spirulina mexima, axima)[1]。螺旋藻可食用,蛋白含量丰富高达60%~80%,营养丰富,且商业化的螺旋藻蛋白消化率>80%。因此,螺旋藻蛋白是优质生物活性肽的良好来源[2,3]。近年来,各种具有生理活性的海藻生物活性多肽的陆续发现为生物医学领域开辟了广阔前景,螺旋藻蛋白水解物和多肽的多种功能特性被广泛研究,例如:降血压[4]抗炎活性[5]、铁螯合作用[6]和抗氧化[7]等作用。
传统的海藻蛋白质提取方法处理量小、能耗高、甚至引起蛋白质的变性[8]。由此可见,制备海藻活性多肽的首要问题是如何高效获得具有生物活性功能的海藻粗蛋白质,因此,建立简单高效安全的蛋白提取方法是目前的研究热点。
亚临界水,又称高压热水、超热水或热液态水,是指在一定压力下(一般在 5~20 MPa),温度处于100 ℃以上,临界温度374 ℃以下的液态高温水,其介电常数ε由70减小至1,即其性质由强极性渐变为非极性,依据有机物相似相溶的原理可将溶质按极性由高到低提取出来。根据文献报道,利用亚临界水提取天然产物中的粗蛋白,可有效简化工艺过程、节约制备成本[9],且获得的蛋白生物活性较高,不足之处为提取率较低,而将亚临界水与其它方法耦合的研究鲜有报道。鉴于此,本文利用杨日福等[10]设计的亚临界水提取设备如图1所示,通过在提取釜添加超声探头将超声与亚临界水耦合,利用该设备直接提取螺旋藻活性蛋白,为海藻蛋白的提取开创一种高效、低耗、环保的新技术。

图1 亚临界水设备结构示意图Fig.1 Subcritical water equipment structure diagram
1 材料与方法
1.1 材料与试剂
材料:螺旋藻粉购于广西生巴达生物科技有限公司。试剂:DPPH:Sigma-Aldrich;ABTS:Sigma-Aldrich;Vc(抗坏血酸):Sigma-Aldrich;其他所用试剂均为国内分析纯。
1.2 仪器与设备
仪器:超声波破碎仪(Scientz-IID),宁波新芝;高速冷冻离心机(5415R),德国Eppendorf公司;超纯水仪(Milli-QMillipore),美国Millipore公司、上海天美科学仪器有限公司;紫外可见分光光度计 UV1800;SpectraMax® i3x连续波长多功能酶标仪,美谷分子仪器上海有限公司。
设备:自制亚临界水提取设备[8]。
1.3 实验方法
1.3.1 螺旋藻粗蛋白的制备
1.3.1.1 反复冻融与超声均质联用法[11]
基于反复冻融与超声均质联用是实验室常用的方法,故后续称之为传统的提取方法。准确称取50 g螺旋藻粉,按料液比为1:20加入超纯水,磁力搅拌30 min使其充分混溶后,放置于-20 ℃的冰箱中冷冻4 h;冷冻结束后,置于37 ℃水浴锅中解冻;反复冻融操作三次,采用均质2 min;均质结束后,以570 W的功率超声20 min;均质和超声的全过程中,样品均置于冰浴中;超声结束后,将藻液置于4 ℃、10000 r/min条件下离心,取上清液,分装冷冻,并将冻好的冰块冷冻真空干燥后,得到螺旋藻粗蛋白,注意全程避光操作。
1.3.1.2 超声耦合亚临界水设备提取法
(1)对亚临界水提取设备的改进
亚临界水提取设备提取的对象多为固体原料,由于固态基质本身属性及亚临界水高温、高压特殊条件的要求和限制,本实验室的亚临界水提取设备在提取釜中无法实现安装搅拌装置,物料大多是堆积在一起,导致传质效率低和提取过程的不均匀性,并且随装料量的增多和增加的堆积高度,这种缺陷表现的异常明显[12]。鉴于此,本文设计了亚临界水物料袋来增大物料与亚临界水接触进而提高活性物质得率,该物料袋制作方便,在提取釜中剖面结构如2~5图所示,用于直接增大物料与提取液接触面积,操作方便,有利于提高天然产物的提取率。后续实验采用改进后的物料袋来提取螺旋藻粗蛋白。
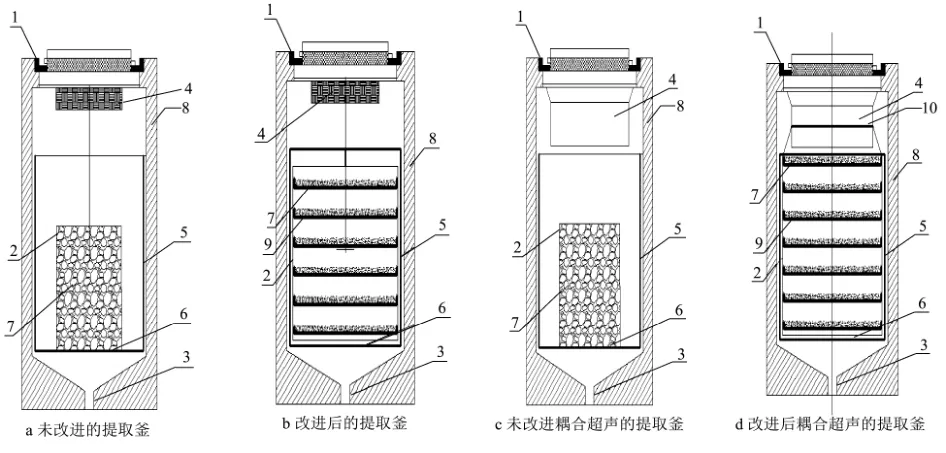
图2 改进前后的提取釜结构图Fig.2 The structure diagram of extraction kettle before and after improvement
(2)超声耦合亚临界水提取法
将事先准备好的螺旋藻粉均匀铺开在6层的支架箍的纱布层中,置于提取釜中,检查并启动设备控制去离子水以 100 mL/min的流速注入预热炉预热至80~100 ℃,通过预热炉注入到提取釜中;提取参数为:在提取温度100~160 ℃、提取压力1~20 MPa、超声功率50~300 W或不加超声的条件下,对原料进行有效成分的提取,提取时间为7.5~120 min;对原料进行有效成分的提取,当设备达到设定条件时开始计时;收集提取液。后续操作与水提相同,实验平行三次。
1.3.2 蛋白含量的测定
以GB/T 5009.5-2003为标准,采用凯氏定氮法测定螺旋藻粉中的蛋白含量。采用 BCA试剂盒测定提取物中的蛋白含量。以牛血清白蛋白为标准,通过BCA试剂盒测定粗提物中蛋白含量。由各标准曲线计算出粗提物中的蛋白含量。
将亚临界水提取得到的活性物质在分光光度计上做全波段扫描并与水提的螺旋藻作对比,主要吸收峰都在210~220 nm之间。说明提取出来的物质主要为蛋白液。采用 BCA试剂盒测定螺旋藻提取液中的蛋白含量,比较四种提取方法提取的蛋白质含量,计算方法见公式1、公式2。
1.3.3 抗氧化活性实验1.3.3.1 ABTS自由基清除活性测定[13]
ABTS使用液由 7 mM ABTS溶液和 2.45 mM K2S2O8溶液按照1:1的体积比充分混溶,避光反应12 h后生成,该溶液提前1 d制备,并且必须当天使用。使用前用PBS稀释到吸光值在732 nm处为0.70±0.02。选取96孔板测定ABTS自由基的清除率,每孔加入20 μL样品+180 μL ABTS溶液,避光反应30 min,于734 nm波长下检测样品吸光度值A样品,以相同的体积的样品代替样品提取液作为对照,其吸光值为A对照,空白孔以水代替样品,用A空白表示,以Vc为对照。ABTS自由基抑制率计算公式如下:
抑制率%=(1-(A样品-A对照)/A空白)×100%
注:A样品:样品+ABTS;A对照:样品+水;A空白:水+ABTS。
1.3.3.2 DPPH自由基清除活性测定[14]
根据本实验室建立好的方法进行活性评价,配制200 μmol/L的DPPH溶液。采用96孔板测定样品的DPPH自由基清除活性。在提前规划好的96孔板内,精确移取20 μL样品+180 μL DPPH溶液,室温下将二者混合均匀,避光放置30 min,在517 nm处测定其吸光值,用A样品表示,空白孔以无水乙醇代替样品溶液,对照组以无水乙醇代替DPPH溶液,其吸光值分别用A对照和A空白表示。以传统方法提取的螺旋藻粗蛋白与Vc做阳性对照,每个浓度重复实验3次,取平均值。
DPPH 自由基清除率%=(1-(A样品-A对照)/A空白)×100%
注:A样品:样品+DPPH;A对照:样品+乙醇;A空白:水+DPPH。
1.3.3.3 羟基自由基清除能力[15]
配置浓度为1.50 mM的硫酸亚铁,6.70 mM的双氧水与1.50 mM的水杨酸钠溶液,现配现用。将配置好的溶液按照10:3:7的比例混匀得混合液,避光保存。采用96孔板测定样品的羟基自由基清除率,加入20 μL样品+180 μL的混合液,在37 ℃条件下培养1 h。在562 nm处测吸光度。传统方法提取的螺旋藻粗蛋白与抗坏血酸做阳性对照。
抑制率%=(1-(A样品-A对照)/A空白)×100%
注:A样品:样品+混合液;A对照:样品+水;A空白:水+混合液。
1.4 数据处理和统计分析
数据处理及绘图采用origin 9.0,采用DPS软件进行统计软件方差分析对实验数据进行检验。
2 结果与分析
2.1 螺旋藻中总蛋白含量的测定
经计算凯氏定氮法测得的螺旋藻粉中的蛋白含量为75.05%。
2.2 螺旋藻的提取率
2.2.1 传统方法蛋白提取率的测定
经计算采用传统方法获得的蛋白提取率为45.76%。
2.2.2 改进前后亚临界水设备蛋白提取率的研究
对比改进前后的亚临界水设备获得蛋白的提取率,经计算得表1。


表1 四种提取方法提取的蛋白含量Table 1 Four extraction methods to extract the protein content
由表1可知:利用亚临界水提取设备提取海藻粗蛋白,在未改进设备且未超声处理的情况下提取率仅为10.30%,当增大了物料与亚临界水的接触面积,在未超声处理的情况下蛋白得率达到40.20%,近乎是未改进装置前的4倍;同样,未改进设备在设备加超声的情况下,粗蛋白得率为41.30%,但在改进设备并超声的情况下,蛋白得率为67.12%,增加近1.60倍。经对比发现增大物料与亚临界水的接触面积能让物料与亚临界水反应更加充分并显著提高蛋白得率。因此,后续操作采用改进后的设备提取螺旋藻粗蛋白。
2.2.3 不同提取时间下蛋白提取率的研究

图3 不同提取时间下蛋白提取率的研究Fig.3 The extraction rate of protein at different extraction time
由图3可知,随着提取时间的增加,蛋白质提取率显著增加,当提取时间达到60 min时提取率趋于稳定,达到30.51%。通过单因素实验的方差分析,显著水平α=0.01,故时间对螺旋藻粗蛋白提取率的影响极其显著当提取时间一定亚临界水与螺旋藻充分接触在60 min时已提取充分,在提取温度超过60 ℃时,延长提取时间并没有显著提高提取率。据文献报道,采用亚临界水从药用植物中提取大量有机化合物在40~60 min能获得较好的提取率[16~19],与我们的实验结果相符。而本实验室采用传统方法提取螺旋藻蛋白至少需要16 h才能达到45.76%。因此,该方法有效缩短了提取时间。
2.2.4 不同超声功率下蛋白的提取率
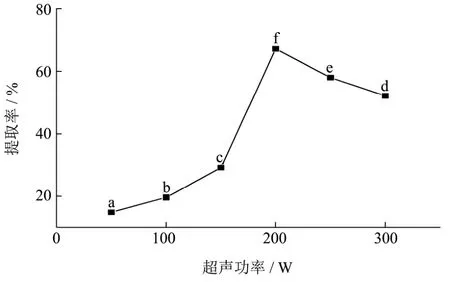
图4 不同超声功率下蛋白的提取率Fig.4 The extraction rate of protein under different ultrasonic power
由图4可知,超声功率由50 W增加至300 W,亚临界水的提取率先增加后减小,当超声功率达到200 W时,提取率最高,达到67.18%。该方法获得的提取率比未加超声时提高 25.88%,比传统方法提高21.42%。通过单因素实验的方差分析得,显著水平α=0.01,经统计推断p<0.01,故超声功率对提取率的影响极其显著。超声波在传播时可在物质介质中形成介质粒子的机械振动,这种含有能量的超声振动引起的与媒质的相互作用,可以归纳为热作用、机械振动和空化作用[20],在一定范围内,超声频率越低,空化作用越强,对细胞损伤越强。因此,在适当的超声功率范围内,该方法有效增加了提取率。
2.2.5 不同提取温度下蛋白的提取率

图5 不同提取温度下蛋白的提取率Fig.5 The extraction rate of protein under different extraction temperature
由图5可知,随着温度的上升,提取率逐渐上升,当温度达到150 ℃时,提取率趋于稳定在60%左右,通过单因素实验的方差分析得,当温度从 110 ℃到130 ℃时,提取率没有显著变化,大于130 ℃时提取率急速上升,显著水平α=0.01,经统计推断p<0.01,故温度对提取率的影响极其显著。据文献报道,对于植物和药用植物中的活性或标定化合物,亚临界水使用的提取温度对提取效率影响很大[18,21,22~27],Richter等从物理化学原理角度认为,温度越高,溶质的溶解度增加,同时扩散速率也提高,提高了溶剂分离溶质-基质的相互作用[17]。此外,水的表面张力和粘度随着温度的升高而减小,导致样品易于湿润并易于渗透[17]。通过对水温的控制,可以选择性的提取无机或有机物质、极性或非极性有机物质。因而,可以通过调节温度提取不同种类的活性成分。
2.2.6 不同提取压力下蛋白的提取率

图6 不同提取压力下蛋白的提取率Fig.6 The extraction rate of protein under different extraction pressure
由图6可知,随着压力的增加,提取率先增大后趋于稳定。通过单因素实验的方差分析得,显著水平α=0.01,经统计推断p<0.01,故压力对提取率的影响极其显著。当压力达到10 MPa时,继续升高压力提取率没有显著性变化,文献显示当将水的压力从0.10 MPa升高到10 MPa时,ε值仅提高0.37[28,29],可见压力对水作为提取剂影响较小。提高压力是为了提高水的沸点避免水汽化影响提取率,改变压力对从中草药植物中提取生物活性物质得率没有任何影响[28]。
2.2.7 正交优化螺旋藻粗蛋白的提取
在单因素实验的基础上,通过 L9(34)正交试验考察温度、超声功率、时间、压力对螺旋藻粗蛋白的提取率的影响正交实验水平因素表如表2所示。

表2 正交试验设计表(4因素3水平)Table 2 Orthogonal experimental design with 4 factor and 3 levels
由表3可知,各因素对指标影响的主次为:温度>超声功率>提取时间>压力,最佳条件为A2B2C3D2,即提取温度150 ℃、超声功率200 W、提取时间80 min、压力10 MPa。通过极差分析可以看出,第四列的极差显著低于其他列,因此可以将此列看做误差列进行其他因素的显著性检验。由表4可知,通过方差分析,提取温度和超声功率对提取率的影响都特别显著,提取压力和提取时间不显著。经验证实验得,最佳条件下提取的粗蛋白的提取率为74.32%。
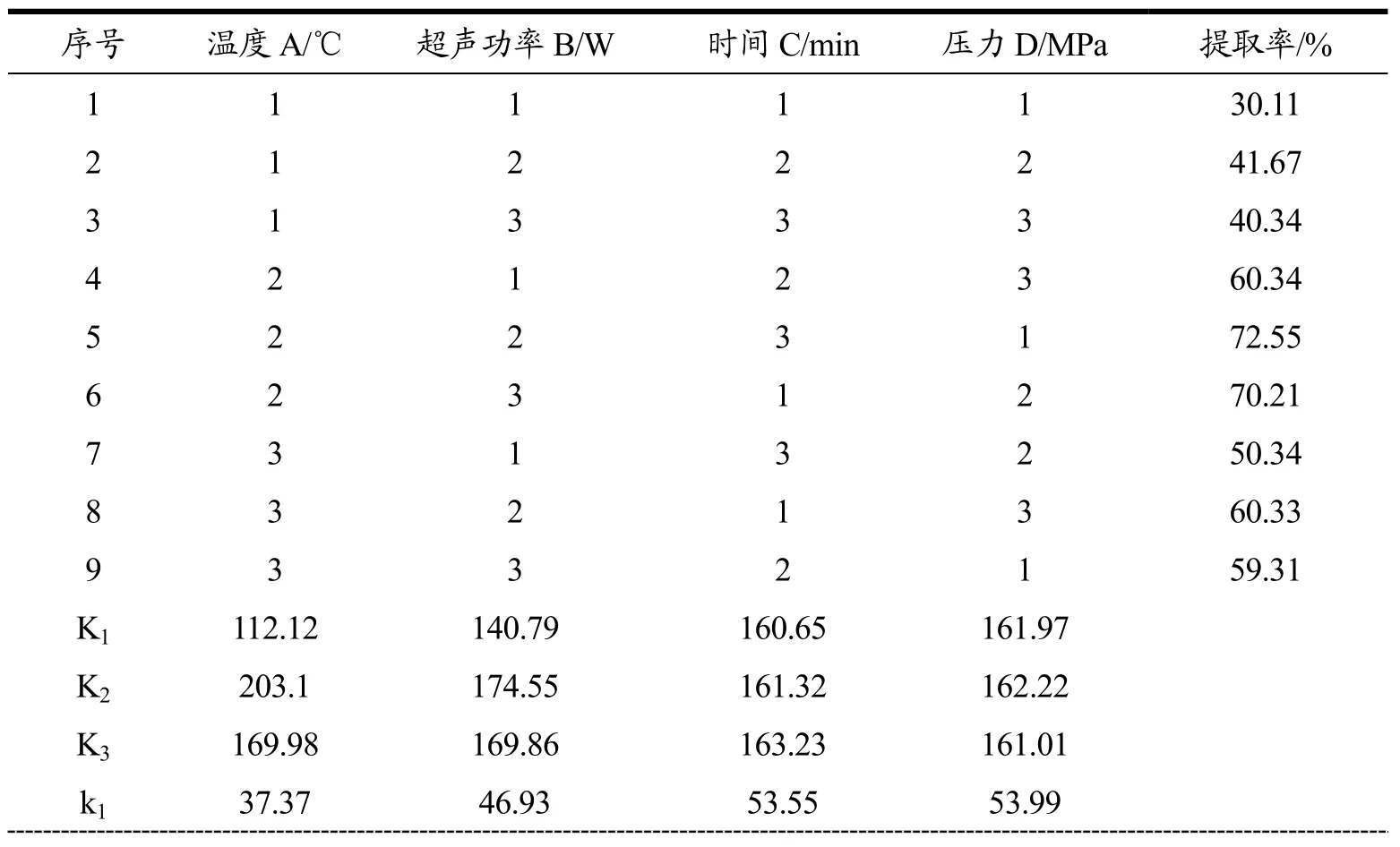
表3 正交实验设计及实验结果Table 3 Orthogonal experiment design and results

k2 67.7 58.18 53.77 54.07 k3 56.66 56.62 54.41 53.67极差R 30.32 11.25 0.86 0.40较优水平 A2 B2 C3 D2
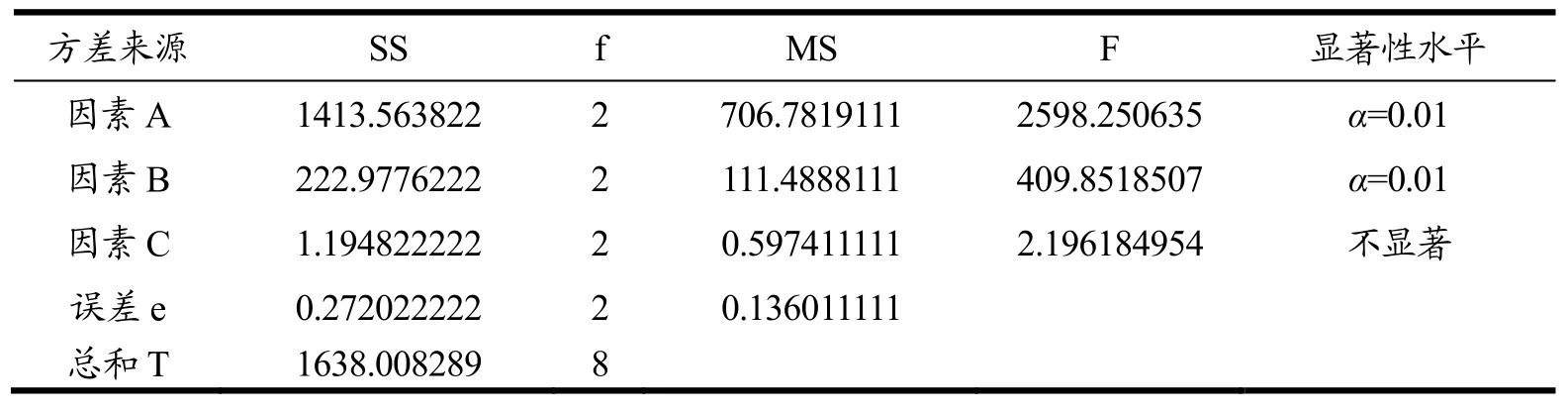
表4 正交试验结果的方差分析Table 4 Variance analysis of orthogonal test results
2.3 抗氧化活性
将采用超声耦合亚临界水从螺旋藻中提取的粗蛋白与常用的传统水提方法得到的粗蛋白做抗氧化活性对比,选用的物质浓度梯度为0.15~10 mg/mL,对其DPPH、ABTS自由基清除活性以及羟基自由基清除能力进行评价。
2.3.1 ABTS自由基清除活性

图7 螺旋藻粗蛋白的ABTS自由基清除能力Fig.7 Scavenging effects on ABTS radicals of Spirulina crude protein
由图7可知,粗蛋白在ABTS的自由基清除中,两种方法提取出来的粗蛋白自由基清除率低于Vc的自由基清除率,且在0.15~2.50 mg/mL的浓度范围内呈计量依赖性上升。当样品浓度为2.5 mg/mL时,粗蛋白对ABTS自由基清除率均大于95%,继续增加样品浓度,其ABTS自由基清除率无明显变化。通过超声耦合亚临界水在120 ℃、130 ℃、140 ℃、150 ℃下获得的粗蛋白自由基清除率明显大于传统方法提取的粗蛋白的自由基清除率,且超声耦合亚临界水获得的粗蛋白在不同的温度下,随着提取温度的上升,ABTS的自由基清除率逐渐增大。
2.3.2 DPPH自由基清除活性

图8 螺旋藻粗蛋白的DPPH自由基清除能力Fig.8 Scavenging effects on DPPH radicals of Spirulina crude protein
由图8可知,两种方法提取出来的粗蛋白的抗氧化活性低于Vc的抗氧化活性,但对DPPH自由基有一定的清除作用。当样品浓度从 0.15 mg/mL到 10 mg/mL时,传统水提取方法提出的粗蛋白的DPPH自由基清除率明显大于超声耦合亚临界水提取的粗蛋白的自由基清除率;而超声耦合亚临界水提取的粗蛋白随着提取条件中温度的升高,抗氧化活性明显增强,140 ℃、150 ℃亚临界水条件下提取的粗蛋白对DPPH自由基清除率明显高于传统水提取方法提取的粗蛋白。
2.3.3 羟基自由基清除活性
如图9所示,虽然两种方法获得的粗蛋白的羟基自由基清除率虽然低于Vc的抗氧化活性,但对羟基自由基有一定的清除作用。当样品浓度从0.15 mg/mL到10 mg/mL时,粗蛋白的清除率先增加后减小或趋于稳定,但是超声耦合亚临界水提取的螺旋藻粗蛋白的羟基自由基清除能力明显优于传统提取方法获得的粗蛋白。

图9 螺旋藻粗蛋白的羟基自由基清除能力Fig.9 Scavenging effects on hydroxyl radicals of Spirulina crude protein
3 结论
3.1 本研究采用改造后的亚临界水提取设备,以提取率为指标,通过单因素与正交试验得到提取蛋白的最优工艺条件:温度150 ℃、超声功率200 W、提取时间80 min、压力10 MPa,在此条件下蛋白的提取率为74.32%。采用ABTS、DPPH、OH自由基清除率法评价不同温度下提取的螺旋藻粗蛋白的抗氧化能力,结果显示,通过超声耦合亚临界水提取获得的粗蛋白在0.15~10 mg/mL浓度范围内均具有较强的抗氧化活性,随着提取温度的升高获得的螺旋藻粗蛋白的活性逐渐增强,且明显大于传统方法提取的粗蛋白。
3.2 综上所述,超声耦合亚临界水可有效提取螺旋藻中的蛋白,为提取海藻蛋白开创了一种高效、低耗、环保的新技术为今后制备海藻活性多肽的研究提供了理论依据和实验基础。
