樟树果实多糖对巨噬细胞RAW264.7的免疫调节作用
2018-10-13吴静胡居吾熊伟顾震王慧宾BaeYoungsoo吴磊
吴静,胡居吾,熊伟,顾震,王慧宾,Bae Young-soo,2,吴磊
(1.江西省科学院应用化学研究所,江西南昌 330096)(2.韩国江原大学森林与环境学院森林生物质材料工程,江原道春川市 200-701)
免疫调节,作为人体内的一种重要防御,在宿主防御病原体和抗原的入侵起到了重要的作用[1]。来自血单核细胞的巨噬细胞可以通过识别感染性病原体启动先天免疫应答,从而抑制多种肿瘤细胞的生长和微生物的入侵[2,3]。多糖,作为最基本的生物大分子是由单糖组成,广泛分布在动物、植物、藻类和真菌中。近年来,从天然资源中分离出的多糖已被证明具有广泛的生物特性,如抗氧化、抗癌和免疫调节活性,已广泛应用于食品和制药工业中[4~6]。很多植物多糖已被视为重要的免疫调节剂,由于其没有明显的毒副作用而且能够增强巨噬细胞的活化能力。一旦被激活,巨噬细胞可直接通过吞噬作用杀死病原体,并通过分泌一氧化氮、前列腺素 E2(PGE2)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和IL-6等炎症介质间接地杀死病原体[7]。多糖介导的免疫细胞的刺激可以通过结合巨噬细胞膜受体(PRRs)如树状细胞凝集素-1(Dectin-1)、Toll样受体(TLRs)、补体受体 3(CR3),并引发了一系列的信号转导通路包磷脂酰肌醇-3-羟激酶(PI3K)/Akt、丝裂原活化蛋白激酶(MAPK),以及转录因子如核因子(NF)-κB和激活蛋白(AP)-1[8]。
樟树(Cinnamomum camphora(L.)Presl.)又名香樟、乌樟、樟木、芳樟等,是樟科(Lauraceae)樟属(Cinnamomum)常绿高大阔叶乔木。樟树是我国重要的经济树种和绿化树种,在中国南部各省份广泛分布,江西省将其命为“省树”[9]。对该属植物化学成分研究表明多含挥发油、多酚、黄酮、瑞诺烷类二萜、鞣质、芳香性化合物、生物碱、木质素、有机酸及多糖等成分[10~12]。现代药理研究发现,樟树资源具有抑菌、消炎、止痛、抗癌、抗氧化及提高人体免疫力等药用价值[13,14]。目前,素有中国最大的香精香料基地-“金溪县”,对樟树的开发利用中,很重要的一方面是对它的芳香资源的开发利用,而对于提取后的樟树原料直接作为柴火进行焚烧,对其果实多糖的研究更是处于空白。本研究以樟树果实多糖为研究对象,在细胞和分子水平上探讨其免疫调节的潜在作用机制。为合理开发利用樟树资源提供依据。
1 材料与方法
1.1 材料与试剂
樟树果实于2017年3月上旬由江西思派思香料化工有限公司提供,江西省科学院应用化学研究所天然产物研究室李雄辉研究员鉴定为樟树(Cinnamomum camphora(L.)Presl.)的果实。
二甲基亚砜(DMSO)、脂多糖(LPS)、甲氮甲唑蓝(MTT)均购于Sigma公司;RPMI 1640培养基、抗生素、胰蛋白酶、PBS(PH 7.4)和胎牛血清均购于Gibco公司;RIPA细胞裂解液购于碧云天生物技术研究所;GAPDH、iNOS、TNF-α、COX-2引物购于武汉博士德公司;ECL增强化学发光检测试剂盒及微量 BCA蛋白定量试剂盒北京康为世纪生物科技有限公司;所需一抗购于美国Cell Signaling公司,二抗购于美国 Abcam公司;ELISA试剂盒购于 R&D Systems;聚偏二氟乙烯膜(PVDF)购于 Bio-Rad;十二烷基硫酸钠、N-1-萘乙二胺盐酸盐、对氨基苯磺酰胺、无水乙醇均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
YC-1800实验室低温喷雾干燥机,上海雅程仪器设备有限公司;H1850台式高速冷冻离心机,厦门森态仪器仪表有限公司;TD6A-WS PPR超速冷冻离心机,金坛区华城润华实验仪器厂;PCR扩增仪,ABI公司;电泳槽,Bio-Rad公司;FDU-1200冷冻干燥机,日本东京理化;Tecan infinite M200 PRO酶标仪,瑞士Tecan公司;Gel XP System伯乐凝胶成像系统,Bio-Rad公司;XD-202倒置生物显微镜,南京江南永新光学公司;Tanon5200数码凝胶图像处理系统,上海天能科技有限公司;KQ-500B超声波清洗仪,中国昆山超声仪器有限公司;TGL-16GA CO2培养箱美国Thermo公司;Nanopure超纯水系统,Millipore公司。
1.3 试验方法
1.3.1 樟树果实多糖的制备
将阴干的樟树果实粉碎(3000.00 g),以 95%乙醇超声提取3次,每次2 h,滤过,合并虑液,减压回收乙醇,去除挥发性成分。将所得到的樟树果实药渣在室温下阴干,去除乙醇残留。以蒸馏水为提取溶剂,料液比为1:50(m/V),100 ℃下热回流提取两次,每次提取2 h,离心取得上清液。将上清液进行喷雾干燥,进风口温度125 ℃,出风口温85 ℃,压强0.4 MPa得樟树果实多糖粗粉。将所得樟树果实粗多糖在热水中复溶解,溶液用 Sevag试剂[氯仿:正丁醇=5:1(V/V)]5:1除蛋白 3次,上层液体经减压浓缩去除Sevag试剂残留,加入4倍体积95%乙醇,搅拌并于4 ℃冰箱过夜,离心收集多糖沉淀。将多糖沉淀溶解于蒸馏水,透析袋透析48 h,经冷冻干燥后得到樟树果实多糖(CCFP),放入冰箱备用。多糖含量经苯酚硫酸法测定为62.36%,提取得率为3.3%。
1.3.2 细胞培养和药液配制
RAW 264.7细胞从美国典型培养物保藏中心(ATCC)购得,用RPMI 1640培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)于37 ℃、5% CO2培养箱中培养至对数生长期。将CCFP溶解于DMSO中,用RPMI 1640培养基稀释成供试液浓度,所配制的药液中DMSO含量不能超过0.1%。
1.3.3 细胞活性检测-MTT法
采用MTT法[15]检测细胞存活率。选取对数生长期 RAW 264.7 细胞,按 1×106个/mL、100 μL/孔接种于96孔板中,置于CO2培养箱培养过夜后,吸取旧培养基,加入待测药物的新培养基继续培养24 h,吸取旧培养基,于每孔中加入MTT工作液100 μL,继续孵育3 h后每孔加入MTT终止液100 μL继续培养16~20 h后,用酶标仪在550 nm处测定OD值,实验重复3次,计算细胞的相对存活率。相对细胞存活率=(实验组孔吸光值-空白组孔吸光值)/(对照组孔吸光值-空白组孔吸光值)×100%。
1.3.4 CCFP对RAW264.7细胞NO、PEG2和TNF-α分泌的影响
将密度为1×105个/mL细胞接种于96孔板中,每孔100 μL置于CO2培养箱中培养过夜,洗掉旧培养基,加入不同浓度供试药物的新培养基继续培养24 h,以加入1 μg/mL LPS处理的细胞作为阳性对照组。用Griess法[16]检测细胞上清液中NO的分泌量,按ELISA检测试剂盒操作方法测定TNF-α及PGE2的分泌量。
1.3.5 CCFP对RAW264.7细胞iNOS、COX-2及TNF-αmRNA表达的影响
将5×106个细胞放入直径为40 mm的小培养皿(4 mL的培养基)培养16 h,吸去旧培养基,加入含有100 μg/mL的CCFP分别处理10 min、60 min、180 min、360 min后收集细胞。采用Trizol法提取细胞总RNA,反转录为 cDNA,然后扩增 cDNA。引物序列和RT-RCR条件如表1所示。
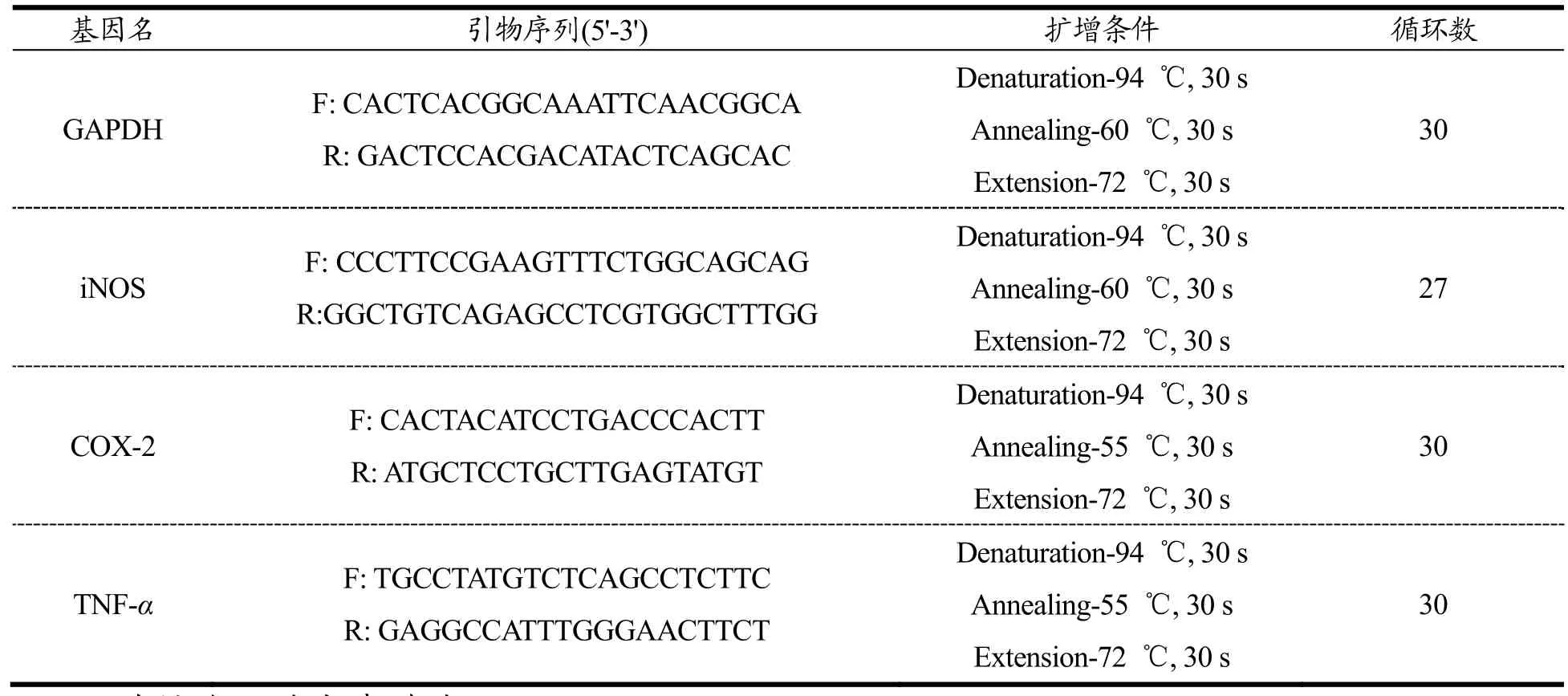
表1 引物序列及RT-PCR条件Table 1 Primer sequences and conditions for RT-PCR
1.3.6 细胞转染和荧光素酶基因测定
取对数生长期且细胞形态生长良好的 RAW264.7细胞,弃去旧培养基,加入新鲜培养基,用刮板轻轻刮下轻轻吹打至单个细胞,采用台盼蓝法在显微镜下细胞计数,按5×105个细胞数目接种于小培养皿中,置于37 ℃、5% CO2培养箱内培养24 h后,弃去上清,加入新鲜培养基细胞用Lipofectamine 3000转染试剂盒法向细胞中转染NF-κB报告基因质粒或AP-1报告基因质粒。置于37 ℃、5% CO2培养箱内培养24 h后,弃去上清,再加入不同浓度梯度的CCFP处理细胞。荧光素酶活性采用试剂盒测定。
1.3.7 Western Blot检测RAW264.7细胞因子的蛋白表达
取对数生长期RAW264.7细胞,接种5×106个细胞于直径为60 mm的4 mL培养皿中,于上述培养箱中培养 16 h。吸去旧的培养基,加入 100 μg/mL的CCFP分别处理不同的时间点后收集细胞。用RIPA裂解液法提取细胞蛋白,按 BCA试剂盒法制作标准曲线测定核蛋白浓度。移取 30 μL体系核蛋白,经SDS-PAGE凝胶电泳后,采用半干半湿法将蛋白转至PVDF膜。将转好的PVDF膜置于摇床,将膜取出,放在摇床上,1*TBS 10 mL清洗一次,10 min后倒掉,用3% BSA 5 mL室温洗膜1 h后倒掉。TTBS 10 mL洗三次,每次10 min,一抗2.5 μL与5 mL 3%BSA混合清洗1 h后回收一抗,TTBS 10 mL洗三次,每次10 min倒掉,对应二抗Rabbit/mouse 2.5 μL+5 mL 3%BSA清洗1 h后倒掉。TTBS 10 mL洗三次,每次10 min后显影。洗膜后加入辣根过氧化物酶试剂显色,将混合液滴加到PVDF膜上,用数码凝胶图像处理系统进行化学发光成像。放入暗室预设曝光时间为30 s、60 s、90 s、120 s和5 min。检测各组细胞蛋白表达水平。
1.3.8 结果分析
数据结果采用平均数±标准差(x±s)表示,各组之间的差异性采用单向方差分析通过统计软件包 SPSS 19.0版,p<0.05认为有显著性差异,p>0.05则无显著性差异。
2 结果与讨论
2.1 樟树果实多糖对炎症因子释放的影响

图1 CCFP对RAW264.7细胞存活率及炎症因子含量的影响Fig.1 The effects of CCFP on cells viability and the contents of cytokines secretion in RAW 264.7
为了研究樟树果实多糖(CCFP)对 RAW264.7细胞活性的影响,本实验采用MTT法检测CCFP一定的浓度范围内细胞的存活率。结果如图1(a)所示,在给药范围12.5~500 μg/mL内,细胞存活率所呈现的趋势与空白对照组相比基本一致,这说明CCFP在浓度12.5~500 μg/mL范围内对RAW 264.7细胞并无毒性,可进行下面的实验研究。
细胞因子是细胞间的信号分子,由免疫和非免疫细胞分泌,在免疫反应中起到重要的作用。活化的巨噬细胞能够释放大量的细胞因子,比如 NO,TNF-α和 PGE2。这些炎症因子在细胞毒性/抑制细胞生长的机制中发挥着重要的作用[17,18]。因此,我们将NO的释放水平作为免疫刺激中巨噬细胞活化的指标之一。NO的含量测定采用Griess试剂法,结果如图1(b)所示,正常组中 RAW264.7细胞只释放少量的 NO(3.12±0.12 μM),随着给药浓度的增加,RAW264.7细胞释放NO的含量逐渐增加,并呈现出浓度依赖性关系。在给药浓度为100 μg/mL时,NO的分泌量达到最大(53.53±4.25 μM)。另一方面,在给药浓度在12.5~50 μg/mL范围时,RAW264.7细胞释放NO的含量比LPS组低,说明CCFP比LPS更温和[19],适合作为免疫调节剂。
TNF-α和PGE2两个细胞因子是免疫刺激中巨噬细胞活化的另外两个指标。为进一步探讨CCFP如何作用于巨噬细胞,通过 ELISA试剂盒法检测细胞内TNF-α和PGE2细胞因子的分泌,结果如图1(c和d)所示,在测试浓度范围内,CCFP能够促进TNF-α和PGE2细胞因子的分泌,与NO分泌的结果一致都呈现出浓度依赖性关系。在给药浓度为 100 μg/mL时,TNF-α和 PGE2的分泌量达到最大,分别为1008.32±35.23 pg/mL和434.56±25.23 pg/mL。为了排除CCFP污染而引起的炎症因子释放,我们向实验组中加入内毒素B(PolyB),实验结果图1(b-d)所示,内毒素B(PolyB)能够降低LPS激活巨噬细胞产生炎症因子,而对CCFP激活巨噬细胞的炎症因子并无影响,这表明CCFP并没有污染。
2.2 CCFP对RAW264.7细胞炎症因子基因表达的影响
iNOS是重要的内源性免疫介质之一,在正常的免疫功能中起重要作用,包括巨噬细胞的活化和宿主对细胞内病原体的防御[20]。以上研究结果表明,CCFP能激活巨噬细胞分泌炎症因子,接下来我们想确定CCFP是否对巨噬细胞中COX-2、iNOS和TNF-α基因的表达有促进作用,用CCFP处理细胞10 min、30 min、60 min、180 min、360 min 后,COX-2、iNOS和TNF-α基因的表达采用RT-PCR测定,如图2所示。结果表明,CCFP能够显著诱导COX-2、iNOS和TNF-α基因的表达并呈现一定的时效关系。与此同时,研究人员[21]发现多糖可以诱导RAW264.7产生NO、PGE2和TNF-α是通过上调iNOS、COX-2和TNF-αmRNA表达来完成的,这与2.1的研究结果基本一致。以上研究表明 CCFP通过调节细胞中 COX-2、iNOS和TNF-α基因的表达来调节细胞中NO、PGE2和TNF-α的分泌量,这与Wu[22]和Shen[23]等研究的猴头菇和麸皮多糖免疫调节活性机制一致。

图2 CCFP对RAW264.7细胞炎症因子iNOS、COX-2和TNF-α基因表达的影响Fig.2 The effect of CCFP on the expression of mRNAs of iNOS,COX-2, and TNF-α in RAW 264.7 cells
2.3 CCFP对TRL4介导的信号通路的影响
NF-κB和AP-1转录因子,广泛控制着细胞内一些基因的表达包括iNOS,TNF-α和 IL-6,以及参与细胞凋亡,细胞衰老,炎症与免疫等反应过程[24]。为进一步研究NF-κB和AP-1是否与CCFP诱导巨噬细胞 COX-2、iNOS和 TNF-α基因的表达有关,在RAW264.7细胞中构建NF-κB-Luc和AP-1-Luc,采用荧光素酶报告基因检测方法考察CCFP对RAW264.7细胞中NF-κB和AP-1的表达情况。结果(图3a,b):在没有受到CCFP刺激的细胞,NF-κB和AP-1的表达量分别为1.00±0.12 和1.00±0.12,而经12.5 μg/mL,25 μg/mL,50 μg/mL,100 μg/mL 的 CCFP 处理RAW264.7细胞后,NF-κB和AP-1的表达量显著增加,分别为:6.32±1.24 和 2.34±1.45,12.45±2.56 和8.60±2.56,14.67±2.86 和 11.32±3.22,18.75±3.56 和14.56±3.78。这充分说明CCFP对巨噬细胞的激活作用是通过NF-κB和AP-1转录因子的参与。
当受到多种细胞外刺激如LPS,促炎性细胞因子和多糖时,MAPKs蛋白激酶家族将会参与发起并激活NF-κF和AP-1等转录因子活化[25]。最近研究报道,黄芪多糖、Sutherlandia frutescens多糖、灵芝多糖通过激活磷酸化MAPKs蛋白诱导细胞免疫反应[26]。

图3 CCFP对核转录因子NF-κB(a)和AP-1(b)的影响Fig.3 Effect of CCFP on the nuclear translocation of NF-κB (a)and AP-1 (b)
因此,为了解CCFP介导的巨噬细胞活化期3条关于MAPK的信号通路的蛋白表达情况。免疫印迹法检测了ERK、JNK和p38 MAPK的磷酸化水平,图4(a-b)研究结果表明,CCFP(100 μg/mL)诱导的巨噬细胞能够迅速激活p-ERK MAPKs,并呈现时间依赖性关系。而JNK,p-JNK,p-38,p-p38,ERK的表达并无变化,说明 CCFP诱导细胞活化可能和激活p-ERK MAPK蛋白信号通路有关。这与之前的报道的黄芪多糖免疫调节活性通过激活p-ERK MAPK蛋白信号通路机制一致[27]。Toll样受体(TLR)在识别病原体和激活先天免疫中起着重要的作用,TLR4是在细胞膜上最先发现的Toll蛋白,可以识别革兰氏阴性细菌脂多糖(LPS)[28],它在增强天然免疫应答和多糖诱导的细胞因子产生中起着重要作用。此外,相关研究证实天然多糖如黄精多糖[29],菌菇多糖[30],黄芪多糖[31]诱导巨噬细胞主要是通过与TLR4受体结合,更重要的是,TLR4一旦被激活,它能够促进细胞内信号通路传导从而激活相关蛋白,如 ERK、JNK和p38蛋白的激活,以及转录因子如NF-κB和AP-1的表达[32]。本研究通过免疫印迹法,对CCFP处理细胞不同时间点(5,10,30,60 min),结果如图4(c-d)所示,TLR4受体蛋白表达随着反应的进行而逐渐增强,研究结果表明TLR4受体是CCFP激活细胞的膜结合位点。同时可以说明CCFP通过与细胞膜上TLR4受体结合,向下引发一系列的级联反应,从而激活巨噬细胞,释放大量的炎症因子。

图4 CCFP对磷酸化ERK1/2,p-JNK,p38 MAPK(a)以及TLR4(b)蛋白表达的影响Fig.4 Effects of CCFP on the phospho-ERK1/2, the phospho-JNK, the phospho-p38 MAPK (a-b) and TLR4 (c-d)
3 结论
3.1 巨噬细胞是一种吞噬细胞,在先天免疫反应中起着关键作用,在宿主遇到病原微生物入侵时,巨噬细胞作为抗原提呈细胞(APC),将抗原递呈给 T淋巴
细胞,诱导适应性免疫应答。此外,巨噬细胞在胚胎发生、肿瘤发生、皮肤创伤愈合和造血等方面也发挥着重要作用[33]。因此,巨噬细胞通常作为理想的细胞模型来评估活性物质的免疫调节性能。
3.2 樟树作为江西省省树,在开发和利用上面还存在很多不足。尤其是以江西省金溪县为主,虽然目前对樟树中挥发性成分的提取和应用有了一定的规模,但对于提取后的残渣并没有物尽其用。本研究发现樟树果实多糖对RAW264.7细胞的免疫调节活性首先通过与巨噬细胞 TRL4膜受体结合,诱导下游 p-ERK MAPKs蛋白的激活,NF-κB和 AP-1转录因子以及COX-2、iNOS和TNF-α基因的表达的上调,从而释放相应的NO,TNF-α和PGE2等炎症因子。据文献可知,本研究是首次以樟树果实多糖为研究对象阐述其可能存在的免疫调节活性机制,为合理开发利用樟树资源尤其是樟树农林废弃物提供理论依据和参考。
