笃斯越橘恒温自然发酵的主要微生物初步鉴定及应用
2018-10-13隋双周赛楠王萍
隋双,周赛楠,王萍
(东北林业大学林学院,黑龙江哈尔滨 150040)
笃斯越橘(Vaccinium uliginosumL.)为杜鹃花科(Ericaceae)越橘属(Vacciniumspp.)落叶灌木,是我国重要的野生资源之一,主要分布在内蒙古、黑龙江、吉林和辽宁等地区[1,2]。它是一种果肉细腻、种子极小的小浆果,有很高的营养和保健价值[2~4]。果实不仅营养丰富,而且含有有机酸、氨基酸、花色苷等独特的功能性成分[5,6],具有防治心血管疾病、抗癌、抗衰老等多种功效[7,8]。
自然发酵(一次传统发酵)是一种古老的传统发酵方式,利用天然微生物发酵而获得最终产物[9],发酵最初的目的是储存食物、延长食物保质期,且发酵过程中依赖有益微生物的代谢产物来抑制大部分有害微生物的生长,其食用安全性得到保证。发酵后的食品中活性物质含量提高、营养成分比例得到改善、活性物质的生物活性得到提高。现在,利用果蔬通过益生菌在特定条件下发酵而成的功能性食品受到越来越多的人们认可,其发酵产生了大量的次生代谢产物,具有调理肠胃、促进消化吸收、抗氧化及提高免疫力等作用。自然发酵的过程极其复杂,在发酵过程中进行代谢的微生物种类繁多,研究证明发酵过程中的主要微生物包括乳酸菌类、醋酸菌及各类酵母等[10,11],目前并未见到关于笃斯越橘自然发酵微生物组成的报道。
本人所研究的笃斯越橘自然发酵的结果表明,其发酵液中的活性物质含量及抗氧化能力显著升高(p<0.01),促使这些变化的主要是发酵液中的微生物,笃斯越橘自然发酵液是一个复杂的混合菌系,本文旨在探究笃斯越橘自然发酵液的主要微生物组成,并通过形态学鉴定、生理生化鉴定分析出所分离菌株的种类,并将笃斯越橘自然发酵液这一混合菌系作为初始发酵种子应用于笃斯越橘人工发酵基质,探究其发酵过程中活性物质及抗氧化能力变化,将笃斯越橘自然发酵应用于人工接种发酵,将两者建立联系,为笃斯越橘发酵工艺提供一种新思路。
1 材料与方法
1.1 材料与试剂
试验样品,以笃斯越橘为原料,选用市面常见白砂糖为碳源,使用前将白砂糖紫外杀菌30 min,在无菌条件下向已灭菌的玻璃瓶中,按质量比1:4的比例加入已破碎的笃斯越橘和无菌饮用水,以及加糖量分别为 15%,20%,25%的白砂糖,将玻璃瓶封口,于恒温培养箱25 ℃避光发酵60 d。
笃斯越橘,黑龙江省大兴安岭;白砂糖,市售;脱氧核糖、2-硫代巴比妥酸、TPTZ,上海源叶生物科技有限公司;其他试剂均为分析纯或生物制剂。
1.2 主要仪器
DH6000A型电热恒温培养箱,天津市泰斯特仪器有限公司;5030-PVL高压灭菌锅,长春百奥生物仪器有限公司;PB-10酸度计,德国Sartorius公司;WYT-4型手持糖度计,泉州中友仪器有限公司。
1.3 主要培养基
平板计数琼脂(PCA)、紫红胆盐葡萄糖琼脂培养基(VPBG)、MRS培养基、GY培养基、酵母膏麦芽培养基、真菌分离培养基(PDA)、细菌分离培养基(LB)、真菌鉴定及保藏培养基(CA)。
1.4 试验方法
1.4.1 笃斯越橘恒温自然发酵液微生物组成分析
取适量恒温自然发酵的笃斯越橘发酵液,无菌生理盐水进行梯度稀释后用平板计数法培养。分别用平板计数琼脂(PCA)、紫红胆盐葡萄糖琼脂培养基(VPBG)、MRS培养基、GY培养基、酵母膏麦芽培养基分别增补250 mg/L金霉素和259 mg/L氯霉素计数总需氧菌数、大肠杆菌、乳酸菌、醋酸菌、酵母菌和霉菌。
1.4.2 笃斯越橘恒温自然发酵液微生物的分离与纯化
取1 mL恒温自然发酵的笃斯越橘发酵液于9 mL无菌生理盐水中,震荡摇匀后用生理盐水进行梯度稀释,取适宜浓度分别涂布于PDA及LB培养基上,分别于28 ℃及37 ℃倒置培养后,挑取不同形态的菌体作平板划线纯化,将纯化单一的菌体分别接种于 CA及MRS的斜面培养基上,于4 ℃保藏备用。
1.4.3 菌种初步分析
1.4.3.1 形态学及显微形态观察
将分离所得微生物接种于对应的培养基上培养,对培养好的微生物进行菌落形态和显微镜观察并记录。
1.4.3.2 生理生化分析
(1)真菌的生理生化分析
分别进行碳源利用试验、氮源利用试验和糖发酵试验[12]。
(2)细菌的生理生化分析
分别进行革兰氏染色、过氧化氢酶试验、葡萄糖产酸产气试验、淀粉水解试验、硝酸盐还原试验、明胶液化试验和碳源利用试验[13,14]。
1.4.4 笃斯越橘恒温自然发酵液作为发酵种子的应用
1.4.4.1 种子发酵基质的制备
取笃斯越橘:无菌水(m/m)=1:6进行打浆,加入白砂糖调整发酵基质的初始糖度为15 °Bx,加入1 M小苏打水溶液调整发酵基质的初始pH值至4.80,进行巴氏杀菌(70 ℃,30 min)后及时冷却至室温备用。
1.4.4.2 接种发酵
取加糖量15%组的笃斯越橘恒温25 ℃发酵50 d的发酵液接入已灭菌的种子发酵基质,接种量均为6%,置于恒温培养箱37 ℃培养10 d,每隔1 d取样测定pH值、还原糖含量、蛋白质含量、总多酚含量、总黄酮含量、花色苷含量、原花青素含量、·OH清除率、总抗氧化能力。
1.4.5 测定方法
pH:pH计法测定。蛋白质含量:考马斯亮蓝G-250法测定[15]。还原糖含量:DNS法测定[16]。总酚含量:福林酚法测定[17]。黄酮含量:根据文献[18]的方法,略有改动。原花青素含量:采用香草醛-硫酸法测定[19]。花色苷含量:采用pH示差法[20]测定。·OH清除率:采用硫代巴比妥酸法(TBARS)测定,试验方法参照文献[20]并作适当修改,用稀释 10倍的发酵液进行测定。总抗氧化能力:采用铁离子还原/抗氧化力测定法(FRAP)测定,试验方法参照文献[21]。乙醇含量的测定:采用重铬酸钾-DNS比色法测定发酵液中的乙醇含量[22]。
1.5 数据分析
2 结果与讨论
2.1 笃斯越橘恒温自然发酵液微生物组成分析
2.1.1 发酵过程中总需氧菌落数的变化
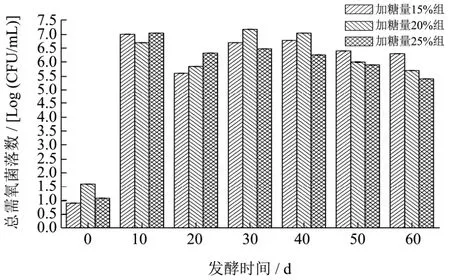
图1 恒温发酵过程中总需氧菌落数变化Fig.1 Changes in total aerobic colonies during constant temperature fermentation
笃斯越橘恒温发酵过程中总需氧菌落数的变化趋势如图1所示。从图1可以看出,三组发酵物的总需氧菌落数在0~10 d内显著升高(p<0.01),加糖量15%组的总需氧菌落数由0.90 Log(CFU/mL)升至7.00 Log(CFU/mL),加糖量20%组的总需氧菌落数由1.60 Log(CFU/mL)升至6.70 Log(CFU/mL),加糖量 25%组的总需氧菌落数由1.07 Log(CFU/mL)升至7.04 Log(CFU/mL)。发酵50 d之后,三组发酵物的总需氧菌落数数量级均达到106CFU/mL左右,分别为6.40 Log(CFU/mL)、6.00 Log(CFU/mL)、5.90 Log(CFU/mL)。发酵至60 d时,三组发酵物的总需氧菌落数略有降低。
2.1.2 发酵过程中大肠杆菌菌落数的变化
使用平板计数法监测0 d、10 d、20 d、30 d、40 d、50 d、60 d发酵液中的大肠杆菌菌落数,其结果均为0 CFU/mL,结果表明发酵液中不存在大肠杆菌。
2.1.3 发酵过程中乳酸菌活菌数的变化

图2 恒温发酵过程中乳酸菌活菌数变化Fig.2 Changes in viable count of lactobacillus during constant temperature fermentation
笃斯越橘恒温发酵过程中乳酸菌活菌数的变化趋势如图2所示。从图2可以看出,三组发酵物的乳酸菌活菌数在发酵0~12 d显著升高(p<0.01),加糖量15%组的乳酸菌活菌数由 1.30 Log(CFU/mL)升至7.00 Log(CFU/mL),加糖量20%组的乳酸菌活菌数由1.26 Log(CFU/mL)升至6.81 Log(CFU/mL),加糖量25%组的乳酸菌活菌数由1.30 Log(CFU/mL)升至6.95 Log(CFU/mL),这段时间为乳酸菌生长的对数期;在12~50 d内趋于平稳,此时为乳酸菌生长的稳定期,发酵至50 d时,乳酸菌活菌数的数量级达106CFU/mL左右,分别为6.47 Log(CFU/mL)、6.11 Log(CFU/mL)、5.95 Log(CFU/mL)。发酵50 d内,活菌数并未显著降低,说明此时乳酸菌并未走向衰落期。
2.1.4 发酵过程中醋酸菌菌落数的变化
笃斯越橘恒温发酵过程中醋酸菌活菌数的变化趋势如图3所示。从图3可以看出,三组发酵物的醋酸菌菌落数在0~10 d内显著升高(p<0.01),加糖量15%组的醋酸菌菌落数由1.98 Log(CFU/mL)升至6.75 Log(CFU/mL),加糖量20%组的醋酸菌菌落数由1.90 Log(CFU/mL)升至 7.04 Log(CFU/mL),加糖量 25%组的醋酸菌菌落数由2.01 Log(CFU/mL)升至6.38 Log(CFU/mL)。发酵50 d之后,三组发酵物的醋酸菌菌落数数量级均达到106CFU/mL左右,分别为6.18 Log(CFU/mL)、5.85 Log(CFU/mL)、5.70 Log(CFU/mL)。发酵至60 d时,三组发酵物的醋酸菌菌落数略有降低。
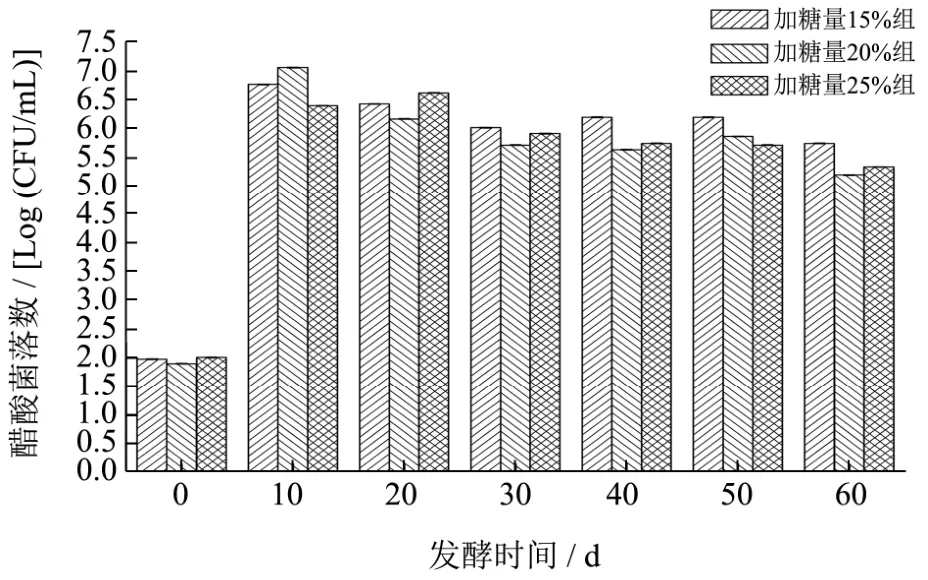
图3 恒温发酵过程中醋酸菌菌落数变化Fig.3 Changes in viable count of acetic acid bacteria during constant temperature fermentation
2.1.5 发酵过程中酵母菌菌落数的变化

图4 恒温发酵过程中酵母菌菌落数变化Fig.4 Changes in viable count of yeast during constant temperature fermentation
笃斯越橘恒温发酵过程中酵母菌菌落数的变化趋势如图4所示。从图4可以看出,三组发酵物的酵母菌菌落数在0~30 d内显著升高(p<0.01),加糖量15%组的酵母菌菌落数由2.94 Log(CFU/mL)升至5.60 Log(CFU/mL),加糖量20%组的酵母菌菌落数由2.67 Log(CFU/mL)升至 5.48 Log(CFU/mL),加糖量 25%组的酵母菌菌落数由3.12 Log(CFU/mL)升至6.23 Log(CFU/mL)。发酵50 d之后,三组发酵物的酵母菌菌落数数量级均达到106CFU/mL左右,分别为6.28 Log(CFU/mL)、6.04 Log(CFU/mL)、5.90 Log(CFU/mL)。发酵至60 d时,三组发酵物的酵母菌菌落数略有降低。
2.1.6 发酵过程中霉菌菌落数的变化

图5 恒温发酵过程中霉菌菌落数变化Fig.5 Changes in viable count of mold during constant temperature fermentation
笃斯越橘恒温发酵过程中霉菌菌落数的变化趋势如图5所示。从图5可以看出,三组发酵物的霉菌菌落数在0~30 d内显著升高(p<0.01)加糖量15%组的霉菌菌落数由 2.88 Log(CFU/mL)升至 5.78 Log(CFU/mL),加糖量20%组的霉菌菌落数由2.95 Log(CFU/mL)升至5.60 Log(CFU/mL),加糖量25%组的霉菌菌落数由3.42 Log(CFU/mL)升至6.52 Log(CFU/mL)。发酵50 d之后,三组发酵物的霉菌菌落数数量级均达到106CFU/mL左右,分别为6.26 Log(CFU/mL)、6.08 Log(CFU/mL)、6.00 Log(CFU/mL)。发酵至60 d时,三组发酵物的霉菌菌落数略有降低。
2.1.7 起始发酵种子的确定

表1 笃斯越橘自然发酵液各菌落数统计Table 1 Quantitative statistics of the number of colonies in naturally fermented Vaccinium uliginosum L.
发酵至50 d时,三组发酵物的各菌落数统计结果见表1。由表1可知,加糖量15%组的笃斯越橘恒温自然发酵液中的各菌落数显著高于其余两组(p<0.05),其中乳酸菌、醋酸菌、酵母菌及霉菌的活菌数数量级均在高于106CFU/mL,分别为(6.47±0.02)LogCFU/mL、(6.18±0.01)LogCFU/mL、(6.28±0.02)LogCFU/mL、(6.26±0.01)LogCFU/mL,选择加糖量15%组的笃斯越橘恒温自然发酵液为起始发酵种子。
2.2 笃斯越橘恒温自然发酵液中分离菌株的形态学鉴定
笃斯越橘自然发酵液中分离所得菌株的形态学特征见表2。

表2 笃斯越橘自然发酵液中分离所得菌株的形态学特征Table 2 Morphological characteristics of the strains isolated from naturally fermented Vaccinium uliginosum L.
根据表2,由菌落形态可知,菌株A系列的菌落湿润,圆形,经染色观察为革兰氏阳性菌,菌体呈球形、卵圆形或短杆状,单个、成对或成链存在;菌株B系列的菌落圆形,表面光滑湿润,颜色呈乳白色,表面凸起,有淡香味,经显微镜观察为细胞圆形。参照《伯杰氏系统细菌学手册》、《酵母菌的特征与鉴定手册》和《真菌鉴定手册》,初步认为菌株A系列为细菌,菌株B系列为酵母菌。对分离所得的菌株进行生理生化鉴定,进一步确定其分类地位。
2.3 笃斯越橘恒温自然发酵液中分离菌株的生理生化鉴定
2.3.1 细菌的生理生化鉴定
以A1、A2菌株为代表菌株,其生理生化的鉴定结果见表3。

表3 细菌的生理生化鉴定结果Table 3 Physiological and biochemical identification of bacteria
由表3可知,菌株A1、A2革兰氏染色均为阳性,葡萄糖产酸为阳性,均发酵葡萄糖、蔗糖、乳糖、麦芽糖、纤维二糖和甘露醇,菌株A1还发酵阿拉伯糖和山梨醇。
参照《伯杰氏系统细菌学手册》[12],初步认为菌株A1为乳杆菌属,菌株A2为链球菌属。
2.3.2 酵母菌的生理生化鉴定
以B1菌株为代表菌株,其生理生化鉴定结果见表4、表5。
由表4、5可知,菌株B1同化乙醇、棉子糖、乳糖,不同化麦芽糖、淀粉、D-木糖,在单一氮源培养基中不同化硝酸钠和亚硝酸铵。菌株B1发酵乳糖、蔗糖、棉子糖、葡萄糖、半乳糖和麦芽糖,不发酵蜜二糖和海藻糖。参照《酵母菌的特征与鉴定手册》[13]和《真菌鉴定手册》[14],认为菌株B1为克鲁维酵母属。
2.4 笃斯越橘恒温自然发酵液作为发酵种子的应用结果

表4 酵母菌碳源利用试验及氮源利用试验结果Table 4 Results of carbon and nitrogen assimilation tests for yeasts

表5 酵母菌糖发酵鉴定结果Table 5 Results of carbohydrate fermentation tests for yeasts
2.4.1 种子发酵过程中基本成分的变化
笃斯越橘种子发酵过程中基本成分的变化如图 6所示。

图6 种子发酵过程中基本成分的变化Fig.6 Changes in the basic ingredients during seed fermentation
由图6可知,在发酵过程中pH值随发酵时间持续降低,pH由4.8降至2.79,发酵过程中产生有机酸,有机酸含量增高造成较低的pH环境,酸性环境可以有效抑制致病菌生长,提高食品安全性,还可以为花
色苷的稳定提供酸性环境;还原糖含量随发酵时间在不断地波动上升与下降,整体呈下降趋势,这是由于所添加的白砂糖主要成分是蔗糖,蔗糖是二糖,属于非还原性糖,微生物需要先利用体系中的还原糖,待还原糖消耗之后,微生物产生的酶促使蔗糖分解成单糖,继续被微生物消耗利用,说明发酵过程中微生物在不断地利用还原糖用于代谢与生长,发酵10 d时还原糖含量降至(106.98±1.43)mg/mL;蛋白质含量随发酵时间波动变化,蛋白质含量增加是由于微生物生长代谢过程中合成了蛋白质或者微生物对笃斯越橘的分解利用使笃斯越橘中的蛋白质逐渐溶解,并释放到发酵液中,从而使发酵液的可溶性蛋白含量增加,蛋白质含量降低是由于发酵液中的微生物利用蛋白质用于代谢与生长,发酵 10 d时蛋白质含量为(0.3053±0.0015)mg/mL。
2.4.2 种子发酵过程中活性成分变化
笃斯越橘种子发酵过程中基本成分的变化如图 7所示。


图7 种子发酵过程中活性成分的变化Fig.7 Changes in the active substance during seed fermentation
由图 7可知,总酚含量随发酵时间显著升高(p<0.01),发酵8 d时总酚含量提高了38.10%。黄酮含量0~3 d显著升高(p<0.01),发酵3 d时达到最大值,提高了9.27%,发酵8 d时黄酮含量提高了5.69%。花色苷含量随发酵时间波动下降后波动上升,发酵8 d花色苷含量下降了30.22%,发酵至9 d时花色苷含量又显著升高(p<0.01)。原花青素含量随发酵时间波动下降,在0~1 d内显著下降(p<0.01),发酵至8 d时原花青素含量下降了31.26%。Filannino等[23]探讨了乳酸菌发酵樱桃汁和花椰菜浓浆混合物的过程,描述了发酵过程中酚类物质的转化规律,指出乳酸菌在代谢过程中将分子较大的酚类物质水解成小分子酚类,酚类物质含量增加,这说明笃斯越橘恒温自然发酵液这一混合菌系作为起始发酵种子,其中乳酸菌的存在是总酚含量增加的主要原因;Ekinci等[24]研究了自然发酵黑胡萝卜汁的化学及生物特性,发现发酵前后花色苷含量下降,原花青素含量增加,认为发酵前后花色苷含量变化可能是由于发酵过程中微生物菌群合成的酶类与酚类化合物之间发生了复杂的相互作用,使酚类物质的结构有所改变,这间接解释了种子发酵前期总酚含量的增加而花色苷含量降低;Escudero-López[25]等选用毕赤克鲁维酵母对橙汁进行发酵,比较了发酵前后几种功能性物质的含量,发现酒精发酵后橙汁中黄酮含量增加,而酚类物质在酒精发酵过程中可能与酵母或酵母代谢产生的蛋白质吸附或结合而有所损失,相关性分析表明抗氧化能力的提高与黄酮含量增加有关,这说明种子发酵前期0~3 d酒精发酵(酵母发酵)占主导,黄酮含量显著提高(p<0.01),后期3~8 d乳酸发酵占主导,使得总酚含量显著增加(p<0.01),发酵第8 d,发酵液的pH已降至2.80以下,这将为花色苷提供稳定的酸性环境,使得花色苷含量在8~9 d有所升高。
2.4.3 种子发酵过程中抗氧化能力变化

图8 种子发酵过程中抗氧化能力的变化Fig.8 Changes in the antioxidant capacity during seed fermentation
笃斯越橘发酵过程中抗氧化能力的变化如图8所示。由图8可知,发酵0~2 d,稀释10倍发酵液的·OH清除率随发酵时间显著升高(p<0.01),·OH清除率提高了3.74%,2~10 d随发酵时间波动变化;总抗氧化能力0~9 d随发酵时间显著升高(p<0.01),总抗氧化能力提高了39.22%。发酵过程中酚类化合物及黄酮类化合物的大量增加是抗氧化能力增强的主要原因。果蔬中的抗氧化成分主要有多酚类、类胡萝卜素、花色苷和生育酚等成分,酚类化合物大多可以作为还原剂、金属螯合剂、单线态氧猝灭剂和氢供体在体系中来发挥抗氧化功能[26]。许多种果蔬发酵食品的抗氧化性都是由于高浓度的多酚类化合物的存在,有报告指出果酒类和果醋类的抗氧化性能都与总酚含量高度相关[27]。然而Naczk等[28]指出从果蔬发酵液中的提取的总酚并不能很好的预测其总抗氧化活性,说明多酚类物质或其他成分与抗氧化能力之间存在协同关系。因此发酵后抗氧化性能的提高可能受到微生物种类、发酵pH、发酵温度、发酵时间、原料种类以及氧气含量等多方面因素的影响。Marazz等[29]指出乳酸菌代谢过程中产生β-葡萄糖苷酶等可以使复杂的酚类化合物水解、异黄酮含量增加,而且乳酸菌本身可以作为金属螯合剂发挥抗氧化功能。酵母菌作为真菌类在生长繁殖过程中不仅会产生相关的酶类还会积累较多的蛋白质、氨基酸和肽类。许多氨基酸和活性肽类具有金属螯合作用及自由基清除作用,在体系中发挥其抗氧化活性[30]。
因此作为起始发酵种子的笃斯越橘发酵液,其中的乳酸菌及酵母菌的存在是抗氧化能力提高的关键,而醋酸菌的存在使得发酵风味得到改善。
2.4.4 抗氧化能力阳性对照结果
抗氧化能力阳性对照结果如表6。由表6可以看出,种子发酵液的抗氧化能力显著高于阳性对照组(p<0.01)。稀释10倍的种子发酵液的·OH清除率显著高于2 mg/mL Vc的·OH清除率(p<0.01),种子发酵液的总抗氧化能力显著高于0.25 mg/mL Trolox的总抗氧化能力(p<0.01)。

表6 抗氧化能力阳性对照结果Table 6 Results of positive control for antioxidant capacity
3 结论
本文首先探究了笃斯越橘恒温自然发酵液的微生物组成,其中主要微生物有乳酸菌、酵母菌、醋酸菌及霉菌;为了进一步确定发酵液中的微生物区系,使用平板分离技术对发酵液中的微生物进行分离与纯化,对分离菌株进行形态学鉴定及生理生化鉴定,得出菌株A1、A2为乳酸菌,其中菌株A1为乳杆菌属,菌株A2为链球菌属;菌株B1为酵母菌,菌株B1为克鲁维酵母属。笃斯越橘恒温自然发酵液是一个混合菌系,将其作为起始发酵种子接种于已灭菌的笃斯越橘人工发酵基质进行发酵,探究其基本成分、活性成分及抗氧化能力随发酵时间的变化,试验结果表明,总酚及黄酮含量对比发酵前分别提高了 38.10%、5.69%,花色苷及原花青素含量对比发酵前分别降低了30.22%、31.26%,·OH清除率及总抗氧化能力对比发酵前分别提高了3.74%、39.22%。种子发酵液的抗氧化能力显著高于阳性对照组(p<0.01)。种子发酵液的·OH清除率显著高于程勇杰[31]等人所研究的蓝莓酵素产品(p<0.01)。种子发酵终产物的乙醇含量为0.98%,为低醇发酵物。
