转录因子MSN2基因过表达对酿酒酵母耐受性的影响
2018-10-13李潇董胜胜付肖蒙王鹏飞董健
李潇,董胜胜,付肖蒙,王鹏飞,董健
(天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457)
酵母多数普遍存在于富含糖类的环境中,例如水果(苹果、葡萄和桃子等)、蔬菜、花蜜和植物分泌物(如仙人掌的汁液)中,以及果园和部分富含石油的土壤中。目前最常见且应用最为广泛的酵母菌种当属酿酒酵母(Saccharomyces cerevisiae)。
Ras-cAMP信号通路对酵母细胞的胁迫抗性具有很大的调节作用,MSN2基因属于Ras-cAMP信号通路中的压力调控因子,Ras-cAMP信号通路活性的提高就会抑制一些与压力响应元件相关基因的表达,其中转录因子MSN2对压力响应元件相关的一些基因的表达是必须的,是Ras-cAMP信号通路抑制压力响应相关基因表达的靶标[1]。
MSN2是锌指蛋白,在对温度敏感型snf1突变株多拷贝抑制物进行分离的过程中得到MSN2基因[2]。Msn2p和Msn4p这两个反式作用元件在STRE介导的基因表达方面发挥作用。转录因子Msn2p及其同系物Msn4p与STRE结合,在营养饥饿、热休克、氧化应激、DNA损伤和渗透休克似乎介导基因激活[3]。当MSN4过量表达时可以像MSN2一样抑制突变snf1的热敏性[4]。MSN2和MSN4在压力条件下调节大约200个基因的表达。这两个蛋白有41%的一致性,在大小和氨基酸序列上很相似,虽然这两个基因的单缺失菌株没有明显的表型特征,但是双缺失的菌株对碳源饥饿、热击、渗透压及氧化压力条件都有超级敏感性,而过量表达这两个基因能降低对饥饿和热击的敏感度[5,6]。
以实验室现有菌株AY12a为出发菌株,通过使用胞内同源重组方法过表达MSN2基因,具体内容如下:
以实验室菌株AY12a为出发菌株,通过胞内同源重组法,以URA3基因作为筛选标记,将PGK1p启动子插入MSN2基因的 N端,经醋酸锂化转,抗性板SD筛选正确转化子,通过PCR验证获得过表达基因的a型(基因型为AY12a-msn2)。从生长性能,高温、15%(V/V)乙醇的耐受性、6%NaCl和 5%乙酸等指标考察突变株AY12a-msn2的综合耐受性的改变,同时将突变株与出发菌株进行玉米高温浓醪发酵实验,并测定发酵完成后的酒度、残糖、48 h细胞存活率、CO2失重和发酵时间。比较突变株及亲本菌株的发酵性能,研究过表达基因对酿酒酵母浓醪发酵性能的影响。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验菌株
酿酒酵母(Saccharomyces cerevisiae)AY12a-msn2:本实验室培育;酿酒酵母(Saccharomyces cerevisiae)AY12a:本实验室保存。
1.1.2 主要试剂
酵母浸粉(生化试剂),北京奥博星生物技术有限公司;葡萄糖(分析纯),天津市永大化学试剂开发中心;琼脂粉(生化试剂),Solarbio公司;胰蛋白胨(生化试剂),天津市英博生化试剂有限公司;氯化钠(分析纯),天津市北方化玻购销中心;DL5000 DNA Marker(生化试剂),TaKaRa公司;RNA提取试剂盒及荧光定量PCR试剂盒,宝生物工程(大连)有限公司。
1.1.3 仪器
台式离心机 T gL-16C,上海安亭科技仪器厂;Bioscreen C全自动生长曲线分析仪,芬兰Oy Growth Curves Ab公司;UVmini-1240岛津紫外分光光度计,岛津仪器(苏州)有限公司。
IS-RDS3恒温摇床,上海制成仪器制品有限公司;AB204-S型分析天平,梅特勒-托利多仪器上海公司;HS-1300-V型超净台,苏州安泰空气技术有限公司;AgilentGC 7890,StepOnePlus™实时荧光定量PCR仪,Biometra公司。
1.1.4 主要培养基
(1)YEPD培养基
葡萄糖2%,蛋白胨2%,酵母浸粉1%,pH自然,115 ℃灭菌20 min。
固体培养基需再添加2%琼脂粉。
(2)耐盐培养基(m/V):
葡萄糖2%,蛋白胨2%,酵母浸粉1%,NaCl 6%,115 ℃灭菌15 min。
(3)耐酒精培养基(m/V):
葡萄糖2%,蛋白胨2%,酵母浸粉1%,115 ℃灭菌15 min,待冷却至室温,加入15%Vol的无水乙醇。
(4)耐乙酸培养基(m/V):
葡萄糖2%,蛋白胨2%,酵母膏1%,115 ℃灭菌15 min,待冷却至室温,加入5%的乙酸。
1.2 实验方法
1.2.1 菌株的构建
1.2.1.1 引物的设计与合成
根据NCBI中GenBank报道的S. cerevisiae S288C菌株的MSN2和URA3基因序列设计PCR反应的上下游引物,用以构建敲除和验证敲除基因的菌株,同时用以构建过表达和验证过表达基因的菌株。三引物用来验证菌株的单双倍体,文中所有用到的引物序列如表1所示。
1.2.1.2 酵母基因组的提取
取新鲜酵母液体培养物,离心收集菌体,提取其基因组DNA,作为PCR的模板,进行琼脂糖凝胶电泳检测。
1.2.1.3 过表达基因酿酒酵母突变株的构建
本文研究以MSN2基因作为靶基因,野生型酿酒酵母工业菌株AY12a为亲本菌株,URA3基因为筛选标记,在MSN2基因的N端加入强启动子PGK1p,以实现MSN2基因的过表达。构建过程示意图如图1所示。

表1 PCR引物设计Table 1 PCR primer design

图1 过表达MSN2基因的流程图Fig.1 Overexpression of MSN2 gene flow chart
1.2.1.4 目的片段的扩增
以亲本菌株AY12a为模板,利用引物对MSN2上同源臂 U和MSN2上同源臂 D、MSN2-URA3U和MSN2-URA3D、MSN2-PGK1PU 和MSN2-PGK1PD、MSN2下同源臂U和MSN2下同源臂D进行PCR扩增带有部分同源的四个基因片段。
1.2.2 突变株的获得
用酵母醋酸锂转化法[7]将得到的四个目的基因片段化转入原菌AY12a内,得到过表达后的AY12a-msn2菌株。
1.2.3 Real-Time PCR
酵母RNA的提取及RNA的反转录均按照产品说明书进行操作,使用 SYBR® Premix Ex TaqTMII(TaKaRa)试剂盒进行实时荧光定量PCR,通过ΔΔC(t)值法对目的基因及内参基因ACT1进行基因表达量的分析。
1.2.4 突变株AY12a-msn2耐受性的测定
1.2.4.1 酿酒酵母细胞生长曲线的测定
本实验采用全自动生长曲线测定仪测定OD600吸光值,操作步骤如下:
(1)挑取斜面菌种1环接至5 mL YEPD液体培养基中,30 ℃,180 r/min培养12 h。
(2)吸取上述培养好的菌液40 μL接入装有360 μL液体YEPD培养基的100孔板的孔中,将100孔板置于设定的温度下培养,以YEPD液体培养基为空白对照,每隔0.5 h测定600 nm处的吸光值,以时间为横坐标,OD600值为纵坐标,绘制生长曲线图。
1.2.4.2 酿酒酵母细胞耐受性的测定[8]
(1)从斜面挑取一环酵母菌泥,接入5 mL YEPD液体培养基中,30 ℃,180 r/min过夜培养。测OD600值,取适量菌液转接入5 mL新鲜YEPD液体培养基中,使其初始OD600值为0.15。
(2)将上述细胞培养4~6 h至生长对数期。测量OD600值,用 YEPD液体培养基调整所有细胞OD600=1,以保证所有细胞初始菌体浓度一致。
(3)移液枪分别移取100 μL的菌液于1.5 mL离心管中,实验组做在55 ℃水浴4 min热击处理,对照组不做任何处理。
(4)将实验组和对照组分别用无菌水稀释相同的浓度梯度,按照浓度递减的顺序,每个稀释度取2 μL的菌液整齐的滴于YEPD固体培养基平板上,超净台晾干后,封口膜封好倒置于 30 ℃恒温培养箱中培养1~3 d,观察菌体的生长,比较不同菌株的耐热情况。
(5)移取2 μL对照组的菌液整齐的滴于含有6%NaCl的YEPD培养基平板上,超净台晾干后,封口膜封好倒置于30 ℃恒温培养箱中培养1~3 d,观察菌体生长,比较不同菌株的耐盐性情况。
(6)移取 2 μL对照组的菌液整齐的滴于含有15%(V/V)的乙醇的YEPD培养基平板上,超净台晾干后,封口膜封好倒置于30 ℃恒温培养箱中培养1~3 d,观察菌体生长,比较不同菌株的耐乙醇情况。
(7)移取2 μL对照组的菌液整齐的滴于含有5%(V/V)的乙酸的 YEPD培养基平板上,超净台晾干后,封口膜封好倒置于30 ℃恒温培养箱中培养1~3 d,观察菌体生长,比较不同菌株的耐乙酸性情况。
1.2.4.3 高温浓醪酒精发酵酒精浓度的测定
利用酒精比重计(标温20 ℃)来对酒精产量进行测定。
准确量取100 mL发酵液加入1 L蒸馏瓶中,加入100 mL蒸馏水后放置于蒸馏装置上进行蒸馏,保持冷却水开启,用100 mL容量瓶收集馏出液,定容至100 mL,混匀后将其倒入100 mL量筒中,用酒精计(标温20 ℃)测酒精度,同时测量温度,最后换算成20 ℃时的酒精度。
1.2.4.4 还原糖的测定
使用斐林试剂法[9]对发酵完成后的还原糖进行滴定。
(1)斐林试剂的标定
吸取斐林试剂甲、乙液各5 mL,置于250 mL三角瓶中,准确加入20 mL空白液(蒸馏水),并用滴定管预先加入适量的0.1%标准葡萄糖溶液,使后面滴定时消耗标准葡萄糖溶液的量控制在1 mL以内,摇匀。待加热至沸腾后,立即用0.1%标准葡萄糖溶液滴定至蓝色消失,此滴定操作需在1 min内完成,记下滴定葡萄糖溶液的体积Vo。
(2)预实验
同上吸取斐林试剂甲、乙液各5 mL,20 mL自来水,置入250 mL三角瓶中,加入体积为V1mL试样稀释液和适量的0.1%标准葡萄糖溶液,摇匀后滴定,以下同标定时操作,总耗糖量为V2mL。
(3)正式测定
吸取斐林试剂甲乙液各5 mL,20 mL自来水,置于250 mL三角瓶中,加入V1mL试样稀释液及(V2-V1)mL 0.1%标准葡萄糖溶液,摇匀滴定,以下同标定时操作,总耗糖量为VmL。按式1计算还原糖的浓度。

式中:V-斐林试剂测定值(mL);V0-斐林试剂标定值(mL);V1-所取试样稀释液体积(mL);C-标准葡萄糖溶液浓度(g/mL);n-试样稀释倍数。
1.2.4.5 细胞存活率的测定
次甲基蓝是一种生物燃料,可鉴别细胞的死活。当酵母细胞浸于次甲基蓝溶液时,色素渗入细胞内,活细胞内的还原酶能使其脱色,但死细胞内的还原酶由于失活,不发生脱色作用,故被染成蓝色。
当发酵进行至48 h,将发酵液摇匀,吸取样液2 mL,过3层纱布以滤去玉米残渣,用5 mL无菌水洗涤滤布上的残渣,将菌液稀释至合适梯度,取100 μL稀释后的菌液与900 μL的次甲基蓝染色剂混合均匀,静置5 min以充分染色,移液枪吸取100 μL加入到血球计数板(填满血球计数板)即可,在显微镜下观察数菌,按式2计算酿酒酵母发酵48 h后的细胞存活率。

式中:X-酿酒酵母发酵48 h后细胞存活率,%;C1-血球计数板中经过次甲基蓝染色剂染色后着色的细胞数;C2-血球计数板中全部的细胞数。
1.2.5 玉米原料高温浓醪酒精发酵[10~12]
(1)玉米水解液的制备
称取1500 g的玉米粉,加入4500 mL 65 ℃~70 ℃的自来水,静置放置20 min,使玉米颗粒充分吸水膨胀。加入液化酶(α-淀粉酶)0.9 mL,于85 ℃~90 ℃下液化1.5 h,期间前30 min不断搅拌,使得玉米粉充分溶解。液化完成后转入60 ℃水浴锅中,并加入3 mL糖化酶,在55 ℃~60 ℃下糖化20 h。糖化完成后,将糖化液用四层滤布过滤,得到澄清滤液,分装,高压蒸汽灭菌105 ℃,时间20 min,即为玉米水解液,pH自然。
(2)种子培养基的配制
一级种子培养基:8 Bix°的玉米水解液,添加0.5%的酵母浸粉,每支试管分装5 mL,105 ℃灭菌20 min,待液体凉透,分别接入一环菌,30 ℃恒温静置培养24 h。
二级种子培养基:12 Bix°的玉米水解液,添加0.5%的酵母浸粉,每个锥形瓶分装45 mL,105 ℃灭菌20 min,将一级种子液全部倒入100 mL锥形瓶,30 ℃恒温静置培养16 h。
(3)同步糖化玉米原料高温浓醪酒精发酵
称取100 g玉米粉于事先洗净、干燥且称重的500 mL三角瓶中,加入200 g 60 ℃~70 ℃的自来水和0.2 mL的淀粉酶,调节pH至5.5~5.8,搅拌均匀,沸水浴液化,料液温度达到90 ℃开始计时液化90 min,液化过程中不断搅拌,液化结果以碘试无蓝色且呈红棕色为准。液化完成后冷却至38 ℃左右,调节pH至4.2~4.4,加入0.2 mL的糖化酶,0.36 g尿素,15 mL二级种子液,搅拌均匀,并用35 ℃左右的自来水补足液化过程中损失的水,将发酵瓶用普通封口膜封好,再加一层PE手套,橡皮筋缠紧,30 ℃,160 r/min条件下培养12 h,后转入38 ℃,160 r/min条件下进行摇床发酵。在此过程中,每隔12 h称重一次,两次差值小于1 g即可蒸酒。待发酵48 h,测48 h细胞存活率,且此时将发酵温度改为30 ℃。
1.2.6 数据统计分析
每组实验做三个平行,并使用 SPSS 11.5和EXCEL 2013软件对实验数据进行差异显著性检验分析(ANOVA)。
2 结果与讨论
2.1 目的片段扩增验证

图2 带有同源臂的MSN2片段扩增验证Fig.2 Verification of MSN2 fragment amplification with homologous arm
以亲本菌株AY12a为模板,利用引物对MSN2上同源臂 U和MSN2上同源臂 D、MSN2-URA3U和MSN2-URA3D、MSN2-PGK1PU 和MSN2-PGK1PD、MSN2下同源臂U和MSN2下同源臂D进行PCR扩增带有部分同源的四个基因片段,其片段长度大小如下图2所示。与预期片段大小一致,可用于下一步实验。
2.2 突变株获得的验证
精提阴性对照 AY12a基因组及粗提基因组验证正确的菌株基因组,分别利用验证引物进行验证。利用引物对验证MSN2上同源臂-URA3U和验证MSN2上同源臂-URA3D、验证PGK1p-MSN2U和验证PGK1P-MSN2D、验证URA3-PGK1PU-MSN2和验证URA3-PGK1PD-MSN2进行过表达MSN2基因菌株进行定点验证,MSN2基因扩增出大小为1126 bp、3006 bp、1433 bp的特异性片段,与预期大小一致,且阴性对照PCR后无此条带,结果如图3所示。
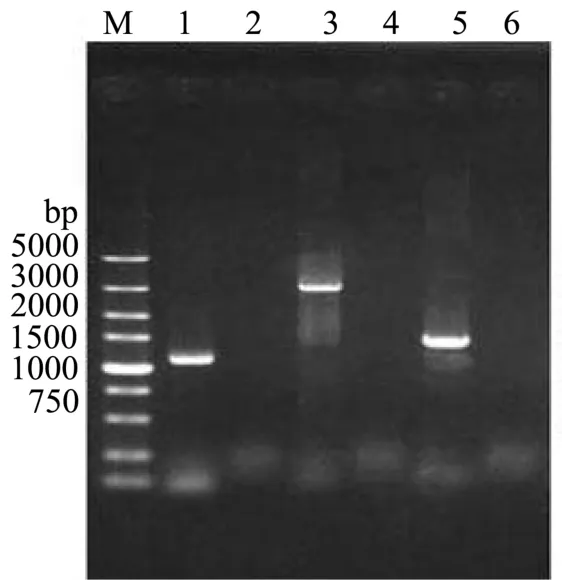
图3 定点PCR验证MSN2电泳图谱Fig.3 Verified MSN2 by PCR using specific primers
2.3 RT-PCR结果
为了进一步验证MSN2基因过表达成功,提取重组菌AY12a-msn2及亲本菌株AY12a的总RNA并反转录成cDNA,按照方法1.2.3以其为模板进行实时荧光定量PCR对MSN2基因表达量进行分析。从图4结果看出AY12a-msn2菌株MSN2基因的表达量是亲本菌株AY12a的4.43倍,结果差异显著(p<0.05)。实验结果表明过表达MSN2基因后,导致其转录水平的增加,RT-qPCR结果能够说明MSN2基因过表达成功。
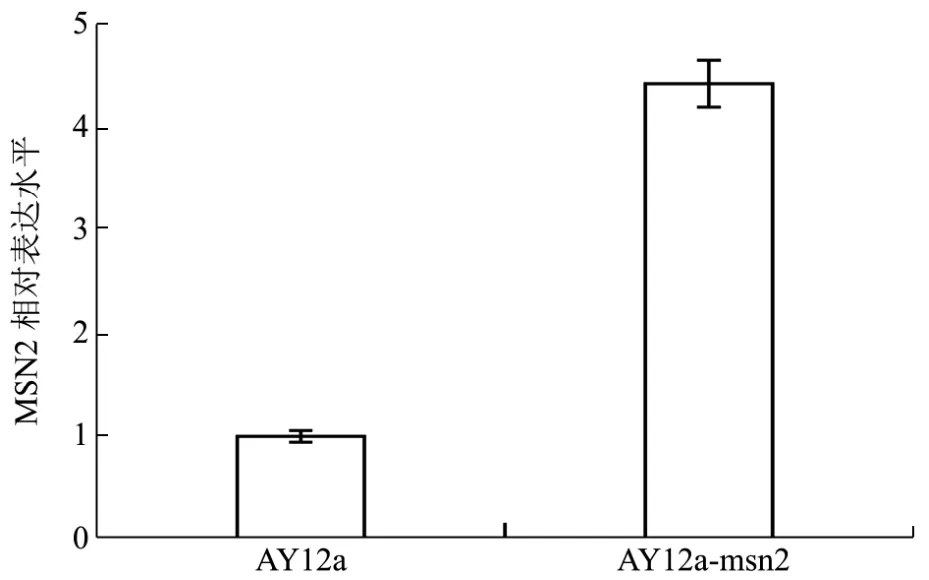
图4 AY12a和AY12a-msn2中的MSN2基因相对表达水平的比较Fig.4 Comparison of relative expression levels of MSN2 gene in AY12a and AY12a-msn2
2.4 酿酒酵母基因突变株与亲本菌株生长性能的比较

图5 菌株的生长曲线Fig.5 Growth curve of strains
利用生长曲线测定仪对亲本菌株 AY12a和AY12a-msn2突变菌株在进行生长曲线的测定。挑取一环AY12a和AY12a-msn2菌泥接种于5 mL YPED液体培养基中,过夜培养后,按照1.2.4.1方法对亲本菌株和突变株在30 ℃和40 ℃下进行生长曲线的测定,结果如图5所示。
图5是亲本菌株和各个突变株的生长趋势。根据各个菌株的生长速度和最终菌体浓度可以看出,在30 ℃的培养条件下AY12a-msn2与亲本菌株AY12a的生长速度相比,生长性能基本相一致;当生长温度改为40 ℃时,高温对突变株AY12a-msn2的生长影响较大,较亲本菌株AY12a菌体浓度没有明显的提高,且生长对数期延长。具体的生长情况需要用玉米高温浓醪发酵验证。
2.5 酿酒酵母基因突变株与亲本菌株耐受性的比较

图6 菌株的耐受性Fig.6 Stress tolerance of strains
按照材料与方法中1.2.4.2中所描述的方法测定出发菌株AY12a以及突变菌株AY12a-msn2在55 ℃(4 min)热击、15%(V/V)的乙醇、6%的NaCl及5%(V/V)乙酸的胁迫环境下进行耐受性分析。结果如图6所示。
根据图6可知,在没有生长压力的YEPD平板上,出发菌株AY12a和突变株AY12a-msn2的生长情况基本上是一致的,可见用做耐受性实验的出发菌株以及突变菌株的初始菌体浓度基本上保持是一致的。在55 ℃(4 min)热击处理造成的环境压力下,出发菌株 AY12a和突变菌株的生长都受到了很大程度的抑制。但相比出发菌株,在相同的稀释倍数下,AY12a-msn2比AY12a的菌落数较少,说明其热击抗性弱于出发菌株AY12a;在15%(V/V)的乙醇和6%的NaCl造成的环境压力下,相同的稀释倍数下,AY12a-msn2突变株的菌落数低于原菌;在 5%(V/V)乙酸造成的环境压力下,相比出发菌株AY12a,突变菌株 AY12a-msn2没有较大的变化说明 5%(V/V)的乙酸对这些突变株的生长没有胁迫性。
2.6 酿酒酵母基因突变株与亲本菌株的玉米原料高温浓醪酒精发酵
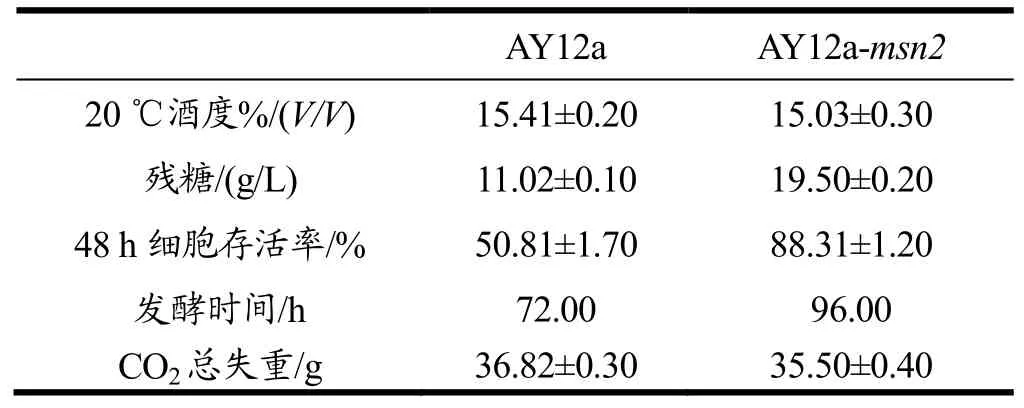
表2 突变菌株的发酵性能和细胞存活率Table 2 Fermentation performance and survival ratios of mutant strains
按照方法1.2.4,将改造后的菌株AY12a-msn2和出发菌株AY12a进行玉米高温浓醪发酵。待发酵进行48 h后,将发酵液摇匀,取样液,用三层纱布滤去玉米渣,用无菌水稀释至合适倍数,按照方法1.2.4.5进行次甲基蓝染色后,放大倍数×400显微镜下检测48 h细胞存活率。待发酵完成后,按照方法1.2.4.3测定发酵液中乙醇含量,按照方法1.2.4.4测定发酵液中残糖的含量。结果如表2所示。
由表 2可知,在 38 ℃浓醪发酵中,突变株AY12a-msn2的酒度相比出发菌株AY12a有所下降,残糖含量明显上升,48 h主发酵完成后的细胞存活率有较大提高,且发酵时间延长。这与细胞生长曲线的测定结果是一致的,且与耐受性实验也大致相符。酵母细胞发酵时间的延长,常伴随着细胞耐受性的增加,比如高乙醇,高温,高渗透压等等,但 AY12a-msn2突变株没有取得预期的效果。
2.7 小结
本实验以MSN2基因为靶基因,酿酒酵母AY12a作为出发菌株,通过胞内重组法,在MSN2基因的N端加上一个强启动子PGK1p,从而实现基因的过表达,今而调控细胞耐受性,获得突变株AY12a-msn2。
酿酒酵母菌株的生长性能分析结果显示,突变株AY12a-msn2在40 ℃的生长条件下,生长趋势明显慢于AY12a且最终的AY12a-msn2细胞浓度低于AY12a。酿酒酵母菌株的胁迫环境耐受性能分析结果显示,相比出发菌株AY12a,耐温性的结果显示为AY12a-msn2较弱。38 ℃下的玉米浓醪发酵结果表明突变株AY12a-msn2的乙醇产量下降,与理论不相一致,可能与基因的遗传背景和个体差异有关。
3 结论
3.1 本文以实验室现有菌种 AY12a为出发菌株,URA3基因为筛选标记,利用胞内重组法来实现MSN2基因的过表达,成功构建过表达MSN2基因的突变菌株AY12a-msn2。
3.2 对突变株AY12a-msn2进行耐受性的测定,发现突变株AY12a-msn2表现出较差的耐高温性。同时将突变株与出发菌株 AY12a进行玉米原料高温浓醪发酵实验,并测定发酵完成后的各个参数。突变株AY12a-msn2的乙醇含量较出发菌株下降,残糖含量增加,且其发酵时间延长。
