水溶性铜卟啉配合物的合成、与DNA的相互作用及抗肿瘤活性
2018-10-12哈斯其美格陈丽华肖朝虎
哈斯其美格 陈丽华 肖朝虎
(西北民族大学实验中心,兰州 730030)
0 引 言
自顺铂作为抗癌药物问世后,金属配合物与DNA相互作用的研究一直是生物无机化学的重要课题[1-4]。最早用于治疗癌症和艾滋病的药物是一些通过与DNA结合进而干扰DNA复制、转录与表达的药物,且药物与DNA的作用机制有利于药物设计的靶向性[5]。因此,设计合成活性较高、毒副作用较低的抗肿瘤药物分子,关键在于研究药物分子与DNA的相互作用。通过研究药物分子与DNA相互作用,有利于了解药物作用机理,进行药物体外筛选,以及利用药物构效关系进行药物结构改造,设计活性更高、毒副作用更低的新药物分子。
卟啉及金属卟啉类化合物是一种重要而特殊的物质,具有独特的生物活性。如光合作用中的关键物质叶绿素(含镁的卟啉化合物)、促进骨髓造血的血红素(含铁的卟啉化合物)等都广泛存在于自然界和生物体中[6]。近年来,卟啉类化合物因其结构的特异性,被广泛的应用于各个领域如医学、生物化学、材料化学等,尤其是其医学方面的研究已成为当今的热门课题,涉及的领域包括如研发抗病毒试剂、DNA/RNA选择性切割试剂、端链酶抑制剂及研究DNA足迹法、DNA/RNA杂交的稳定等[7-9];又如利用其光敏性、实现光动学治疗或利用其对肿瘤细胞的特殊亲和性和选择性富集的特点,实现抗肿瘤作用等[10-13]。但由于卟啉化合物具有较大的刚性空间构型,其在水中的溶解度几乎为零,这大大限制了卟啉化合物在医学方面的应用。而吡啶基、磺酸基、氨基、羧基等大极性基团具有良好的水溶性,可以通过将卟啉环与大极性基团结合在一起,获得相应的水溶性卟啉及金属卟啉[14-17]。水溶性卟啉及金属卟啉被认为是具有“双重作用”的化合物,其原因在于水溶性卟啉化合物一方面能与带有负电荷的水溶性DNA稳定结合,另一方面可利用其光活性裂解DNA。因此,对水溶性卟啉及金属卟啉与DNA相互作用及其抗肿瘤活性的研究,将有助于更深入了解DNA的结构和功能,有助于水溶性卟啉及金属卟啉在医学上的应用,如PDT、癌症检测、人造核酸酶、抑制病毒等[18-20];对认识很多疾病的治疗机制和药物的设计也起到非常重要的作用。
本文合成了3种A3B型水溶性含溴铜卟啉(CuP-1)及其溴取代衍生物(CuP-2、CuP-3),并对其结构进行了表征。采用紫外光谱法、EB-DNA荧光淬灭法、粘度法以及圆二色谱法等光谱手段研究了它们与小牛胸腺DNA(CT-DNA)的相互作用。采用噻唑兰(MTT)法,以人成纤维细胞为正常细胞系,评价了CuP-1、CuP-2和CuP-3在不同浓度、不同作用时间下,对宫颈癌细胞(Hela)和乳腺癌细胞(MDA)2种肿瘤细胞株的抗肿瘤活性。以期为研究和开发疗效更高、毒副作用小的具有抗肿瘤活性的卟啉类药物提供一定的实验基础。
1 实验部分
1.1 试剂和仪器
所用试剂均为分析纯,N,N-二甲基甲酰胺(DMF)使用前用CaH2回流除水,然后减压蒸馏备用。吡咯使用前重蒸。除非另有说明,其余试剂在使用前均不做任何处理。CT-DNA购自Sigma公司,溴化乙锭(EB),三羟甲基甲胺(Tris)等均购自上海生工生物工程公司。胎牛血清购自GIBCO公司,DEME购自Hyclone公司。
仪器包括核磁共振仪 (MERCRY Plus 400)、质谱仪(Bruker Esquire 6000)、紫外光谱仪(UV-2550)、荧光光谱仪(RF-5301PC)、粘度计(UbbeloMe)、圆二色谱仪(J-810)、CO2培养箱(Thermo)、酶标仪(THERMO MultisKan FC)等。
1.2 合成及表征
1.2.1 5,10,15-三(4-吡啶)-20-(4-对溴)苯基卟啉的合成
称取1.85 g(0.01mol)对溴苯甲醛于500 mL三口烧瓶中,加入150mL丙酸,加热并搅拌。当油浴温度达到130℃左右时,快速加入2.7mL(0.03mol)4-吡啶甲醛,再用滴液漏斗缓慢滴加溶解在10mL丙酸中的新蒸吡咯2.6 mL(0.04 mol),10 min内加完。溶液逐渐变为棕黑色,保持高速搅拌,140℃继续回流2 h。反应结束,减压蒸馏,蒸去丙酸,得到深紫色的粗产物。将深紫色粗产物溶于二氯甲烷中,用饱和碳酸氢钠中和,有机相以无水硫酸钠干燥,浓缩。用硅胶(200~300目)作固定相,二氯甲烷和石油醚混合液(1∶1,V/V)作流动相,不同体积比的二氯甲烷和乙酸乙酯的混合液做洗脱剂进行柱层析分离纯化,收集第 5色带,减压旋蒸,真空干燥,即得紫色目标产物 5,10,15-三(4-吡啶)-20-(4-对溴)苯基卟啉,产率:4%。1H NMR(400MHz,CDCl3)δ8.99(d,6H),8.79~8.60(m,8H),8.19(m,6H),8.07(m,2H),7.83(d,2H),-3.00(s,2H)。质谱 m/z:698.331 0,[M+H]+。 元素 分 析 按 C41H26BrN7计 算 值 (%):C,70.69% ;H,3.76%;N,14.08%。 实验值(%):C,70.63%;H,3.78%;N,13.98%。
1.2.2 CuP-1的合成
称取 100mg(0.14mmol)5,10,15-三(4-吡啶)-20-(4-对溴)苯基卟啉于50mL三口烧瓶中,加入5 mL无水DMF,磁力搅拌使其溶解。氩气保护、避光的条件下,将1 mL碘甲烷(过量)加到上述溶液中,继续避光、通氮气,40℃加热搅拌反应3 h。反应完毕停止加热,冷却至室温,缓慢滴加丙酮,析出沉淀、过滤,滤饼反复用三氯甲烷洗涤、真空干燥,得到5,10,15-三甲基吡啶基-20-(4-对溴)苯基卟啉,产率:89%。1H NMR(400 MHz,CDCl3)δ9.51(s,6H),9.01(m,12H),8.09(m,2H),7.83(d,2H),4.59(s,8H),-3.00(s,2H)。 质谱 m/z:742.060 7,[M-3I]+。元素分析按C44H35BrI3N7计 算 值 (%):C,47.08% ;H,3.14% ;N,8.74%。实验值(%):C,47.05%;H,3.16%;N,8.75%。
称取 100 mg(0.13 mmol)5,10,15-三甲基吡啶基-20-(4-对溴)苯基卟啉溶于5 mL无水DMF中,加入3 mL溶有89 mg(0.52 mmol)氯化铜的无水甲醇溶液,65℃搅拌反应5 h。反应完毕,减压蒸去甲醇,滴加丙酮,析出沉淀、过滤,滤饼反复用三氯甲烷洗涤、真空干燥,得到目标产物CuP-1,产率:75%。1H NMR(600 MHz,DMSO) δ9.32(m,6H),8.09(m,6H),7.27~7.55(m,4H),6.68(d,2H),4.50(s,5H),3.56(s,9H)。ESI-MS:质谱 m/z:803.033 4,[M-3Cl]+。 元素分析 按 C44H33BrCl3CuN7计 算 值 (%):C,58.10% ;H,3.66%;N,10.78%。 实验值(%):C,58.03%;H,3.70%;N,10.88%。UV-Vis(Tris-HCl buffer,pH=7.2)λmax/nm(absorbance)=424.5(1.579),549.5(0.198),584(0.09)。

图1 CuP-1、CuP-2及CuP-3的合成路线Fig.1 Synthesis routes for CuP-1,CuP-2 and CuP-3
1.2.3 CuP-2或CuP-3的合成
氩气保护下,将100 mg(0.13 mmol)CuP-1溶于30mL无水DMF中,依次加入33mg(0.2mmol)咔唑或 29 mg(0.2 mmol)2-(咪唑-2-基)吡啶,84 mg(0.26 mmol)碳酸铯,5 mg(0.026 mmol)碘化亚铜和5.5 mg(0.13mmol)无水氯化锂,于140℃回流反应72 h。反应结束,冷却至室温,滴加三氯甲烷,析出沉淀、过滤,滤饼反复用三氯甲烷洗涤、真空干燥,得到目标产物 CuP-2或 CuP-3,产率:43%(CuP-2)或 37%(CuP-3)。
CuP-2:1H NMR(600MHz,DMSO)δ9.12(m,6H),8.30(m,6H),8.06 ~7.10(m,6H),4.49(s,6H),3.30(s,9H)。 质谱 m/z:888.293 6,[M-3Cl]+。 元素分析按C56H41Cl3CuN8计算值 (%):C,67.54%;H,4.15%;N,11.25%。实验值(%):C,67.61%;H,4.09%;N,11.23%。UV-Vis(Tris-HCl buffer,pH=7.2)λmax/nm(absorbance)=422.5(1.491),546.5(0.182),628.5(0.12)。
CuP-3:1H NMR(600MHz,DMSO)δ9.18(m,6H),8.30(m,6H),7.93(s,3H),4.49(s,6H),3.30(s,9H)。质谱m/z:866.124 4,[M-3Cl]+。元素分析按C52H40Cl3CuN10计算值(%):C,64.07%;H,4.14%;N,14.37%。 实验值(%):C,64.09%;H,4.13%;N,14.36%。 UV-Vis(Tris-HCl buffer,pH=7.2)λmax/nm(absorbance)=433.5(1.405),564.5(0.108),628.5(0.076)。
1.3 配合物与DNA相互作用的实验
CT-DNA 溶液用缓冲溶液(5 mmol·L-1Tri-HCl,50 mmol·L-1NaCl,pH=7.2)配制,测其 A260/A280=1.8~1.9,说明该DNA溶液基本上不含蛋白质[21],不需要进一步处理。CT-DNA的浓度根据其在260 nm处的摩尔消光系数值(6 600 L·mol-1·cm-1)来计算[22]。 配合物的溶液用称量法进行配制。
1.3.1 紫外光谱滴定实验
室温下,参比池中加入3.0 mL Tris-HCl(pH=7.20)缓冲溶液,样品池中加入3.0 mL待测样品,用微量进样器每隔5 min向样品池中加入2μL 1.0 mmol CT-DNA并搅拌,直到紫外吸收值恒定不变。每次加CT-DNA前检测其在200~700 nm范围内的紫外可见吸收光谱。待测样品与CT-DNA相互作用的结合常数(Kb)由下面公式计算得到:

其中,εa代表存在不同浓度的CT-DNA时待测样品的摩尔消光系数;εf为不存在CT-DNA时待测样品的摩尔消光系数;εb为待测样品与CT-DNA作用达到平衡时的摩尔消光系数。以cDNA/(εa-εf)为纵坐标,cDNA为横坐标作图,得到一条直线,待测样品的结合常数(Kb)即为这条直线斜率与截距的比值。
1.3.2 EB-DNA淬灭实验
恒定室温下,荧光池中加入2.5mL Tris-HCl缓冲溶液和20μL EB,然后滴加4μmol·L-1CT-DNA直到荧光强度不再变化即达到滴定平衡(λex=496 nm,λem=596 nm)。每隔5 min,用微量进样器滴加0.2 mL待测样品直到荧光强度不再下降即达到滴定平衡。根据Stern-Volmer方程[23]计算荧光淬灭常数(Ksv):

其中,F0代表不存在待测样品时的荧光强度;F代表存在待测样品时的荧光强度;cQ代表淬灭剂的浓度;Ksv代表动态淬灭常数。
1.3.3 粘度实验
在(25.00±0.01)℃恒定温度条件下,首先将10 mL Tris-HCl(pH=7.20)缓冲溶液加入到粘度计中,测量溶液流经毛细管所用的时间为t0;接着将50μL配制的CT-DNA溶液加入其中,混匀后,测量溶液流经毛细管所需的时间t;每隔5 min,滴加待测样品2.5μL,混匀后,测量待测样品加入后CT-DNA粘度的变化;停止测量,直至流动时间基本不发生变化。此操作重复 3 次。以(η/η0)1/3为纵坐标,待测样品与CT-DNA浓度比为横坐标作图,观察CT-DNA相对粘度变化[24]。

其中η0代表不存在待测样品时CT-DNA粘度值,η代表存在待测样品时CT-DNA粘度值。
1.3.4 圆二色谱实验
首先将1 mL Tris-HCl(pH=7.20)缓冲液加到比色池中,扫描其在220~500 nm范围内的CD光谱作为对照,然后将 10μmol·L-1待测样品和50μmol·L-1CT-DNA溶液混合,混匀、反应 5 min,在 220~500 nm范围内测定待测样品的ICD光谱。
1.4 抗肿瘤活性实验
人成纤维细胞(L929)、宫颈癌细胞(Hela)和乳腺癌细胞(MDA)均由兰州大学医学院提供。取宫颈癌细胞 (Hela)、乳腺癌细胞(MDA)和人成纤维细胞(L929)(处于对数生长期),用DMEM培养基(含有10%胎牛血清)配制单细胞悬浮液,浓度约为4×104mL-1。然后接种于96孔板中。每孔加入的细胞悬液为100μL,需要注意的是配制单细胞悬液时尽量保持加入每孔的细胞数一致。
将细胞培养至贴壁再分组,分为4组进行实验,对照组(con)为不加药组,加入DMEM培养基(含有10% 胎牛血清 );其余各组为实验组(exp),各实验组分别加入100μL的含CuP-1~CuP-3的浓度分别为 25、50、75 及 100 μmol·L-1的溶液。 每组设 3个实验孔、3个复孔。37℃、5%(V/V)CO2,水蒸气饱和培养条件下,分别继续培养24,48和72 h,以仅含有10%胎牛血清DEME培养基,不接种细胞的空白组为调零孔。
培养终止,分别向每孔中加入10μLMTT溶液(5 mg·mL-1),原条件下继续培养4 h,培养终止后,弃上清液,加二甲基亚砜(DMSO)(200μL)到每孔,然后以中速于水平摇床上振荡15min,检测570 nm吸光度OD值。重复3次实验,计算细胞抑制率(Rin)公式如下:

其中ODexp为实验组OD值,ODcon为对照组OD值。
2 结果与讨论
2.1 紫外光谱滴定实验
卟啉类化合物的结构中由于存在共轭大环结构,而具有紫外可见吸收特征光谱,在Soret带有一个强吸收峰而在Q带有3~4个弱的吸收峰[25]。因此紫外-可见光谱常被用来研究卟啉类化合物与DNA的相互作用[26]。
如图2所示,水溶性铜卟啉配合物CuP-1、CuP-2和 CuP-3的 Soret带分别位于 424.5、422.5和433.5 nm。随着滴加CT-DNA浓度的递增,CuP-1、CuP-2和CuP-3 Soret带的吸收强度都出现明显降低,且分别红移到430.5、426.5和439 nm。其中CuP-1的Soret带减色41.5%,红移6 nm。而相同条件下,CuP-2和CuP-3的Soret带分别减色25.4%和26.4%,且分别红移了4 nm和5.5 nm。研究结果显示,CuP-1、CuP-2和CuP-3 Soret带的紫外吸收均出现红移及减色现象,说明DNA碱基的π共轭体系与CuP-1、CuP-2和CuP-3的大环π*共轭体系发生了某种作用,致使π电子堆积,π电子轨道和π*空轨道发生耦合,促使π→π*跃迁能降低,表现为红移。减色效应是因为耦合作用促使π*轨道部分充满电子,减小了π→π*跃迁,吸收峰强度因此降低。初步判断CuP-1与CT-DNA可能以插入结合的方式作用,而CuP-2和CuP-3与CT-DNA是以外部沟面结合的方式作用。为了定量比较CuP-1、CuP-2和CuP-3与CT-DNA结合能力的强弱,根据Soret带吸光度值随着CT-DNA浓度的变化进行紫外光谱滴定,测定配合物与CT-DNA的结合常数。如表1所示,本实验条件下,CuP-1、CuP-2和 CuP-3与CTDNA 的结合常数 Kb分别为 1.622×105、1.004×105和1.143×105L·mol-1。说明 CuP-1、CuP-2 和 CuP-3 与DNA结合能力的大小为CuP-1>CuP-3>CuP-2。

图2 CT-DNA对CuP-1(a)、CuP-2(b)和CuP-3(c)紫外可见吸收光谱的影响;(d)结合常数的测定Fig.2 Influence of CT-DNA on the absorption spectra of CuP-1(a),CuP-2(b)and CuP-3(c);(d)Determination of binding constant
2.2 EB-荧光淬灭法
荧光光谱是研究化合物与DNA相互作用的主要手段之一,由于Cuギ离子的3d轨道有单电子存在,具有顺磁性,所以水溶性铜卟啉配合物CuP-1、CuP-2和CuP-3这3种金属配位的卟啉化合物均没有荧光,与文献[27]报道一致。
EB分子本身的荧光很弱,但若存在DNA时,EB分子能够迅速插入到DNA碱基对中并发出很强的荧光。原因在于EB分子插入到DNA碱基对中后,受到DNA疏水环境的保护,避免了EB分子激发态与水分子之间由于发生能量交换而产生的非辐射猝灭。而对于本身没有荧光的化合物而言,化合物的加入若使EB-DNA体系的荧光明显降低,认为该化合物与EB发生了DNA竞争结合,EB-DNA体系荧光降低的程度就成为化合物与DNA结合能力的间接体现[28]。
如图3所示,EB-DNA体系随CuP-1、CuP-2和CuP-3的滴加,EB-DNA体系的荧光光谱均发生不同程度的荧光淬灭现象,表明这些配合物与CTDNA之间存在一定的相互作用。其中,随滴加的CuP-1浓度的递增,EB-DNA体系的荧光强度淬灭现象最为明显,EB-DNA体系的荧光强度逐渐减弱,最后几乎被完全猝灭,表明可能有部分EB分子已被CuP-1从EB-DNA体系中取代出来,发生了与EB分子类似的插入作用。另外,根据Stern-Volmer方程和荧光淬灭常数曲线得出CuP-1、CuP-2和CuP-3 的淬灭常数, 分别为 1.303×104、8.62×103和1.032×104L·mol-1(表 1)。 这3种阳离子卟啉化合物的Stern-Volmer淬灭常数呈现 CuP-1>CuP-3>CuP-2的趋势。淬灭常数的这种次序能反映出这些淬灭剂与CT-DNA的结合能力。荧光淬灭实验所反映的水溶性卟啉配合物与CT-DNA结合能力的次序与紫外光谱实验结果基本一致。

图3 CuP-1(a)、CuP-2(b)和CuP-3(c)对EB-DNA体系荧光光谱的影响及Stern-Volmer方程的线性拟合Fig.3 Influence of CuP-1(a),CuP-2(b)and CuP-3(c)on the fluorescence spectra of EB-DNA and Linear fitting of the Stern-Volmer equation(d)
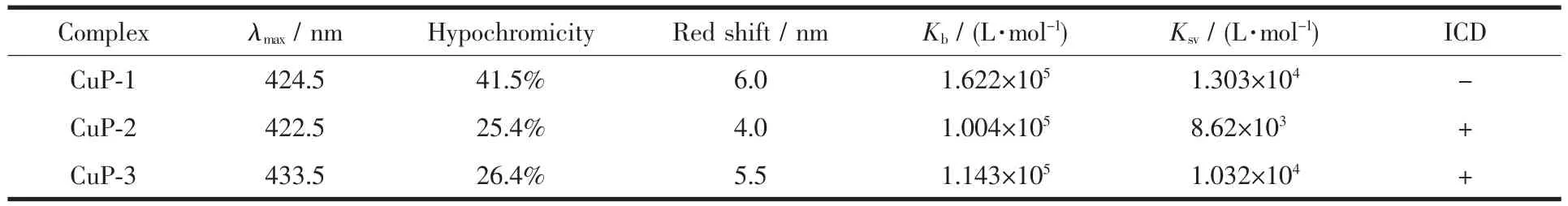
表 1 CuP-1、CuP-2和CuP-3与CT-DNA结合的参数Table 1 Parameters of CuP-1,CuP-2 and CuP-3 in binding w ith CT-DNA
2.3 粘度法研究
化合物与DNA是否发生相互作用可通过光谱学数据充分反映出来,但不能充分说明化合物与DNA的作用方式。研究化合物与DNA相互作用的实验方法中最有说服力的是粘度法[29]。当某种化合物与DNA以插入的方式进行相互作用时,这种化合物会插入到DNA相邻碱基对中,致使相邻碱基对的距离变长,进而增加DNA链的相对长度,表现为DNA相对粘度升高。而当化合物与DNA以部分插入或非经典的插入方式进行作用时,DNA相邻碱基对发生扭结,DNA链的相对长度变短,表现为DNA相对粘度降低。当DNA相对粘度没有明显变化时,说明化合物与DNA以外部沟面结合的方式进行作用。
水溶性铜卟啉配合物 CuP-1、CuP-2和 CuP-3滴加到CT-DNA体系(pH 7.20,TrisHCl缓冲液)后对CT-DNA相对粘度的影响,如图4所示。当CuP-1滴加到CT-DNA体系后,随浓度比率r(r=ccomplex/cDNA)的递增,CT-DNA溶液的粘度呈明显的上升趋势。表明CuP-1可能以插入模式与CT-DNA进行作用。而CuP-2和 CuP-3滴加到CT-DNA体系后,CT-DNA溶液的粘度没有明显的变化,说明这2种配合物可能以外部沟面结合的方式与CT-DNA进行作用。
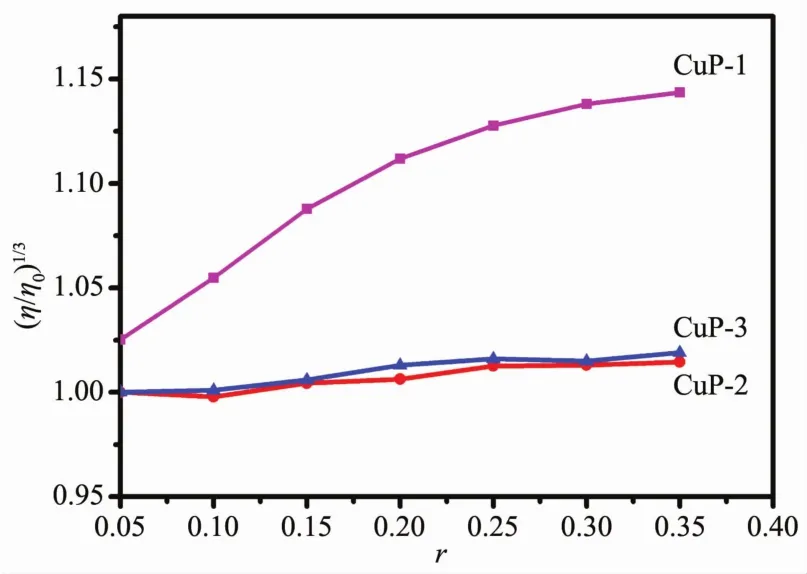
图4 CuP-1、CuP-2和CuP-3对CT-DNA相对粘度的影响Fig.4 Influence of CuP-1,CuP-2 and CuP-3 on the relative viscosity of CT-DNA
2.4 圆二色谱法研究
通常研究卟啉类化合物与DNA相互作用最直接的方法是圆二色谱法(CD)。具有不对称结构的卟啉化合物在Soret带没有CD信号,当DNA与这种卟啉化合物发生相互作用时会在Soret带产生诱导CD(ICD)信号峰。因此卟啉类化合物与DNA不同的作用模式对应不同的诱导CD(ICD)信号峰。一般认为,负的ICD信号峰,表示卟啉类化合物与DNA以插入的方式相互作用;正的ICD信号峰,表示卟啉类化合物与DNA以外部沟面结合方式相互作用;等强的正、负ICD信号峰,表示卟啉类化合物与DNA以外部堆积的方式相互作用[30-31]。
为进一步证实 CuP-1、CuP-2和 CuP-3与 CTDNA的结合模式,采用CD光谱在220~500 nm的波长范围内研究其与CT-DNA的结合模式。如图5所示,当 配合物与DNA的浓度比r(r=ccomplex/cDNA)为0.05时,CuP-1在433 nm处出现1个较强的负峰,而CuP-2和CuP-3在431和430 nm处各出现1个正峰。这表明CuP-1与CT-DNA以插入的模式进行作用,而CuP-2和CuP-3通过外部沟面结合的方式与CT-DNA进行作用。

图5 CT-DNA存在时CuP-1、CuP-2和CuP-3的诱导圆二色光谱Fig.5 ICD spectra of CuP-1,CuP-2 and CuP-3 in the presence of CT-DNA
以上结果表明CuP-1与CT-DNA以插入的模式进行相互作用,而CuP-2和CuP-3通过外部沟面结合的方式与CT-DNA进行相互作用,且CuP-1与CT-DNA的结合能力优于CuP-2和CuP-3。可能的原因在于CuP-1的空间构型及体积相对于CuP-2和CuP-3较小,且趋于平面,利于其嵌入到DNA的碱基对中成键,与CT-DNA以插入的模式进行结合。CuP-2和CuP-3结构中由于芳香环上存在N杂环取代基,会使CuP-2和CuP-3与DNA结合时产生较大的空间位阻,因此CuP-2和CuP-3易从外部与CT-DNA分子进行键合,与CT-DNA以外部沟面结合的模式进行作用。且CuP-2和CuP-3结构中芳香环上N杂环取代基含有带孤电子对的N原子,影响复合物的稳定性,进而影响CuP-2和CuP-3与CT-DNA的结合效果。
2.5 M TT法测定CuP-1~CuP-3对肿瘤细胞增殖的影响
基于水溶性铜卟啉配合物CuP-1~CuP-3与CTDNA以不同的结合模式进行相互作用,以及卟啉类化合物对肿瘤细胞良好的靶向作用及其结构的特异性[32],本文以人成纤维细胞(L929)为正常细胞系,以宫颈癌细胞(Hela)和乳腺癌细胞(MDA)为测试细胞株,考察了CuP-1~CuP-3的体外抗肿瘤活性。
不同浓度、不同作用时间的条件下,CuP-1~CuP-3对Hela和MDA的抑制率如图6~8所示。结果表明,随浓度和作用时间的增大,CuP-1~CuP-3对Hela和MDA的抑制率呈现时间和剂量依赖性,其中CuP-1对2种肿瘤细胞的抑制率明显高于其溴取代衍生物CuP-2和CuP-3。通常,利用化合物的半数有效浓度IC50来评价其药效,IC50值越小表明其药效越好。如表2所示,CuP-1对Hela和MDA分别作用 24、48、72 h 后的 IC50值分别为:59.399、42.513和 33.956 μmol·L-1以及 107.094、60.215 和 46.406 μmol·L-1;可知在相同条件下,CuP-1 对 Hela 的体外增殖抑制作用优于MDA,且作用72 h时其抑制率最高,说明CuP-1对Hela可能具有特定的靶向性。而CuP-2和CuP-3对Hela和 MDA分别作用 24、48、72 h 后的 IC50值均大于 119 μmol·L-1(表 2),表明CuP-2和CuP-3对2种肿瘤细胞的体外增殖抑制作用相对于CuP-1的抑制作用较弱,可能与其和CT-DNA的作用模式有关。另外,从表2中可知,CuP-1~CuP-3对L929的抑制率均很弱,其可能的原因在于卟啉环对肿瘤细胞的选择性[33]。

图6 CuP-1对2种肿瘤细胞的增殖抑制作用Fig.6 Proliferation inhibition of CuP-1 on two kinds of tumor cell lines
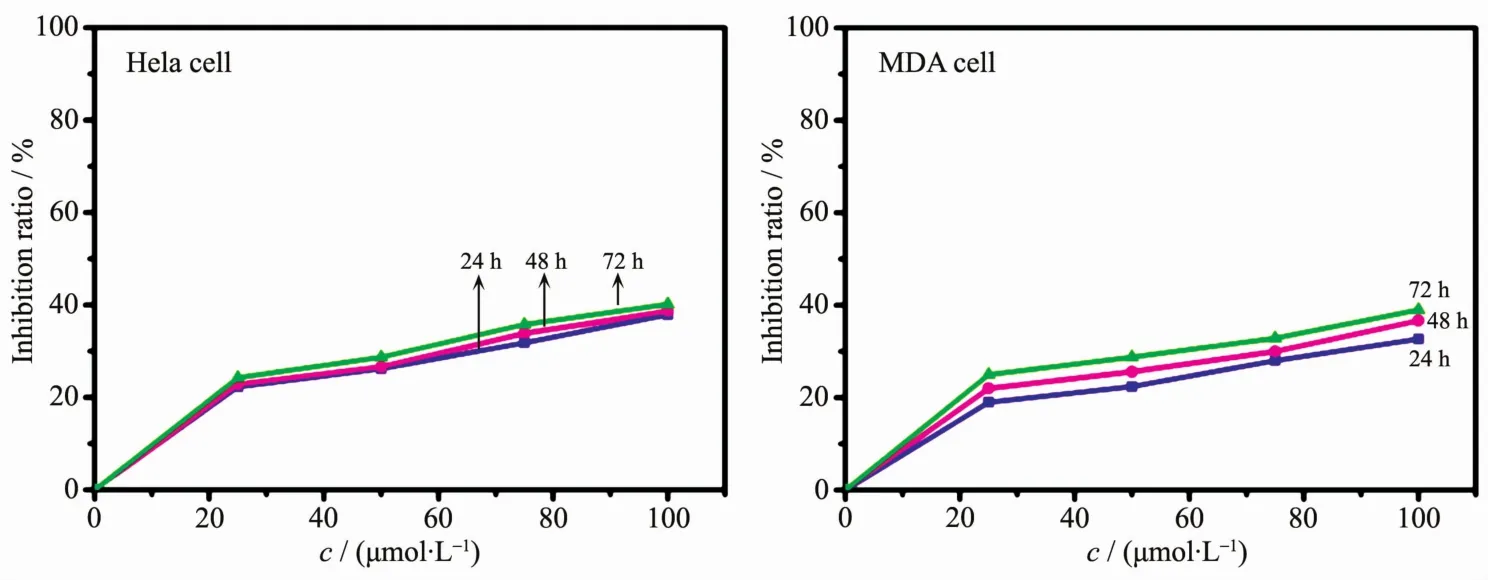
图7 CuP-2对2种肿瘤细胞的增殖抑制作用Fig.7 Proliferation inhibition of CuP-2 on two kinds of tumor cell lines

图8 CuP-3对2种肿瘤细胞的增殖抑制作用Fig.8 Proliferation inhibition of CuP-3 on two kinds of tumor cell lines

表 2 CuP-1~CuP-3 的 IC50值Table 2 IC50 values of CuP-1~CuP-3
3 结 论
基于A4型吡啶基阳离子卟啉具有与DNA强的插入作用及潜在的抗癌活性,合成了A3B型含溴的吡啶基阳离子铜卟啉CuP-1,进而通过官能团修饰,取代溴原子合成了其衍生物CuP-2和CuP-3,并进行了结构表征。采用紫外光谱法、EB-荧光淬灭法、粘度法和圆二色谱法研究了它们与CT-DNA的相互作用。结果表明,CuP-1与CT-DNA以插入的模式进行作用,而CuP-2和CuP-3与CT-DNA以外部沟面结合的方式进行作用,且CuP-1与CT-DNA的结合能力优于CuP-2和CuP-3。基于卟啉类化合物对肿瘤细胞良好的靶向作用及其结构的特异性,研究了CuP-1~CuP-3的体外抗肿瘤活性。实验结果表明,CuP-1~CuP-3对Hela和MDA均有体外抑制肿瘤细胞增殖的作用,呈时间、剂量依赖关系。其中CuP-1对2种肿瘤细胞的体外增殖抑制作用远远优于其溴取代衍生物CuP-2和CuP-3,可能和CuP-1与DNA相互作用较强及结合模式有关,表明配合物与DNA的插入作用模式可能是配合物具有抗肿瘤活性的原因之一。且CuP-1对Hela的抑制增殖作用明显优于MDA,表明CuP-1对Hela具有特定的靶向性,说明卟啉类化合物对肿瘤细胞存在靶向性筛选。
