STAT3信号通路在胚胎神经系统发育中作用的研究进展
2018-10-11吴淑芳孟晓芳周静莹刘学红
吴淑芳 潘 洁 孟晓芳 周静莹 刘学红
(绍兴文理学院医学院, 绍兴 312000)
胚胎神经系统的发育受多条信号通路的调控。在大脑皮质的发育过程中,GTPase介导的信号通路在树突的发育和神经细胞的迁移中起着重要调控作用[1]。Wnt信号通路可以通过控制神经板、神经嵴的形成以及促进小脑突触的发育来调节胚胎神经系统发育[2]。BMP信号通路则可以抑制BMP4的表达,来促进海马神经的发生[3],参与视网膜的胶质细胞发育,从而调节中枢神经系统的发生过程。此外,MAPK、mTOR、STAT3等信号通路均是神经发育过程中的重要调节者,其中,STAT3信号通路无论是在中枢神经系统还是周围神经系统的发育中都发挥重要调控作用,尤其在产生和维持神经胶质细胞方面。
1 STAT3信号通路
信号转导和转录激活因子(signal transducers and activators of transcription, STATs)是转录因子的一个家族,在细胞增殖、分化、凋亡、炎症反应、免疫、造血以及肿瘤等多个方面起着至关重要的作用。STATs属于高度保守的蛋白质家族,由STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6组成[4]。其中,STAT3是一种脱核苷酸结合蛋白,可以被许多细胞因子、生长因子和其他刺激所激活,在胚胎发育、肿瘤发生等方面发挥重要作用。
1.1 STAT3的结构
人类STAT3基因位于第12号染色体。STAT3的结构包含6个区域: 即N端结构域(N-terminal domain, NTD)、卷曲螺旋域(coiled-coil domain, CCD)、DNA结合域(DNA-binding domain, DBD)、连接域、SH2域以及C端转录激活域[5]。NTD参与静止细胞中未磷酸化的STATs形成同质二聚体;SH2域则参与活化的STATs二聚物的形成;DBD与STATs基因启动子直接相关。连接域主要维持SH2域和DBD之间的正确构象。CCD、C端转录激活域均与目标基因的转录与调节有关[4]。
1.2 STAT3的活化与信号转导
STAT3的活化源于其C端转录激活域的酪氨酸705(Try705)和丝氨酸727(Ser727)磷酸化。目前有超过40种不同的多肽配体可引起STAT3磷酸化。白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、干扰素-γ(interferon-γ, IFN-γ)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)等细胞因子均可以激活STAT3。许多细胞因子受体,比如表皮生长因子受体(epithelial growth factor receptor, EGFR)、血管内皮生长因子受体(vascular endothelial growth factor receptor, VEFGR)、血小板生长因子受体(platelet-derived growth factor receptor, PDGFR)等也可促进STAT3的活化[6]。此外,烟雾、压力、辐射、致癌物、感染等因素也在STAT3的活化中发挥了巨大作用。STAT活化蛋白抑制剂以及细胞因子信号抑制剂等则可以阻止STAT3转录活化。
细胞表面或者胞质内的受体可以与细胞外信号蛋白或细胞因子结合,结合后受体的糖蛋白130(gp130)亚基形成二聚体,与其相连的Jak酶发生磷酸化,进而使得STAT3分子C端的酪氨酸残基发生磷酸化,SH2域调控活化的STAT3形成二聚体[7](图1)。而后STAT3二聚体转移到细胞核内,与靶基因的启动子结合,诱导靶基因的转录。STAT3的活化与信号转导、胚胎神经系统发育有着密切联系。
2 STAT3与胚胎神经系统发育
2.1 STAT3与胚胎中枢神经系统发育(图1)
胚胎中枢神经系统的发育主要包括神经管的演变、神经细胞和胶质细胞的发育。STAT3可以激活hgf/c-met信号通路,从而构成hgf/c-met/STAT3途径,抑制神经管缺陷,促进胚胎脑组织的血管生成以及正常分化发育[8]。STAT3在早期胚胎脑发育阶段高度表达,晚期表达下调。早期STAT3的高度表达有利于内源性神经干细胞的增殖和稳定,晚期的表达下调则可以促进相邻细胞的神经元分化[9]。STAT3也可以直接调控SOX2启动子[10],使得SOX2下游的巢蛋白活化,巢蛋白的激活有助于神经干细胞的增殖和维持。STAT3/AMPK/ERK信号通路激活对海马的发生,即轴突和突触的形成具有重要意义[11]。IL-10可以使JAK1磷酸化,进而活化STAT3,有助于神经元和突触形成,尤其是海马突触形成。Chen等[12]的实验表明,STAT3通过下调Bax的表达和上调Bcl-2的表达,增加了netrin-1的表达,促进轴突分枝和神经的生长。
中枢神经系统发育过程中,STAT3调控星形胶质细胞、少突胶质细胞和小胶质细胞等神经胶质细胞的发育。SUN等[13]认为,STAT3在胶质祖细胞的分化中起监管作用,诱导星形胶质细胞、少突胶质细胞以及髓鞘的产生。转录因子Hes1(hairy and enhancer of split-1)是一种蛋白质,能够在胚胎干细胞分化过程中与STAT3结合,促进它的表达和活化,而后作用于亨廷顿蛋白(huntingtin protein, Htt),Htt对谷氨酸能神经元、γ-氨基丁酸能神经元以及少突胶质细胞的分化和成熟起着调控作用。而基因突变的Htt则会破坏损害各神经元、少突胶质细胞以及其他器官祖细胞的成熟[14]。神经损伤后,异丙酚可以激活JAK1,并使STAT3的Try705磷酸化从而参与细胞内钙离子止血,预防线粒体肿胀,对星形胶质细胞和小胶质细胞提供神经保护以及促进胶质细胞的再生,神经干细胞参与胶质细胞的再生及胚胎发育中胶质细胞的分化[15]。因此,在胚胎神经系统发育中,STAT3或许与小胶质细胞的发育也存在一定关联。
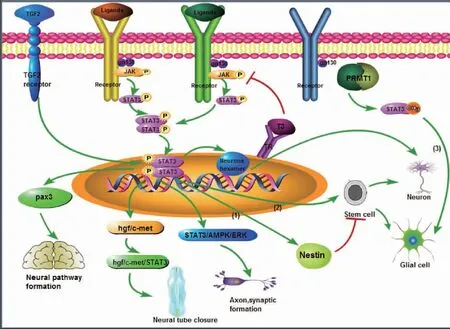
图1 STAT3信号通路在胚胎神经系统发育中的作用示意图
STAT3除了直接调控胶质细胞的生成以外,也可以作用于神经干细胞后再对胶质细胞发挥调控作用。三碘甲状腺原氨酸(T3)具有促进神经元分化生长的作用,其通过甲状腺激素受体α降低JAK1、JAK2的磷酸化,从而抑制STAT3的C端酪氨酸磷酸化以及DNA结合域的活性[16]。STAT3的活性下降后,神经干细胞的活性也显著下降,神经干细胞增殖受抑制,而后被诱导分化为神经元和少突胶质细胞。在神经系统中,mTOR调节神经元的分化、生存和发展,可被神经元细胞膜上各种类型的蛋白质调控。STAT3的Ser727磷酸化可被mTOR信号通路调节,从而诱导早期神经元和星形胶质细胞分化[17]。神经干细胞向星形胶质细胞分化也可受蛋白质精氨酸甲基转移酶-1(PRMT1)调节,其使STAT3甲基化而活性增高,促进分化过程[18]。gp130也能够通过JAK/STAT途径诱导STAT3活化,调控神经干细胞和神经祖细胞分化为星形胶质细胞[19]。Luo等[20]运用STAT3的抑制剂来阻断STAT3的活化,结果显示星形胶质细胞的形成和增殖明显下降,更加直观地表明了STAT3对胶质细胞的作用。此外,STAT3可以直接调控神经干细胞的活性: STAT3活性下降后,神经干细胞活性降低,其增殖和稳定能力也显著减弱,从而促进神经细胞的分化和脑组织的分化。mTOR与STAT3合成的mTOR/STAT3信号通路被激活后可调控NogoA,抑制轴突纤维生长,促进神经再生[17]。
在胚胎脊髓发育过程中,在时间和空间的调控下,沿神经管腹背轴有序生长的大量神经细胞逐渐分化成小的、独立的细胞团,这些小的细胞团再逐渐分化为脊髓的各个部分。脊椎动物的脊髓细胞最初来源于胚胎中具有中胚层特征的神经祖细胞区域。在胚胎脊髓发育中,Pax3在背部联合神经元表达,以形成合适的脊髓大脑通路,从而调节神经通路的形成[21]。成纤维细胞生长因子-2(FGF2)通过调节STAT3信号通路来影响Pax3的表达[22],FGF2受到外界的刺激后被激活分泌,与FGF2受体结合,促进STAT3的转录活化,使得Pax3的表达。由此可见,STAT3在胚胎脊髓发育中与神经通路的形成有着重要联系。
2.2 STAT3与胚胎周围神经系统发育
胚胎周围神经系统由神经外胚层形成的神经嵴分化而来,可以分为运动神经纤维和感觉神经纤维。STAT3的Try705磷酸化可以保持胚胎干细胞的分化多能性,Ser727磷酸化则参与维持胚胎干细胞内环境的稳定。若失去Ser727磷酸化,神经外胚层干细胞则表现为神经分化潜能丧失[23]。在胚胎发育时期,运动神经元的分化离不开STAT3的活化。Seunghee等[24]报道,当受到外部刺激时,STAT3信号通路被激活,触发其C端酪氨酸705区磷酸化,提高运动神经元六聚物在其上游信号的转录活动,增强运动神经元六聚物的表达,从而促进运动神经元的基因表达。但Rajalaxmi等[25]认为,抑制STAT3的活化,可以促进神经发生,诱导运动神经元的分化。这可能是由于在不同的细胞环境中,所呈现的结果有一定差异。在施万细胞的发育和髓鞘形成过程中,STAT3并没有起决定性作用,但其在施万细胞的损伤修复中被磷酸化后发挥重要作用[26]。STAT3对于周围神经系统中的运动神经元的作用是促进还是抑制仍需要进一步研究。
STAT3可以通过激活JAK/STAT途径、hgf/c-met/STAT3等多种途径来调节胚胎神经系统的发育,其活化可以促进胚胎中枢神经系统的分化,但对周围神经系统分化具有促进还是抑制作用仍存在争议。胚胎神经系统发育过程中,STAT3活化后可以激活哪些下游基因的转录表达?如何运用该信号通路来解决临床胚胎神经系统发育不全或障碍等问题都有待进一步研究。
