携带EphrinA1-caspase-3基因的重组腺病毒载体的构建和包装❋
2018-10-11张本斯卞思源李艳娇
张本斯 李 庄 卞思源 杨 桂 李艳娇 张 覃 黄 煜
(大理大学, 1 基础医学院解剖学教研室, 2 附属医院胸外科, 大理 671000)
诱导细胞凋亡是很有前途的肿瘤基因治疗方法[1]。构建靶向促凋亡基因,将具有导向能力的肿瘤特异性分子与促凋亡蛋白偶联,靶向促凋亡蛋白在体内就像“死亡开关”,定向寻找肿瘤细胞,诱导其自杀,同时对正常组织又不造成损伤[2]。EphA2是受体酪氨酸激酶家族(RTKs)的重要成员,其特异性配体为EphrinA1。两者结合产生的信号转导能直接参与各种生理活动,包括细胞生长、迁徙、分化及血管发生等[3]。研究表明,EphA2高表达于高侵袭性肿瘤组织和肿瘤细胞,与患者预后显著相关[4-6]。本课题组前期研究显示EphA2高表达于乳腺癌组织,其阳性率与病理类型、肿瘤大小、淋巴结转移、临床分期、组织学分级相关[7]。鉴于乳腺癌过度表达EphA2,选择其配体EphrinA1作为靶向促凋亡蛋白的靶向分子,参与构建靶向促凋亡基因EphrinA1-caspase-3。caspase-3作为凋亡的最终执行因子,有望成为理想的肿瘤治疗因子[8]。但胞质中caspase-3以无活性前体(Procaspase-3)存在。Srinivasula等[9]构建了一种重构型caspase-3分子,无需上游caspases切割即具有活性。如何使caspase-3分子特异地进入肿瘤细胞是其发挥自杀基因作用的关键。本研究拟用人活性型caspase-3和EphrinA1的基因,构建一种新型靶向促凋亡基因,即EphrinA1-caspase-3,并将该基因亚克隆入腺病毒载体,包装获得重组腺病毒,为后续以重组腺病毒介导目的基因修饰人外周血T淋巴细胞,研究T淋巴细胞表达的融合蛋白EphrinA1-caspase-3在体内外对乳腺癌细胞的杀伤作用奠定基础,为进一步探索利用EphrinA1/EphA2系统介导选择性诱导高表达EphA2受体的肿瘤细胞死亡提供依据。
1 材料和方法
1.1 基因、载体、细胞和主要试剂
pMD18T-casp3和pMD18T-EFNA1基因、大肠杆菌DH5α(长沙爱科博生物科技有限公司);重组腺病毒构建系统(包括pAD/pl-DEST腺病毒骨架及穿梭载体)、HEK293细胞(Invitrogen公司);感受态细胞TOP 10(Biontex公司)。Not I、EcoR I、Sal I、T4 DNA Ligase、Taq DNA聚合酶(TaKaRa公司);METAFECTENETM转染试剂、LR Clonase Ⅱ(Invitrogen公司);DMEM/High Glucose培养基、胰酶(Hyclone公司);胎牛血清、青霉素/链霉素(Gibco公司);XbaI、Pac Ⅰ(NEB公司)。
1.2 引物的设计和合成
1.3 pET28a-Casp3载体的构建
首先进行caspase-3基因的PCR扩增及回收,用Casp3-F和Casp3-SalNotR引物,以含有人活性型caspase-3基因的pMD18T-casp3为模板扩增目的基因。在EP管中依次加入: 10×PCR Buffer 5μl、Taq DNA polymerase 0.5μl、dNTP(10mmol/L)1μl、Casp3-F 1μl、Casp3-SalNotR 1μl、pMD18T-casp3 2μl、加ddH2O至50μl反应体系中进行反应。反应条件为: 95℃变性5min;95℃ 30s→56℃ 30s→72℃ 1min,共计30个循环;72℃延伸10min,置4℃保存。将PCR产物进行1%琼脂糖凝胶电泳,GIS凝胶系统检测是否出现预期的caspase-3基因带(1kb),并用胶回收试剂盒回收目的片段。接着将caspase-3基因亚克隆至pET28a载体,对回收的caspase-3片段和pET28a载体进行Sal I和Not I双酶切,将反应体系(表1)放到37℃水浴中反应30min。1%琼脂糖凝胶电泳回收酶切产物。按载体与目的片段为1∶3的比例,用T4 DNA连接酶连接,连接反应体系为: caspase-3目的片段3.0μl,pET28a 1.0μl,10×T4 Ligase buffer 2.0μl,T4 Ligase 1.0μl,ddH2O 13.0μl,总共20μl体系。混匀后22℃反应4h。然后将连接产物转化感受态大肠杆菌DH5α,次日挑取阳性克隆,送南京金斯瑞科技有限公司测序鉴定,正确克隆命名为pET28a-Casp3。

表1 Caspase-3目的片段和pET28a载体的双酶切反应体系(μl)
1.4 pET28a-EphrinA1-Casp3载体的构建
首先进行EphrinA1基因的PCR扩增及回收,用EphrinA1-ECOSALF/EphrinA1-ECOSALR引物,以pMD18T-EphrinA1为模板扩增目的基因。在反应体系中加EphrinA1-ECOSALF 1μl、EphrinA1-ECOSALR 1μl、pMD18T-EphrinA1 2μl,其余试剂和反应条件与“caspase-3基因的PCR扩增”相同。将PCR产物电泳,检测是否出现预期条带(618bp),回收目的片段。接着将EphrinA1基因亚克隆至pET28a-Casp3载体,对EphrinA1基因片段和pET28a-Casp3载体进行Eco RI和Sal I双酶切,将反应体系(表2)放到37℃水浴,反应30min。电泳、回收酶切产物,在连接反应体系加EphrinA1基因片段3.0μl,pET28a-Casp3载体1.0μl,其余试剂和反应条件与“1.3”类似。然后将连接产物转化DH5α感受态细胞,次日挑取阳性克隆,提取质粒,Eco RI和Sal I双酶切,1%琼脂糖凝胶电泳。并将阳性克隆送公司测序,正确克隆命名为pET28a-EphrinA1-Casp3。

表2 EphrinA1基因片段和pET28a-Casp3载体的双酶切反应体系(μl)
1.5 pEC3.1-EphrinA1-Casp3穿梭载体的构建
将pET28a-EphrinA1-Casp3和穿梭质粒pEC3.1(+)用EcoR I和Not I双酶切,将反应体系(与1.4类似)置于37℃水浴30min,回收酶切产物。在T4 DNA Ligase作用下,亚克隆EphrinA1-Casp3至穿梭载体pEC3.1(+)上(连接反应与1.3类似),将连接产物转化DH5α,挑取Ampr抗性单菌落,双酶切和测序鉴定,阳性克隆命名为pEC3.1-EphrinA1-Casp3。
1.6 pAd-EphrinA1-Casp3重组腺病毒载体的构建
2011年10月18日,由广东省粤电集团投资的目前世界上单机容量及总装机容量最大的秸秆直燃发电项目正式投入商业运营。该电厂选用2×50MW凝汽式汽轮机发电机组,配2×220t/h高温高压循环流化床锅炉。2015年,年利用小时数超过6700h。该秸秆直燃发电项目每年可节约约10万吨标准煤,减少二氧化碳排放约30万吨,减少二氧化硫排放近2000t[22]。
采用LR体外同源重组,将pEC3.1-EphinA1-Casp3载体的EphrinA1-caspase3表达框转移至腺病毒表达载体pAd/pl-DEST(图1)上,反应体系为: pEC3.1-EphinA1-Casp3 (0.1μg/μl) 1.5μl,pAd/pl-DEST (0.02μg/μl) 1.5μl,LR Clonase Ⅱ 2μl,加ddH2O至10μl。25℃反应1 h。蛋白酶K消化LR Clonase II,37℃反应15min。将5μl反应产物转化感受态细胞TOP 10,涂布于含Ampr抗性的LB平板,37℃恒温箱培养过夜。挑取3~4个单克隆菌落接种于10ml LB培养液中,37℃恒温摇床(250r/min)培养过夜。提取质粒,XbaⅠ单酶切鉴定,反应体系为: 10×Buffer 1.5μl,XbaI 0.5μl,重组腺病毒质粒13μl,总共15μl体系。正确质粒命名为pAd-EphrinA1-Casp3。
1.7 重组腺病毒载体pAd-EphrinA1-Casp3的包装
先用PacI单酶切,准备线性化的pAd-EphrinA1-Casp3质粒DNA,反应体系为: 10×Neb Buffer 5μl, 10×BSA 5μl, Pac I(10unit/μl)1μl,重组腺病毒质粒39μl,总共50μl体系。37℃水浴反应5h。酚/氯仿/异戊醇抽提、纯化,乙醇洗涤、沉淀,加30μl dH2O溶解,取3μl电泳鉴定。接着将线性化的腺病毒DNA转染HEK293,依照说明书,用METAFECTENETM转染试剂,按DNA: lipid=1∶3的比例对达到50%~70%融合度的HEK 293细胞进行转染。每天观察细胞病态反应(cytopathic effect, CPE)。当有明显CPE现象,且有>50%脱壁时即收集细胞,在干冰浴及37℃间反复冻融3次,裂解细胞,离心、收集上清,-74℃保存。然后取适量上清再次感染HEK293细胞,放大培养重组腺病毒,当有明显CPE现象时,收集病毒。最后PCR验证重组腺病毒,取上清20μl,提取病毒DNA。设计引物EphrinA1正义序列为5′CAGTTCAAATC CCAAGTTCCG3′,反义序列为5′TGACCGATGCTA TGTAGAACCC。以病毒DNA为模板PCR扩增。反应体系为: 10×PCR Buffer 2.5μl,rTaq 0.25μl,dNTP(2.5mmol/L)1μl,EphrinA1-F (20μmol/L) 0.5μl, EphrinA1-R (20μmol/L) 0.5μl,病毒DNA 1μl,加dH2O至25μl。反应条件为: 95℃变性2min;95℃ 15s→55℃ 15s→72℃ 50s,共计35 cycles;72℃ 5min延伸,4℃保存。电泳检测是否出现预期条带(465bp)。
2 结果
2.1 重组质粒pET28a-Casp3的鉴定
Caspase-3基因PCR产物电泳,可见大小约1000bp的清晰条带,与预期相符(图1),胶回收目的片段。在目的质粒转化的培养皿中可见阳性菌落,具有抗生素抗性的阳性对照也布满阳性菌落,而不加任何DNA的感受态细胞的阴性对照则未见阳性菌落生长,表明质粒转化成功。将阳性克隆测序,把所得序列与人活性型caspase-3基因序列比对,完全一致,成功获得质粒pET28a-Casp3。
2.2 重组质粒pET28a-EphrinA1-Casp3的鉴定
EphrinA1基因PCR产物电泳,显示片段大小约为618bp,与EphrinA1的理论大小一致(图2),胶回收目的片段。提取阳性克隆质粒进行Eco RI和Sal I双酶切,可切出约1.6kb的片段带和约5.0kb的载体带,推测EphrinA1-caspase-3基因片段已被克隆到pET28a载体。测序分析(图3)显示pET28a-EphrinA1-Casp3包含Genebank公布的EphrinA1胞外端基因序列及caspase-3基因序列,表明pET28a-EphrinA1-Casp3构建成功。
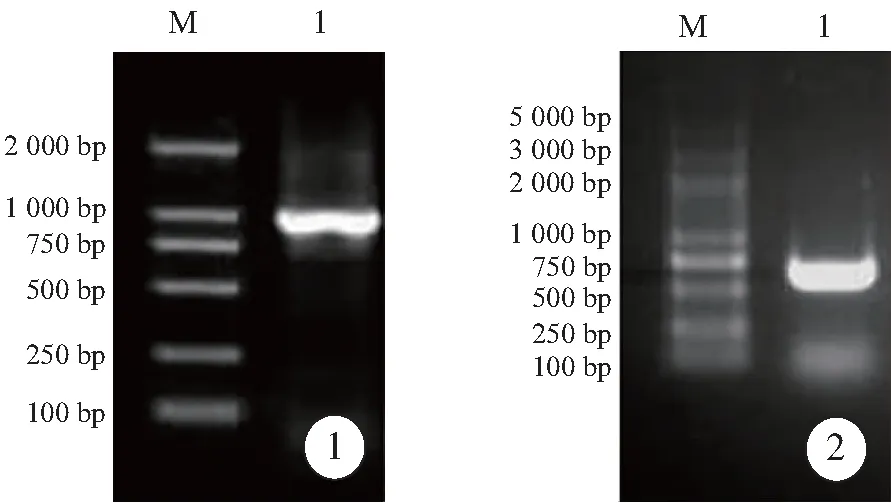
图1 Caspase-3基因PCR产物的1%琼脂糖凝胶电泳图.
图2 EphrinA1基因PCR产物的1%琼脂糖凝胶电泳图.
Fig 1 PCR product of caspase-3 gene was verified by 1% agarose gel electrophoresis. M: DNA marker; 1: PCR product of caspase-3 gene.
Fig 2 PCR product of EphrinA1 gene was verified by 1% agarose gel electrophoresis. M: DNA marker; 1: PCR product of EphrinA1 gene.
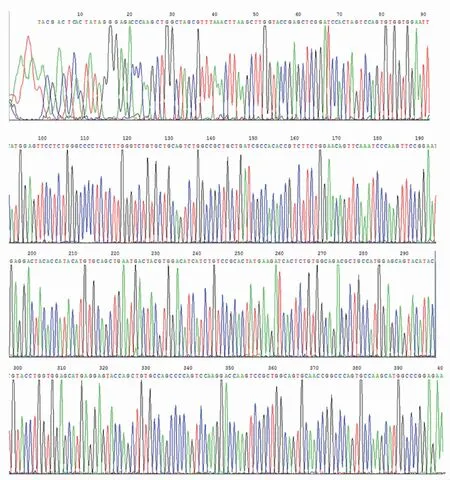
图3 质粒pET28a-EphrinA1-caspase-3的测序
2.3 重组质粒pEC3.1-EphrinA1-Casp3的鉴定
提取阳性菌落质粒,Eco RI和Sal I双酶切鉴定,可切出约1.6kb的片段带和约4.4kb的载体带(图4),与预期相符。测序显示质粒pEC3.1-EphrinA1-Casp3包含EphrinA1-caspase-3基因,提示pEC3.1-EphrinA1-caspase-3构建成功。
2.4 重组腺病毒质粒pAd-EphrinA1-Casp3的鉴定
用XbaⅠ单酶切阳性克隆质粒DNA,电泳显示约3kb和大于15kb的条带(图5),与预期一致,说明载体为腺病毒载体,成功构建了pAd-EphrinA1-Casp3。
2.5 重组腺病毒rAd-EphrinA1-Casp3的制备和鉴定
PacI单酶切质粒pAd-EphrinA1-Casp3,电泳显示1个约2.5kb小带及1个约32kb大带(图6),与预期相符,条带清晰,表明PacI酶切充分,线性化的重组腺病毒质粒DNA的量足够用于后续转染工作。线性化的腺病毒DNA转染HEK293,转染前HEK293细胞贴壁生长,易于聚集成团,呈现不规则多边形、伸展佳、边界清楚,胞质透亮,胞核隐约可见(图7)。转染后7d出现明显的CPE现象(图8),细胞皱缩变小,间隙增大,继而肿大、变圆,呈串珠样改变,约50%细胞脱壁悬浮。收集和裂解细胞,离心取上清,获得重组腺病毒rAd-EphrinA1-Casp3。以适量上清再次感染HEK 293细胞,将重组腺病毒的放大培养,48h后即有明显CPE现象,裂解细胞,收集病毒。PCR扩增腺病毒DNA,电泳(图9)可见约465bp的清晰条带,与设计的目的片段大小一致,表明重组腺病毒rAd-EphrinA1-Casp3包装成功,提取的病毒包含预期目的基因。

图4 重组质粒pEC3.1-EphrinA1-Casp3的Eco RI和Sal I双酶切电泳.
图5 重组腺病毒质粒pAd-EphrinA1-Casp3的XbaI酶切电泳.
图6 PacI酶切后线性化质粒pAd-EphrinA1-Casp3电泳.
Fig 4 Electrophoresis result of the plasmid pEC3.1-EphrinA1-Casp3 digested with the restriction enzymes EcoR I and Sal I. M: DNA marker; 1: pEC3.1-EphrinA1-Casp3 digested with EcoR I and Sal I.
Fig 5 Electrophoresis result of the plasmid pAd-EphrinA1-Casp3 digested by the restriction enzyme Xba I. M: DNA marker;1: pAd-EphrinA1-caspase-3 digested by Xba I.
Fig 6 Electrophoresis result of the linear plasmid pAd-EphrinA1-Casp3 digested by the restriction enzymes Pac I. M: DNA marker; 1: pAd-EphrinA1-caspase-3 digested by Pac I.
3 讨论
3.1 腺病毒作为基因转移载体的优势
随着基因技术的发展,基因治疗应用于临床已有了可行性。安全有效的载体是成功进行基因治疗的先决条件。基因治疗应用的载体可分为两类: 非病毒式和病毒式[10]。非病毒式载体无致病性,疗效易控制,不引起免疫反应,相对安全,但转染效率低,已转入细胞内的DNA易被DNA酶分解,不能在细胞内稳定存在和表达,故应用较少。病毒介导法转染效率高,目的基因表达稳定,在基因治疗中占大多数。用于基因治疗的载体主要有逆转录病毒、腺病毒、腺病毒相关病毒、慢病毒等,相比之下,腺病毒载体具有较多优点[11-12]: (1) 宿主范围广泛,可感染哺乳动物和人体组织多种细胞,包括任何时期的细胞(分裂和非分裂);(2) 外源基因表达水平高,转染效果明显;(3) 适应性和稳定性好,转染后目的基因持续表达时间可达一两周,适合后续实验需要;(4) 易于大量制备和纯化,病毒滴度高,能满足临床要求;(5) 外源基因容量大,并可同时插入多个目的基因;(6) 病毒携带的基因不整合至宿主细胞基因组,以附加体形式存在于染色体之外,在细胞分裂增殖过程中逐渐丢失;(7) 生物安全性高,基本不致病或仅引起轻微的呼吸道感染症状。因此,腺病毒载体明显优于其他转染方法和病毒载体,在基因治疗研究和临床实验中应用较为广泛,是基因治疗比较理想的外源性载体。
3.2 重组腺病毒载体Ad-EphrinA1-Casp3的构建
构建重组腺病毒系统的策略主要有3种[13]: 体外直接连接(Adeno-X系统)、细菌内重组(Adeasy 系统)和293细胞内重组(AdMax系统)。体外直接连接是传统酶切连接法,效率低,基因组上适于克隆的酶切位点有限,因而限制了其应用。细菌内重组和293细胞内重组是应用同源重组原理,都存在构建复杂,筛选费时,效率低等缺陷,还不能完全避免野生型病毒产生。因此,构建一种简单方便、快速高效获得重组腺病毒的方法一直是腺病毒载体研究的热点和难点。
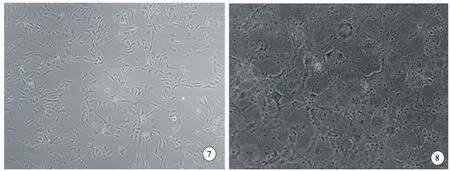
图7 转染pAd-EphrinA1-Casp3前HEK 293细胞形态,倒置显微镜,×100.
图8 收集病毒前HEK 293细胞形态,倒置显微镜,×100.
Fig 7 Morphological observation of HEK 293 before transfection of pAd-EphrinA1-Casp3,inverted microscope,×100.
Fig 8 Morphological observation of HEK 293 before collection of rAd-EphrinA1-Casp3,inverted microscope,×100.

图9 重组腺病毒rAd-EphrinA1-Casp3 PCR产物电泳.
Fig 9 Electrophoresis result of PCR product of the rAd-EphrinA1-caspase-3. M: DNA marker; 1: PCR product of the rAd-EphrinA1-Casp3.
由Invitrogen公司开发的GatewayTM技术是一种通用型克隆方法[14],它基于l噬菌体位点特异性高效重组系统(attL×attR→attB×attP),在LR Clonase Ⅱ酶介导下进行体外重组,attL与attR发生准确的重组反应,形成包含attB、attP位点的产物质粒。本实验将目的基因EphrinA1-caspase-3片段亚克隆到包含两个attL(attLl、attL2)位点的穿梭载体pEC3.1(+)中,形成穿梭质粒pEC3.1-EphrinA1-Casp3;用穿梭质粒和带有两个attR(attRl、attR2)位点的腺病毒骨架载体pAd/pl-DEST(图1),在重组酶作用下体外重组,实质是在pEC3.1-EphrinA1-Casp3中的attL(attLl、attL2)位点与pAd/pl-DEST的attR(attRl、attR2)位点,两特异性位点间发生重组反应,EphrinA1-caspase-3表达框转入pAd/pl-DEST,替换其中的attR基因,反应严格保守,保持方向和开放阅读码框ORF不变,整个反应只需在25℃下持续1h,具有高效性。
该技术还利用ccdB选择方法,穿梭质粒pEC3.1-EphrinA1-Casp3和表达载体pAd/pl-DEST重组时,pAd/pl-DEST中的ccdB被EphrinA1-caspase-3基因取代,生成pAd-EphrinA1-Casp3和带attP的副产品,将这些反应产物转化感受态细胞TOP10,氨苄LB平板只能筛选出带表达克隆pAd-EphrinA1-Casp3的细胞,带attR的表达载体pAd/pl-DEST和带attP反应副产物的细胞都不生长,避免了以往构建方法中复杂的重组子筛选和反复纯化过程,高效率地分离出重组克隆pAd-EphrinA1-Casp3。经包装制备重组腺病毒,缩短了构建周期,提高了构建效率,为下一步在体内、外水平,以重组腺病毒介导目的基因修饰人外周血T淋巴细胞,使之分泌靶向促凋亡蛋白EphrinA1-caspase-3,诱导EphA2阳性乳腺癌细胞凋亡奠定了实验基础,为肿瘤基因治疗提供了一种新策略。
