人精子血管内皮生长因子及其受体2的表达和顶体酶活性的关系❋
2018-10-11马晓萍岳应权高晓勤
马晓萍 岳应权 高晓勤
(遵义医药高等专科学校组织学与胚胎学教研室, 遵义 563006)
男性不育症是由多种疾病和(或)因素造成的结果,其中高达30%~40%的不育患者仍原因不明[1]。由于精液常规检测在精确诊断和预测精子受精能力中存在较大的局限性,随着研究深入,精子糖蛋白和精子内酶学在参与精子获能和精卵识别的过程中的重要作用备受关注[2-4]。研究报道,人的睾丸、附睾、精囊和前列腺组织均存在血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体2(VEGFR2)的表达,且VEGF蛋白在精液中也存在高浓度的表达[5]。VEGF及VEGFR2的特异性表达会影响精子的发生、发育和成熟过程,并与精子的受精能力有关[6]。精子顶体内的顶体酶在精子发生顶体反应、精卵特异结合和使精子穿过透明带等受精过程中起着关键作用[7],测定精子顶体酶活性,是评估精液质量和预测精子受精能力的重要指标[8]。本研究通过对VEGF和VEGFR2在正常生育组和不育组中人精子的表达定位进行研究,同时研究VEGF蛋白的表达量与精子顶体内顶体酶活性的相关性,探讨其在精子受精过程中的重要作用,为男性生殖生理机制的研究和男性不育的临床诊断提供新的理论和实验依据。
1 材料和方法
1.1 主要试剂
Percoll分离液(美国Pharmacia公司);兔抗人多克隆VEGF、VEGFR2抗体(美国Abcam公司);Alexa Fluor®594标记山羊抗兔IgG(北京中山金桥生物技术有限公司);DAPI染色液(武汉博士德生物有限公司);精子细胞BWW培养液(美国Toscience公司);人输卵管液HTF(美国InVitroCare公司);RIPA裂解液和BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);PVDF膜和ECL化学发光试剂盒(Amersham Bioscience公司)
1.2 标本来源及分组
标本采集自贵州医科大学第一附属医院生殖检验中心的就诊者,受检者年龄22~43岁,共92例精液标本(22例正常生育者,70例不育患者)。正常生育组为身体健康、有生育史的正常成年男性,其精液常规各项指标符合WHO规定的正常精液常规标准,精浆及血清抗精子抗体阴性。不育组均为婚后1年以上不育(女方不孕因素已排除),无既往相关病史,生殖器及其附属性腺体检未见异常。依据《WHO人类精液检查与处理实验室手册》诊断标准[9]根据精液参数的不同将不育组分为两组: 正常参数不育组28例(精子浓度>15×106/ml、精子总活力>40%和正常形态精子百分率>4%的不育患者)和异常参数不育组42例(精液常规检查结果异常的不育患者,包括少精子症10例、弱精子症18例和畸形精子症组14例)。所有供精者均禁欲5~7d,手淫方式取精,待完全液化后,采用精子质量检测和计算机辅助系统分析并检测各项指标。
1.3 免疫印迹法检测精子VEGF蛋白表达
精液标本用40∶80梯度的Percoll液(美国Pharmacia公司)进行密度梯度离心分离成熟精子[10]。收集80%层中沉淀的精子,调整精子浓度为2.0×106/ml。取分选后的人精子加入RIPA裂解液提取细胞蛋白,蛋白浓度采用BCA蛋白浓度测定盒进行检测,提取蛋白50μg 经12%SDS-PAGE电泳分离后,转至PVDF膜,5%脱脂奶粉的TBS封闭后加一抗(兔抗人多克隆VEGF抗体,1∶500稀释),4℃缓慢振荡过夜;次日加HRP标记的酶标二抗(1∶10000稀释),室温缓慢振荡2h;TBST液轻摇洗膜后,ECL显影,凝胶成像系统扫描。以目标蛋白积分吸光度与内参蛋白GAPDH吸光度比值,表示蛋白的相对表达量。
1.4 免疫荧光法检测VEGFR2在精子的定位
将获能精子悬液涂于多聚赖氨酸载玻片上,室温干燥后,涂片以3%H2O2孵育30min,1% Triton X-100 浸泡10min;用山羊血清封闭液在湿盒内封闭60min。加一抗(兔抗人多克隆VEGFR2抗体,1∶50稀释),4℃过夜。洗涤后加1∶100稀释的二抗(Alexa Fluor®594标记山羊抗兔IgG)室温孵育1h。洗涤后加入DAPI染色液,漂洗后封片。阴性对照以0.1mol/L (pH7.3)的PBS液代替一抗孵育。用激光共聚焦显微镜(Carl Zeiss LSM710)观察并照相,分别随机选取910个视野摄片并计数精子VEGFR2标记阳性率,每组计数200个精子。
1.5 改良明胶底物膜法检测顶体酶活性(顶体酶阳性反应率、顶体酶活性强度)
取人精子悬浮液50μl涂于改良明胶底物膜片上[4],置于37℃恒温恒湿箱孵育3h,室温下干燥,每份孵育片于Leica DME光学显微镜下均匀选取7~8个视野,随机观察200个精子头部,出现亮环者视为顶体酶阳性,计算顶体酶阳性反应率。采用图像分析测微尺测量视野下每个精子头部亮环直径的大小,取其平均值作为顶体酶活性强度。
1.6 统计学处理

2 结果
2.1 精液常规检测
各组精液常规检测结果比较(表1)显示,异常参数不育组的精子密度、精子活动率和精子正常形态率均明显低于正常生育组(P<0.05);正常参数不育组与正常生育组比较差异无统计学意义(P>0.05)。

表1 正常组和不育各组精子密度、精子活动率和精子正常形态率
*P<0.05vsnormal fertile group
2.2 精子VEGF蛋白的表达
免疫印迹检测结果显示,正常生育组和2个不育组精子多数存在VEGF蛋白的表达,2个不育组与正常生育组相比,VEGF/GAPDH平均光密度均明显低于正常生育组(P<0.05);2个不育组相比,VEGF/GAPDH平均光密度差异没有统计学意义(P>0.05,图1)。

图1 免疫印迹检测VEGF蛋白在精子中的表达(A)及相对表达量(B)
2.3 精子VEGFR2蛋白的定位
正常生育组和不育各组精子涂片用间接免疫荧光染色后在荧光显微镜下观察,正常生育组大部分精子顶体区均有强荧光反应,不育2组部分精子VEGFR2荧光强度减弱,荧光阳性精子数减少。正常参数不育组和异常参数不育组的精子VEGFR2阳性率明显低于正常生育组,差异均有统计学意义(P<0.05,图2)。
2.4 改良明胶底物膜法检测顶体酶活性
2个不育组和的顶体酶阳性反应率和顶体酶活性强度明显低于正常生育组(P<0.05,图3)。
2.5 精子VEGF蛋白表达量、精子VEGFR2阳性率与顶体酶活性
相关性分析提示精子VEGF蛋白表达量与顶体酶活性(顶体酶阳性反应率、顶体酶活性强度)存在正相关性(图2、3),相关系数(r=0.462,0.307;P<0.01);精子VEGFR2阳性率与顶体酶活性(顶体酶阳性反应率、顶体酶活性强度)存在正相关性,相关系数(r=0.750,0.579;P<0.01)。
3 讨论
3.1 精子VEGF及其受体VEGFR2在正常生育组和不育各组中的表达差异
研究表明[5,11-12],VEGF及其VEGFR2在人的睾丸、附睾、精囊和前列腺组织中均有表达且与雄性生殖有关。马莉等[13]证实VEGF及其VEGFR2在附睾特异性表达不仅参与构建精子附睾内成熟的微环境,共同调节附睾微循环的生理功能,还可作为特殊物质在精子的附睾成熟过程中发挥作用。
本研究采用免疫印迹证实VEGF蛋白在不育各组和正常生育组的精子中均有不同程度的表达且不育各组明显低于正常生育组,通过间接免疫荧光清晰显示VEGFR2定位于人精子顶体帽区,正常生育组大部分精子顶体部均有强荧光反应且VEGFR2阳性率较高,不育各组VEGFR2在精子顶体处的荧光强度和阳性率大幅减弱。结果显示: 原因不明不育组虽然各项精液常规参数与正常生育组无显著性差异,但其精子VEGF蛋白表达量及其VEGFR2阳性率却显著低于正常生育组。结果表明,精子VEGF蛋白表达量减少及其VEGFR2阳性率下降可能是精液常规参数正常的不育患者(即原因不明不育患者)生育能力低下的重要原因,而该结果仅从精液常规参数检测中是无法反映出来的。
3.2 精子VEGF及其VEGFR2表达与顶体内顶体酶活性的相关性
Obermair等[14]证实VEGFR2定位于精子表面,并在精子顶体区有强表达。研究表明,VEGF在顶体形成过程中具有重要作用,VEGF的表达伴随精子细胞顶体发育的全过程,可作为顶体发育的重要标志[15]。本研究免疫荧光法检测了VEGF及其VEGFR2在人精子上的表达和定位,结果与上述报道相一致。VEGFR2蛋白表达于人精子顶体区,说明VEGF与VEGFR2特异的结合可能在精子顶体的功能成熟过程中发挥重要作用。
顶体来源于精子细胞的高尔基复合体,在形成过程中合成多种酶和顶体素,精子顶体内释放的顶体酶与顶体膜结构完整程度存在密切关系[16]。顶体膜结构的不完整会影响顶体酶的释放[17],使结合到卵子透明带上的精子不能发生顶体反应,导致精子不能穿透卵子透明带,无法完成受精[18]。由于VEGF及其VEGFR2的表达均与顶体发育成熟密切相关,笔者推测VEGF表达的高低可能会伴随顶体内酶活性的改变,进而共同影响男性生育力。
本研究结果表明不育各组顶体酶活性(顶体酶阳性反应率、顶体酶活性强度)明显低于正常生育组,这与本课题组之前报道相一致[19],说明男性生育力低下与其顶体酶活性减弱有关。本研究证实精子VEGF蛋白表达量及VEGFR2阳性率分别与精子顶体酶活性(顶体酶阳性反应率、顶体酶活性强度)呈正相关。不育各组精子VEGF蛋白表达水平的降低及VEGFR2阳性率的减少伴随精子顶体酶活性(顶体酶阳性反应率、顶体酶活性强度)的下降。结果说明功能成熟的精子具有完整的顶体和较高的顶体酶活性,而精子VEGF蛋白表达量及VEGFR2阳性率下降同时伴随精子顶体成熟障碍和精子顶体酶活性低下,这些均可能导致精子与透明带结合能力下降从而造成男性生育能力低下。
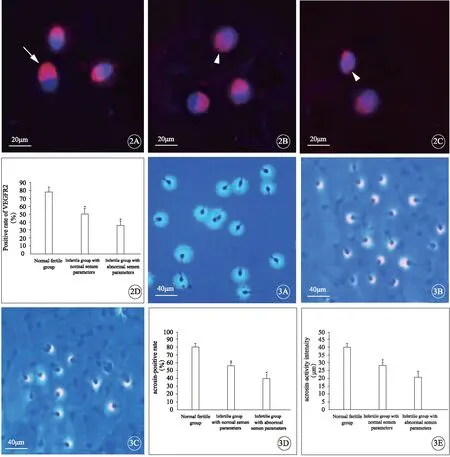
图2 免疫荧光检测精子VEGFR2表达(A~C)及精子VEGFR2表达阳性率(D)。A: 正常生育组;B: 正常参数不育组;C: 异常参数不育组。箭头示VEGFR2在精子顶体的阳性表达;三角形示VEGFR2在精子顶体处的缺失。*P<0.05vs正常生育组.
图3 改良明胶底物膜法检测精子arcosin活性(A~C),精子arcosin阳性反应率(D),精子arcosin活性强度(E),标尺=40μm。A: 正常生育组;B: 正常参数不育组;C: 异常参数不育组。*P<0.05vs正常生育组.
Fig 2 Detection of VEGFR2 expression by immunofluorescent staining (A-C). The positive rate of VEGFR2 on human spermatozoa(D). A: Normal fertile group; B: Infertilie group with normal semen parameters; C: Infertile group with abnormal semen parameters. The arrow showed positive expression of VEGFR2 in sperm acrosome. The triangle showed lack of VEGFR2 in sperm acrosome.*P<0.05vsnormal fertile group.
Fig 3 The acrosin activity was examined by improved fixed-substrate film method (A-C). The acrosin-positive rate on human spermatozoa (D). The acrosin-activity intensity on human spermatozoa (E). Bar=40μm. A: Normal fertile group; B: Infertile group with normal semen parameters; C: Infertile group with abnormal semen parameters.*P<0.05vsnormal fertile group.
在引起男性不育众多的病因中,单独一种精子蛋白的表达量或酶的活性虽然不能作为独立诊断依据,但在不育症者特别是原因不明不育者中,精子VEGF蛋白表达量及VEGFR2阳性率下降并伴随顶体酶活性低下,可能是造成男性不育的一个重要原因。本研究结果表明,VEGF及VEGFR2蛋白的表达伴随顶体发育成熟,分别与精子顶体酶活性呈正相关,说明VEGF与受体结合后,参与顶体发育和功能成熟,精子VEGF及VEGFR2的表达与顶体内酶活性密切相关。因此,在常规精液分析的基础上共同检测与精子功能成熟相关的VEGF及VEGFR2蛋白的表达和顶体酶活性将更有利于综合评价精子受精潜能,为原因不明男性不育症的诊断和治疗提供有效的功能指标和实验依据。
