金雀异黄素对血小板微颗粒诱导的类风湿关节炎成纤维样滑膜细胞迁移和侵袭的影响
2018-10-11柳桂萍王雯雯刘家欢沈维干
沈 芹,柳桂萍,王雯雯,胡 君,周 玮,刘家欢,王 慧,沈维干,张 育,
(1. 扬州大学附属苏北人民医院风湿免疫科,江苏 扬州 225001;2. 泰州市人民医院风湿免疫科,江苏 泰州 225300;3. 江苏省武警总队医院内科,江苏 扬州 225001;4. 扬州大学附属医院血液风湿科,江苏 扬州 225001;5. 扬州大学医学院,江苏 扬州 225001)
类风湿关节炎(rheumatoid arthritis,RA)作为多关节炎症性疾病,其主要的病理改变包括关节滑膜炎及血管炎。关节滑膜细胞分为A型巨噬样滑膜细胞和B型成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS)。FLS位于滑膜衬里层,可向关节软骨表面迁移和侵袭,导致关节软骨及骨的侵蚀,最终引起关节破坏,在RA的发生、发展过程中发挥重要作用[1]。血小板微颗粒(platelet-derived microparticles,PMPs)是血小板活化过程中形成的囊性小泡[2]。我们的前期研究证实,PMPs能够通过ERK/NF-κB通路及CXCR2/NF-κB通路,促进RA-FLS与细胞外基质(extracellular matrix,ECM)的黏附,提高其迁移和侵袭能力[3-4],提示PMPs通过NF-κB信号通路,影响RA-FLS的迁移及侵袭,可能为RA骨侵蚀机制的研究提供了新视角。
金雀异黄素(genistein,Gen)是一种异黄酮类化合物,广泛存在于豆类植物中,具有酪氨酸激酶抑制剂活性[5]。课题组前期研究证实,Gen可抑制肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)等炎症因子的分泌,以及胶原诱导性关节炎(collagen induced arthritis,CIA)大鼠FLS的增殖,同时缓解CIA大鼠关节炎症和关节的损害[6-8]。本实验进一步观察Gen对PMPs诱导的RA-FLS迁移和侵袭的影响,并探讨其可能的机制,为RA治疗的靶点选择提供理论依据,并为临床医师的工作提供参考。
1 材料与方法
1.1试剂与仪器DMEM高糖培养基(HyClone公司);胎牛血清(FBS,Gibco公司);Gen、罗丹明标记的鬼笔环肽(Sigma公司);人纤维连接蛋白(fibronectin,瑞士罗氏公司);Ⅰ型胶原(CollagenⅠ)、Matrigel(美国BD公司);CCK-8(上海生博生物医药科技有限公司);兔抗人NF-κB 、p-NF-κB、p-IκB及鼠抗人IκB单克隆抗体(CST公司);小鼠抗GAPDH单克隆抗体(Santa Cruz公司)。PMPs的制备和鉴定,按本课题组前期建立的方法进行[4]。二氧化碳培养箱(美国Thermo公司);倒置显微镜(日本Olympus公司);垂直电泳槽、电转移槽(Bio-Rad公司);荧光显微镜(日本NIKON公司)。
1.2细胞培养RA-FLS细胞株MH7A购自上海赛齐生物科技有限公司。使用含10% FBS的DMEM高糖培养基培养,置于37 ℃、5% CO2以及饱和湿度条件中,择生长良好的3~6代细胞用于后续实验。
1.3细胞活力检测实验空白组不做任何处理;PMPs组给予100 mg·L-1PMPs处理24 h;另外3组为PMPs+Gen组,在100 mg·L-1PMPs作用24 h后,给予20、40、60 μmol·L-1的Gen干预24 h。将各组细胞接种于96孔板,细胞数量约为每孔5×103个,设置6个复孔,37 ℃、5% CO2条件下培养24 h,按CCK-8试剂盒说明操作,于酶标仪上测量波长450 nm处的OD值,实验重复3次。设定空白组细胞活力为100%,其他各组相对细胞活力=实验组细胞OD值/空白组细胞OD值×100%。
1.4Transwell细胞迁移与侵袭实验
1.4.1迁移实验 空白组细胞密度达90%时,使用无血清培养基饥饿12 h;PMPs组和PMPs+Gen组细胞先后使用含100 mg·L-1PMPs的完全培养基(10% FBS)和含100 mg·L-1PMPs的无血清培养基培养12 h。0.25%胰蛋白酶消化MH7A,室温下1 200 r·min-1离心10 min收集;用低浓度血清培养基(2% FBS)重悬细胞,细胞计数后,制成5×108·L-1的细胞悬液,PMPs+Gen组细胞悬液加入不同浓度的Gen;将上述细胞悬液分别加至Transwell上室,每孔100 μL;在Transwell下室分别加入完全培养基500 μL,其中PMPs+Gen组Transwell下室加入不同浓度的Gen;放入小室培养24 h;取出小室,吸去上室液体,PBS清洗3次,用棉签拭去上室细胞,将小室倒扣晾干;向下室加入快速吉姆萨染色试剂A液,固定2 min,取出小室,加入2倍体积的B液,混匀后染色8 min;PBS洗涤后,于100×倒置显微镜下,随机选取8个视野拍摄,计算每个视野内的细胞数,结果用相对于空白组倍数的均值表示,实验重复3次。
1.4.2侵袭实验 按前述方法处理MH7A;取100 mg·L-1的Matrigel 稀释液100 μL包被小室,37 ℃孵育过夜;吸净残液后,向小室中加入100 μL DMEM培养基,37℃孵育30 min,水化基底膜;其余步骤同迁移实验。
1.5细胞与ECM黏附实验
1.5.1细胞与Collagen Ⅰ、Fibronectin黏附实验 按细胞活力检测实验方法处理细胞;分别取浓度为10 mg·L-1的Collagen Ⅰ、Fibronectin工作液100 μL置于96孔板中,4 ℃过夜;弃上清,加入1% BSA 100 μL,37 ℃封闭1 h;收集细胞,制备2.5×108·L-1的细胞悬液,每孔加入100 μL,设6个复孔,孵育30 min;去上清及PBS洗涤后,每孔加入100 μL无血清培养基和10 μL CCK-8试剂,孵育30 min;用酶标仪测定波长450 nm处的OD值,实验重复3次。
1.5.2细胞与Matrigel黏附实验 类似于“1.5.1”实验,区别为铺胶时,每孔加浓度为100 mg·L-1的Matrigel稀释液50 μL,37 ℃孵育1 h。
1.6细胞免疫荧光染色收集细胞,接种于放有盖玻片的24孔板中,细胞数量约为每孔5×104个,按细胞活力检测实验方法处理细胞;用免疫荧光固定液室温固定30 min;再加入含0.5% Triton X-100的PBS,室温透化细胞10 min;3% BSA室温封闭1 h后,用罗丹明标记的鬼笔环肽染色细胞,室温避光孵育2 h;再以0.5 mg·L-1DAPI室温避光孵育样本15 min;洗涤封片后,在荧光显微镜下观察拍照。
1.7Westernblot检测按细胞活力检测实验处理MH7A后,收集各组细胞进行蛋白提取和浓度测定。按照Western blot常规步骤操作,用Image J软件分析蛋白质免疫印迹图像灰度值。

2 结果
2.1Gen对PMPs作用后RA-FLS的活力无明显影响Fig 1的CCK-8检测结果显示,与空白组比较,PMPs作用后RA-FLS的活力稍有增强;然而,空白组、PMPs组和PMPs+Gen(20、40、60 μmol·L-1)组之间细胞活力比较差异无统计学意义(P>0.05)。
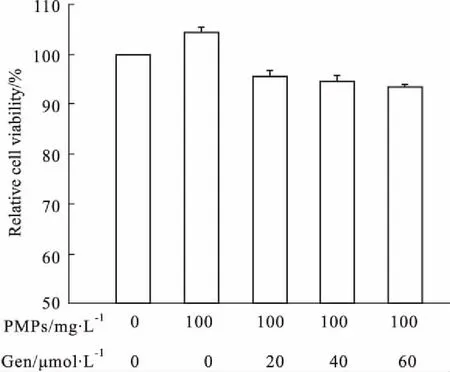
Fig 1 Effects of Gen on cell viability of RA-FLS after incubation with n=3)
2.2Gen抑制PMPs诱导的RA-FLS的迁移和侵袭Fig 2、3的Transwell迁移和侵袭实验结果显示:与空白组相比,PMPs组RA-FLS的迁移和侵袭能力明显增强(P<0.05);相对于PMPs组,PMPs+Gen组RA-FLS的迁移和侵袭能力均有所减弱,PMPs+20 μmol·L-1Gen组与PMPs组相比差异无统计学意义(P>0.05),而PMPs+Gen(40、60 μmol·L-1)组与PMPs组相比差异有统计学意义(P<0.05)。上述结果提示,Gen可抑制PMPs诱导的RA-FLS的迁移和侵袭。
2.3Gen抑制PMPs作用后RA-FLS与ECM的黏附如Fig 4所示,PMPs组RA-FLS与3种不同ECM模拟物的黏附能力高于空白组(P<0.05);而PMPs+Gen组RA-FLS与ECM的黏附能力均低于PMPs组,其中PMPs+ Gen(40、60 μmol·L-1)组与PMPs组相比,差异有统计学意义(P<0.05)。结果
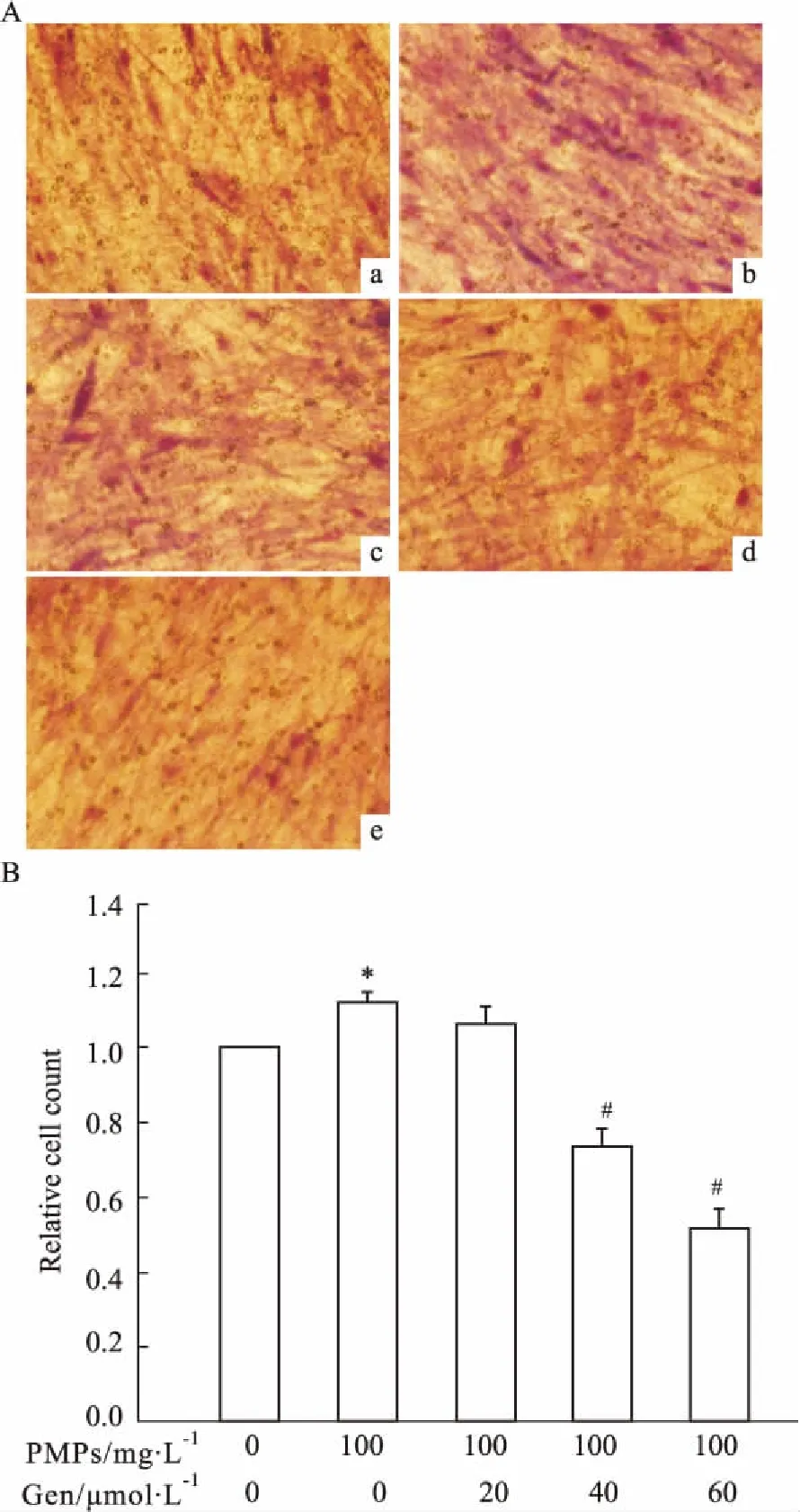
Fig 2 Effects of Gen on migration of RA-FLS induced by PMPs(×200)
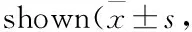
提示,Gen可以抑制PMPs诱导的RA-FLS与ECM的黏附。
2.4Gen影响PMPs诱导的RA-FLS肌动蛋白细胞骨架的重排Fig 5的细胞免疫荧光染色结果显示,与空白组相比,PMPs组RA-FLS的应力纤维明显变细、变少,片状伪足增多;与PMPs组相比,PMPs+Gen组RA-FLS的片状伪足减少,应力纤维增粗。结果提示,PMPs可能通过改变肌动蛋白细胞骨架重塑,促进RA-FLS的迁移和侵袭,而Gen可通过影响RA-FLS的肌动蛋白细胞骨架装配,达到抑制PMPs诱导的RA-FLS迁移和侵袭的作用。
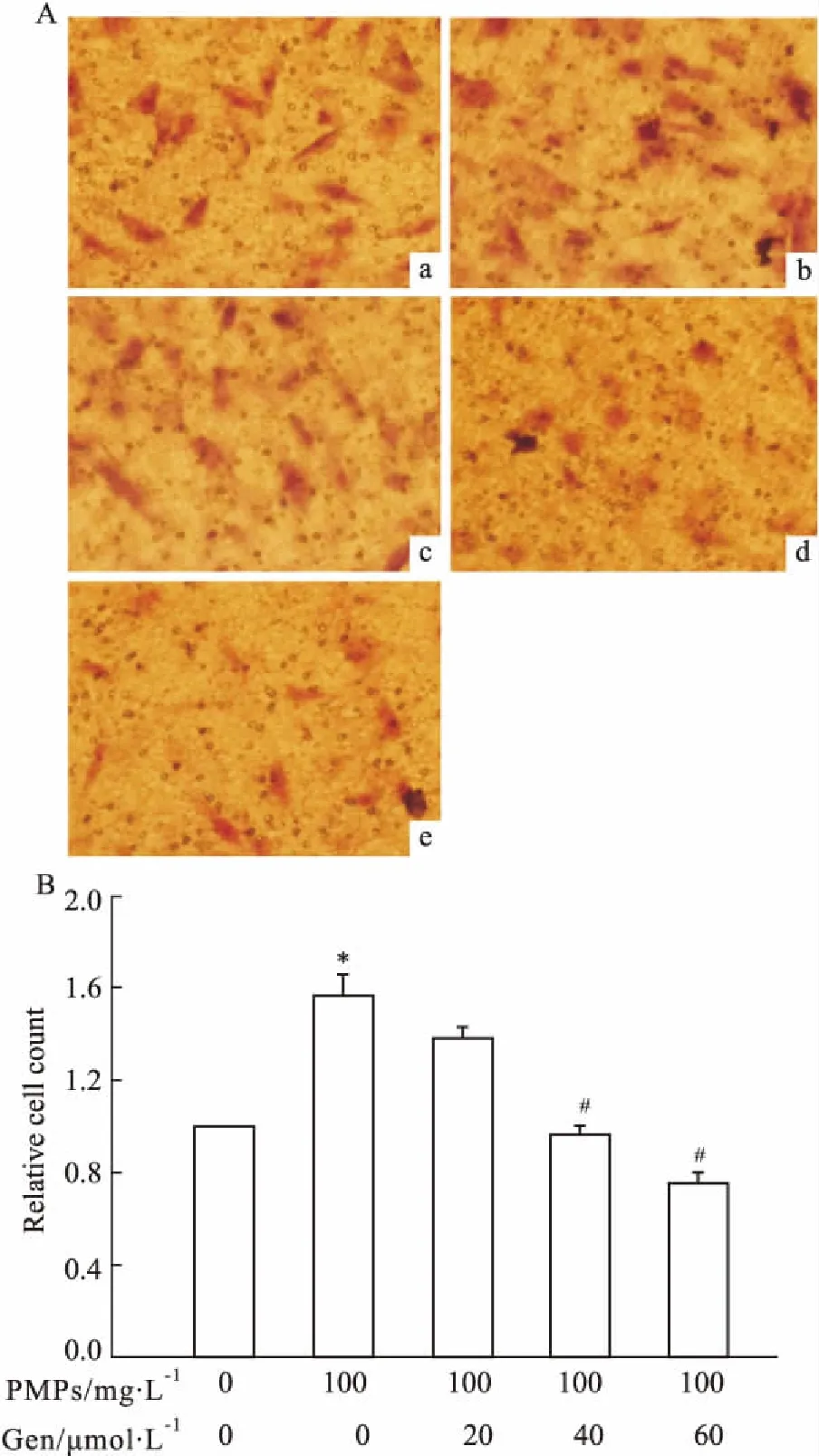
Fig 3 Effects of Gen on invasion of RA-FLS induced by PMPs (×200)
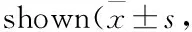
2.5Gen对PMPs激活的RA-FLS中NF-κB通路的影响Fig 6的Western blot结果显示,与空白组相比,PMPs可上调RA-FLS中p-IκB和p-NF-κB的表达;与PMPs组相比,PMPs +Gen组RA-FLS中p-IκB和p-NF-κB的表达下调。提示Gen可抑制PMPs激活的NF-κB信号通路,从而进一步抑制RA-FLS的迁移和侵袭。
3 讨论
RA的病理特征包括关节滑膜炎及滑膜衬里层增生,FLS的增殖和向关节软骨表面迁移和侵袭在RA病程的演变、炎症的维持以及软骨与骨的破坏等过程中,都发挥了重要作用[1,9-10]。
Fig 4 Effects of Gen on adhesion to ECM of
*P<0.05vscontrol group;#P<0.05vsPMPs group
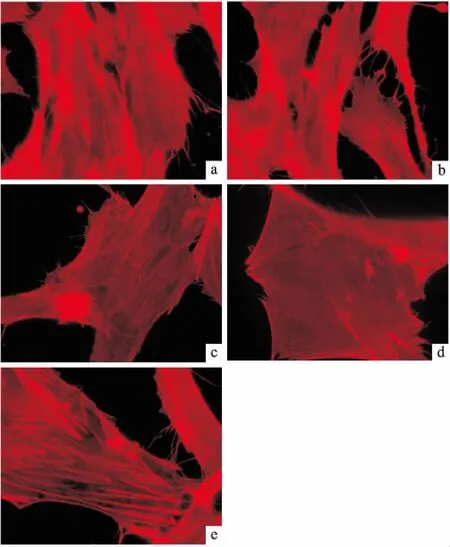
Fig5EffectsofGenonactincytoskeletonrearrangementofRA-FLSinducedbyPMPs(×1000)
A: Control group; b: PMPs group; c: PMPs+20 μmol·L-1Gen group; d: PMPs+40 μmol·L-1Gen group; e: PMPs+60 μmol·L-1Gen group.
本课题组为明确Gen对PMPs诱导的RA-FLS迁移和侵袭的作用,首先采用CCK-8试剂盒检测各组细胞的活力,发现PMPs +Gen组细胞活力相较于空白组和PMPs组,差异均无统计学意义,排除了Gen对细胞活力的影响导致的迁移和侵袭能力改变的可能性。然后,本研究通过Transwell细胞迁移和侵袭实验,观察Gen对PMPs诱导的RA-FLS迁移和侵袭的影响。结果表明,PMPs组RA-FLS的迁移和侵袭能力高于空白组,而PMPs +Gen组RA-FLS迁移和侵袭的能力较PMPs组有所减弱。上述结果提示,在PMPs作用的基础上,Gen能够抑制PMPs诱导的RA-FLS的迁移和侵袭。在细胞迁移和侵袭的
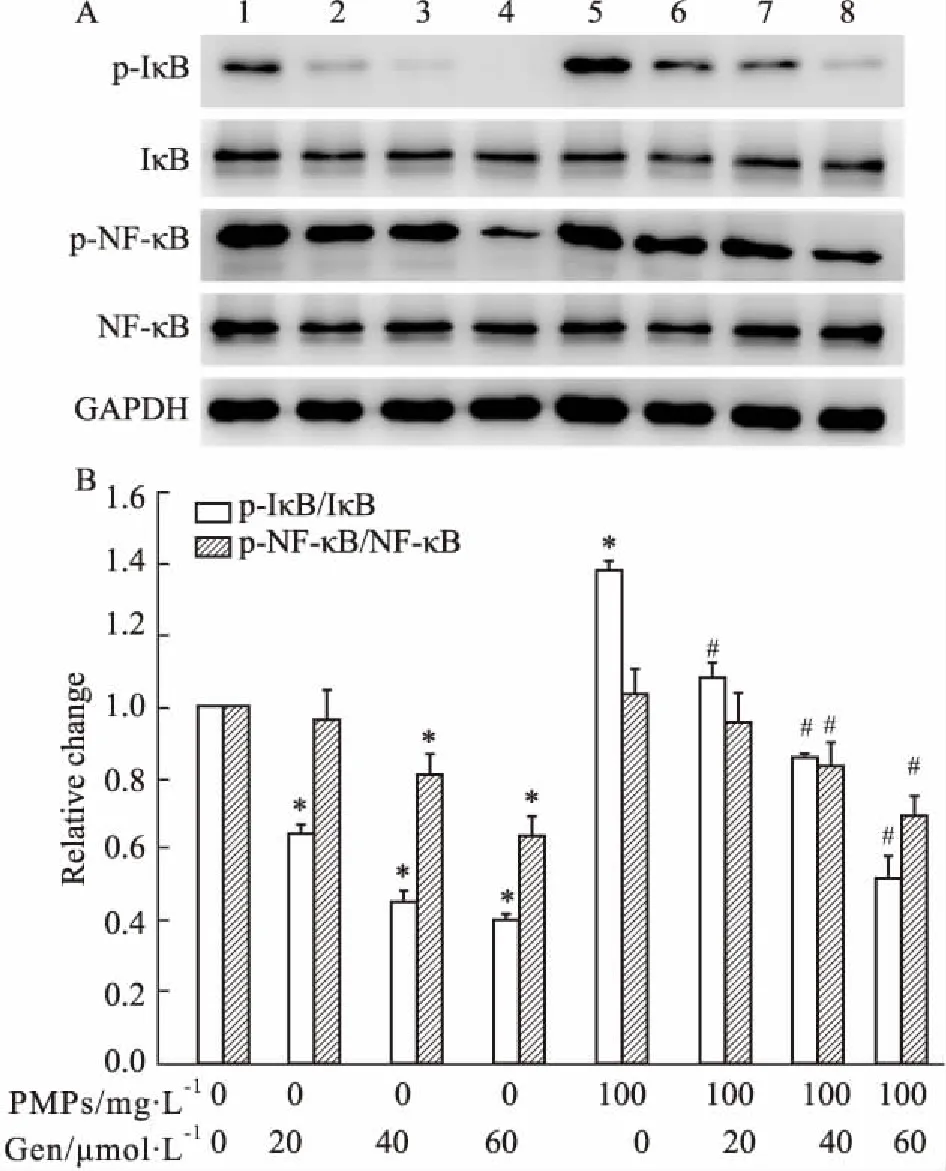
Fig 6 Effects of Gen on NF-κB pathway of RA-FLS activated by PMPs n=3)
1: Control group; 2: 20 μmol·L-1Gen group; 3: 40 μmol·L-1Gen group; 4: 60 μmol·L-1Gen group; 5: PMPs group; 6: PMPs+20 μmol·L-1Gen group; 7: PMPs+40 μmol·L-1Gen group; 8: PMPs+60 μmol·L-1Gen group.*P<0.05vscontrol group;#P<0.05vsPMPs group.
过程中,由于细胞必须先从黏附的ECM上脱落,然后再于新部位的黏附,因此,细胞与ECM黏附的改变是细胞发生迁移和侵袭的前提[11-12]。我们分别以CollagenⅠ、Fibronectin和Matrigel 作为ECM模拟物,观察Gen对PMPs作用后RA-FLS与ECM 黏附的影响。结果表明,PMPs可促进RA-FLS与3种不同ECM的黏附,加入Gen后,PMPs诱导的RA-FLS与ECM类似物的黏附能力均下降, 提示Gen可以抑制PMPs诱导的RA-FLS与ECM的黏附。
有研究表明,Gen可通过重构细胞中肌动蛋白细胞骨架,减少伪足的形成,抑制肿瘤细胞与ECM的黏附、迁移和侵袭[12-13]。我们采用罗丹明标记的鬼笔环肽对RA-FLS的纤维状肌动蛋白(filament actin, F-actin)骨架系统进行免疫荧光染色,观察PMPs和Gen对RA-FLS的肌动蛋白细胞骨架装配的影响。结果显示,PMPs作用于RA-FLS后,RA-FLS的应力纤维明显变细、变少,片状伪足增多,提示PMPs可能通过改变肌动蛋白细胞骨架的重塑,促进RA-FLS的迁移和侵袭。在PMPs作用的基础上加入Gen后,RA-FLS的应力纤维增粗,片状伪足减少,提示Gen可通过影响RA-FLS的肌动蛋白细胞骨架装配,达到抑制PMPs诱导的RA-FLS迁移和侵袭的作用。
NF-κB作为重要的核转录因子,与细胞的增殖、黏附、迁移和侵袭密切相关,而NF-κB通路的活化能够提高肿瘤细胞的迁移和侵袭能力[14-15]。本课题组前期工作已证实,PMPs可通过活化NF-κB通路,促进RA-FLS的迁移和侵袭[3-4]。为进一步观察Gen对PMPs激活的RA-FLS中NF-κB通路的影响,本研究采用Western blot检测NF-κB信号通路组分蛋白的表达。结果显示,与对照组相比,PMPs可上调RA-FLS中p-IκB和p-NF-κB的表达,而对IκB、NF-κB无明显影响;与PMPs组相比,PMPs +Gen组RA-FLS中IκB和NF-κB的磷酸化受到抑制,提示Gen可抑制PMPs激活的NF-κB信号通路,从而进一步抑制RA-FLS的迁移和侵袭。
综上所述,Gen可通过抑制PMPs激活的NF-κB信号通路,影响RA-FLS的肌动蛋白细胞骨架装配,从而抑制PMPs诱导的RA-FLS与ECM的黏附、迁移和侵袭。本研究揭示了Gen在PMPs诱导的RA-FLS迁移和侵袭过程中的作用及其机制,为寻找RA的药物靶点和机制研究提供了方向。