氧化对肌原纤维蛋白热诱导凝胶质构特性及保水性的影响
2018-10-11杨玉玲周磊游远汤晓智魏苏萌
杨玉玲,周磊,游远,汤晓智,魏苏萌
氧化对肌原纤维蛋白热诱导凝胶质构特性及保水性的影响
杨玉玲,周磊,游远,汤晓智,魏苏萌
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
【目的】研究氧化对肌原纤维蛋白(myofibrillar proteins,MP)凝胶质构和保水性的影响,探讨凝胶特性随蛋白质氧化程度变化的根本原因,为MP凝胶特性控制和鸡肉制品的质量控制提供理论依据。【方法】活鸡屠宰,取鸡胸肉提取MP。利用质构仪研究在脂肪氧化酶-亚油酸体系中蛋白质氧化对MP凝胶质构的影响;用高速离心机测定凝胶保水性;用拉曼光谱法测定I760和I850/I830表示MP凝胶的疏水作用力和氢键,Zeta电位法测定电位值代表静电斥力;通过总巯基含量的变化反应二硫键的变化;通过扫描电镜观察凝胶的超微结构;通过氨基酸分析仪研究氧化对MP氨基酸含量的影响。【结果】在脂肪氧化酶-亚油酸-MP体系中,随着亚油酸浓度增加,MP中羰基含量逐步增加,氧化程度逐渐增高。亚油酸含量从0增加到2 mmol·L-1时,凝胶硬度和保水性均逐渐增加到最大值,而后随亚油酸浓度增加均逐渐下降;凝胶弹性在低氧化程度下略有增加,但随着氧化程度继续增加而逐渐降低;亚油酸浓度为2 mmol·L-1时,MP凝胶结构致密,多孔且孔径均一。高度氧化的MP凝胶孔径变大,空隙增多,胶束不均匀。随着氧化程度升高,拉曼光谱的I760在2 mmol·L-1处达到最大值,表明疏水相互作用力在此处达到最大。Ser, Glu和Cys 3种氨基酸残基能够形成MP分子内氢键,这3种氨基酸含量随着氧化程度的升高而降低,同时拉曼光谱的I850/I830随氧化程度的升高而增加,最终大于1.25,表明MP分子间的氢键随着氧化程度的升高而减少。解离后带负电荷的Glu含量随氧化程度升高而降低,导致Zeta电位绝对值下降,表明静电相互作用随氧化程度增加而减弱。Cys的巯基在凝胶形成过程中能够形成二硫键,其含量随氧化程度的升高而降低,导致总巯基含量同向变化,表明氧化过程中二硫键生成。疏水性氨基酸(Ala,Met,Val,Leu,Ile和Phe)的总量随氧化程度升高而变化,在亚油酸为2 mmol·L-1处达到最大值,这为疏水作用力在2 mmol·L-1处达到最大值提供了证据。主成分分析表明疏水相互作用对脂质酶氧化体系下MP凝胶特性起决定性作用。【结论】适度氧化有助于改善MP凝胶的特性,在脂肪氧化酶-亚油酸体系中,亚油酸浓度为2 mmol·L-1时,MP凝胶的硬度和保水性都获得最大值。其原因为氧化作用改变MP的组成和疏水作用力,在亚油酸2 mmol·L-1时,MP分子中疏水性氨基酸总量最高,疏水作用力最大,形成的凝胶微观结构均匀致密,因此MP凝胶的质构和保水性均获得最大值。
肌原纤维蛋白;凝胶特性;氧化;氨基酸;蛋白质分子作用力
0 引言
【研究意义】在肉品贮藏和加工中常常发生脂肪氧化,脂肪氧化产生的自由基能导致肌原纤维蛋白(MP)同时氧化,引起蛋白质凝胶特性发生改变,进而引起肉制品感官品质如硬度、弹性、黏性等发生改变[1-2]。研究氧化对MP凝胶特性的影响,揭示氧化对MP凝胶特性影响的根本原因,能为MP凝胶特性控制和鸡肉制品的质量控制提供理论依据。【前人研究进展】有报道认为氧化导致蛋白质凝胶强度和保水性显著下降。DECKER等[3]研究了离子催化氧化体系对火鸡肉白肌MP的凝胶质构和保水性的影响,发现蛋白质氧化过程中凝胶强度和保水性都显著下降。BERTRAM等[4]对氧化处理的猪肉MP研究发现,随着氧化程度的增加(H2O2浓度的增加),蛋白质的保水性降低。但也有报道认为温和氧化有利于提高其凝胶特性并导致保水性增加。SNIDER等[5]发现温和氧化有利于蛋清蛋白的聚集,提高其凝胶特性。SRINIVASAN等[6]冷冻储藏牛肉糜后发现冷冻促进了其蛋白和脂肪氧化,凝胶弹性也增大。XIONG等[7]也发现适度氧化的样品拥有更好的弹性和更均匀细腻的凝胶微观结构。KELLEHER等[8]研究发现在水溶性和脂溶性抗氧化剂混合的肉糜体系中,保水性随着氧化程度的升高而增加。MP凝胶作用力决定其凝胶特性,疏水作用力、静电作用力和氢键是影响此凝胶性质的主要作用力,二硫键的作用较小[9]。ZHANG等[10]和WANG等[11]用拉曼光谱法研究了MP凝胶的疏水作用力和氢键。【本研究切入点】虽然氧化对MP凝胶特性的影响已有一些报道,但结果却是矛盾的。其原因是采用的氧化体系不同,与FeCl3+H2O2氧化体系相比,采用亚油酸-脂肪氧化酶体系进行研究更接近氧化发生的实际情况。脂肪氧合酶是脂肪氧化的一种重要方式,氧化过程中会产生自由基和含羰基的化合物,后者进而氧化MP,但利用亚油酸-脂肪氧化酶体系研究氧化对MP凝胶特性影响原因却未见报道。【拟解决的关键问题】借助脂肪氧化酶-亚油酸氧化体系产生自由基使MP发生不同程度的氧化,研究蛋白质氧化对MP凝胶的质构特性和保水性的影响。通过研究氧化对MP凝胶特性、作用力(疏水相互作用、氢键、静电相互作用和二硫键)和分子组成的影响,从分子水平上揭示MP氧化对其凝胶特性影响的根本原因。
1 材料与方法
试验于2017年6—11月在南京财经大学进行。
1.1 主要材料与试剂
40日龄的活AA鸡(母鸡和公鸡各半),购于南京江宁西北村养鸡场,就地屠宰后取鸡胸肉,运输途中加冰保管,储存于-18℃下并在1个月内使用。
脂肪氧化酶LOX 1000 000单位/mL和亚油酸色谱纯,含量≥99.0%均购于Sigma公司。
其他化学试剂均为分析纯。
1.2 主要仪器与设备
PHS-3C型pH计,上海精密科学仪器有限公司;Beckman Avanti J-26 XP落地式高速冷冻离心机,美国贝克曼库尔特公司;DS-1高速组织捣碎机,上海标本模型厂;TA. XT. Plus. 质构仪,英国Stable Micro System公司;TM 3000 扫描电子显微镜,日本日立公司;LABRAM 800型激光拉曼谱仪,法国Jobin Yvon公司;Zetasizer Nano ZS Zeta电位分析仪,英国马尔文公司;U-3900紫外分光光度计,日本日立公司;L-8900型全自动氨基酸分析仪,日本日立公司。
1.3 试验方法
1.3.1 MP的提取 冷冻鸡胸肉在4℃下解冻20 min,剔除脂肪和结缔组织,切碎后参照XIONG等[12]的方法提取MP,提取的蛋白质在4℃下保存,3 d内用完。
1.3.2 MP的氧化处理及凝胶的制备 取适量MP,用磷酸盐缓冲液(0.6 mol·L-1KCl、0.01 mol·L-1KH2PO4,pH 6.0)配制60、25、1 mg·mL-1的MP溶液,向其中分别加入0、0.2、1、2、4、10 mmol·L-1亚油酸溶液,分别加入5 000单位/mL脂肪氧化酶,在4℃下氧化24 h,用1 mmol·L-1EDTA终止氧化,得到经过氧化处理的MP溶液[13]。
氧化处理后的MP样品水浴加热至70℃(1℃·min-1)制成凝胶,保温20 min,取出后自然冷却,4℃保存16 h后备用。25 mg·mL-1的MP凝胶用于质构特性、保水性和微观结构测定。1 mg·mL-1的MP凝胶用于静电相互作用和巯基含量的测定。60 mg·mL-1的MP凝胶用于拉曼光谱测定氢键和疏水相互作用。
1.3.3 MP羰基含量的测定 羰基含量的测定参照LEVINE等[14]的方法并略作修改,在离心管中加入0.5 mL蛋白溶液(25 mg·mL-1)和2 mL 2, 4-二硝基苯肼溶液(10 mmol·L-1),在室温下反应40 min,对照组只加入2 mL不含2, 4-二硝基苯肼的2 mol·L-1HCl,不再添加之后步骤的试剂。向离心管中加入2.5 mL 20%的TCA(三氯乙酸),振荡后离心(11 000×,5 min),弃上清,用2 mL乙醇-乙酸乙酯溶液(体积比1﹕1)清洗蛋白沉淀3次,除去未反应的试剂。加6 mol·L-1盐酸胍6 mL溶解蛋白沉淀。在37℃下放置30 min,空白组作为对照,测定370 nm处吸光值,使用摩尔吸光系数2.2×104mol·L-1·cm-1计算羰基衍生物含量(μmol·g-1protein)。
1.3.4 质构特性的测定 用质构仪按照杨玉玲等[15]的方法和条件测定MP热诱导凝胶的硬度和弹性。参数如下:P/6探头,测试前速度5 mm·s-1,测试中速度1 mm·s-1,测试后速度5 mm·s-1,探头探入距离为10 mm。每个样品重复3次。
1.3.5 保水性的测定 用高速冷冻离心机参照KOCHER等[16]的方法进行测定。将氧化后的MP凝胶和离心管称重(W1),于4℃下离心(10 000×,15 min),除上清液后称量离心管和凝胶的重量(W2),空离心管的质量为W。根据下列公式计算凝胶保水性WHC(%)=(W2-W)/(W1-W)×100。每个处理3次重复。
1.3.6 微观结构的观察 将凝胶切块,用戊二醛固定3 h,清洗,利用乙醇(50%,70%,90%,95%和100%)梯度脱水,每个浓度处理30 min。再用叔丁醇置换,冷冻干燥,镀膜后用扫描电镜(SEM)观察微观结构,扫描电镜加速电压15 kV。
1.3.7 激光拉曼光谱法测试 按照ZHANG等[17]的方法和条件用拉曼光谱仪测定MP凝胶的疏水相互作用和氢键作用。激光波长:514.5 nm;激光出射功率:10 mw(照到样品上约4 mW);显微物镜:50倍长焦距;光栅:600;狭缝(Hole):200 μm;积分时间:60 s;重复3次累加得谱。用I760 cm-1处强度反映MP凝胶的疏水相互作用[18]。I850/I830值反映MP凝胶的氢键变化[19]。
1.3.8 Zeta电位法测试 MP凝胶的静电斥力用样品的Zeta电位表示。将1 mg·mL-1的MP凝胶样品注入Zeta电位皿后,盖上塞子,勿留气泡,进行Zeta电位测试。测试参数:散射角90°,平衡时间60 s,测试温度25℃。每个梯度重复3次。
1.3.9 MP巯基含量的测定 采用ELLMAN法[20]测定MP凝胶的总巯基和活性巯基含量。将0.5 mL MP样品(1 mg·mL-1)依次与4.5 mL缓冲液(由0.01 mol·L-1EDTA,8 mol·L-1尿素和0.1 mol·L-1K2HPO4配制而成,pH 6.0)、100 µL Ellman试剂(由10 mmol·L-1DTNB和0.01 mol·L-1KH2PO4缓冲液配制而成,调pH为6.0)混合,使用旋涡振荡约1 min,使溶液混合充分,在室温、避光条件下静置25 min,用紫外分光光度计于412 nm下测定吸光值,摩尔消光系数设为1.36×10-4mol·L-1·cm-1,巯基含量用nmol·mg-1protein表示。每个样品测定3次。
用不含尿素的缓冲液以同样的方法测定样品中活性巯基的含量。
1.3.10 MP氨基酸含量测定 氨基酸含量测定的方法参照PARK等[21]并做部分修改。称取一定量的MP凝胶于10 mL玻璃水解管中,加入6 mol·L-1的盐酸,在氮气环境下完全水解并浓缩,用0.02 mol·L-1的盐酸溶解后,以15 000 r/min离心5 min,得上清液备用。取适量上清液通过0.22 μm滤器过滤,采用氨基酸自动分析仪进行氨基酸组分分析。
1.4 统计分析
用SPSS17.0软件进行方差分析和主成分分析。
2 结果
2.1 氧化对MP羰基含量的影响
图1反映了氧化条件下MP羰基含量的变化。在脂肪氧化酶-亚油酸-MP体系中,随着亚油酸浓度的增加,羰基含量不断增加,并最终达到2.96 μmol·g-1protein,这表明MP氧化程度随亚油酸含量增加而逐渐升高。
蛋白质在氧化过程中,羰基基团的引入是蛋白质氧化过程中的明显变化,其含量可作为蛋白质氧化指标[22]。蛋白质分子自身结构中不含有天然存在的羰基,但是蛋白质氧化能够将羰基基团引入到蛋白质分子,在脂肪氧化酶-亚油酸氧化体系下,蛋白质分子与脂质氧化二级产物以及自由基结合,肽骨架的断裂,氨基酸侧链的直接氧化,这些都会导致羰基的产生。随着亚油酸浓度的增加,羰基含量逐渐升高,说明蛋白质氧化程度越来越高。
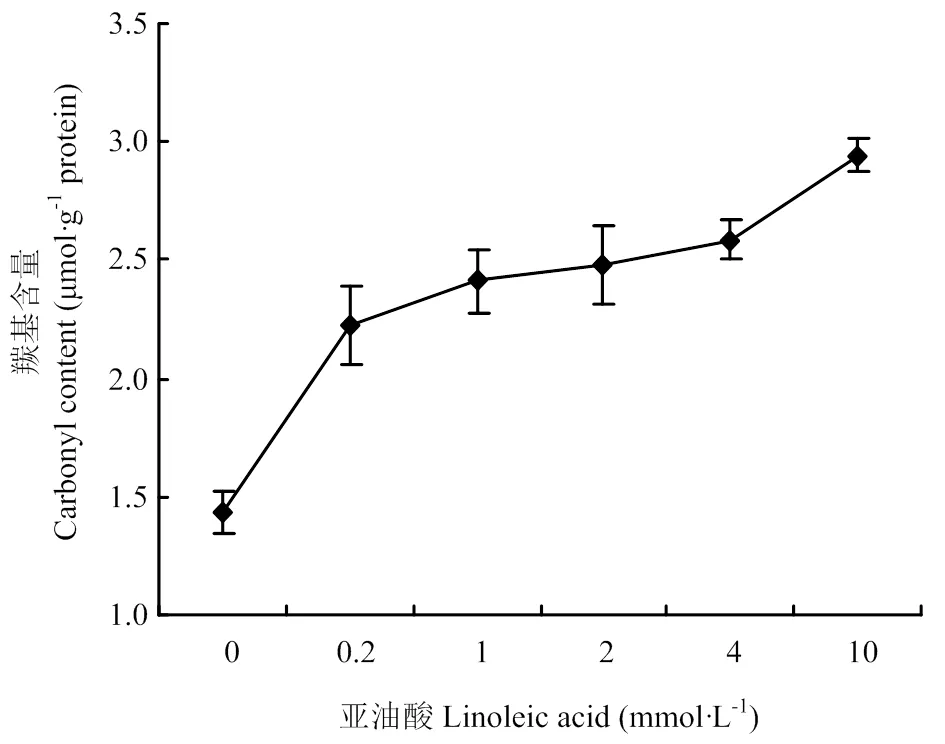
图1 氧化对MP羰基含量的影响
2.2 氧化对MP凝胶质构特性的影响
图2反映了不同氧化程度下MP凝胶硬度和弹性的变化。凝胶硬度随亚油酸浓度增加呈现先升高后降低的趋势,在2 mmol·L-1时达到最大值。亚油酸含量从0增加到2 mmol·L-1时,MP凝胶硬度从10.50 g增加到最大值12.95 g,与对照组相比,凝胶硬度增加了21.9%;随着亚油酸浓度继续增加,凝胶硬度迅速下降,在亚油酸10 mmol·L-1处下降到8.23 g,比对照组降低了21.6%。凝胶弹性在亚油酸含量为0.2 mmol·L-1时比对照组略有增加,之后随着氧化程度继续增加,弹性逐渐降低,在10 mmol·L-1处达到最低值,比对照组的凝胶弹性降低了64.3%。表明在脂质酶氧化体系下,低程度氧化改善了MP凝胶的硬度;高浓度氧化会降低MP凝胶的硬度和弹性,削弱MP凝胶的形成能力。
2.3 氧化对MP凝胶保水性的影响
如图3所示,在0—0.2 mmol·L-1亚油酸浓度的低氧化程度下,MP凝胶的保水性变化不大;随着亚油酸浓度增加(0.2—10 mmol·L-1),氧化程度升高,保水性呈现出先增加后降低的趋势;当亚油酸浓度为2 mmol·L-1时,保水性到达最大值,然后再降低。表明适度氧化能改善凝胶的持水性。

图2 氧化对MP凝胶硬度和弹性的影响
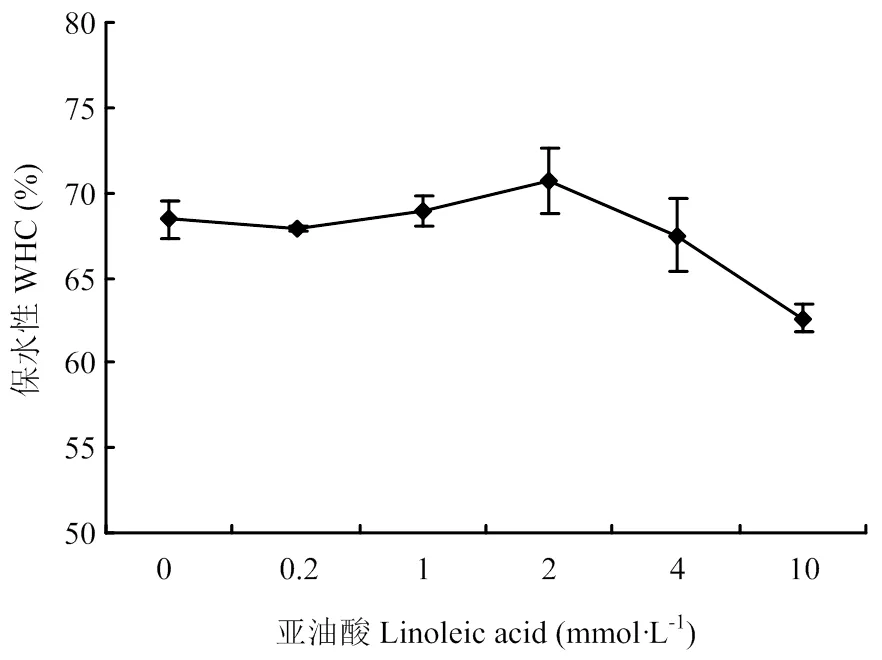
图3 氧化对MP凝胶保水性的影响
2.4 氧化对MP凝胶微观结构的影响
不同氧化程度的MP凝胶结构有明显区别(图4)。未经过氧化处理的MP凝胶孔隙比较均匀、网络结构也比较致密;随着氧化程度的增加(0.2—2 mmol·L-1),凝胶网络结构越来越致密,亚油酸浓度为2 mmol·L-1时形成的凝胶网络最为均匀细腻,孔径均一,呈现“蜂窝状”胶束。而随着氧化程度继续增大(2— 10 mmol·L-1),网络结构变少,凝胶孔径增大,胶束不均匀,形成大小不一的蛋白质胶束。亚油酸浓度为10 mmol·L-1时形成的凝胶网络均匀性最差,孔径变大,空隙增多。因此在亚油酸浓度为2 mmol·L-1处MP凝胶的网络结构最佳。
2.5 拉曼光谱测试结果
2.5.1 氧化对MP凝胶疏水作用力的影响 拉曼光谱760 cm-1处色氨酸环伸缩振动反映了MP凝胶的疏水相互作用[18]。如图5所示,随着氧化程度的升高,MP凝胶760 cm-1处归一化强度(I760)随着亚油酸浓度的增加先升高后降低,在2 mmol·L-1处达到最大值,表明疏水相互作用先增加(0—2 mmol·L-1),然后随着氧化程度进一步增强而降低,这说明随着氧化程度的增加,疏水作用力先增加后降低,在2 mmol·L-1处获得最大值。由此可知,低程度氧化可增大MP凝胶的疏水作用力,但高程度氧化减弱了MP凝胶的疏水作用力。
2.5.2 氧化对MP凝胶氢键的影响 在图6中,未经氧化处理的对照样I850/I830比值为0.98;随着亚油酸含量增加,I850/I830比值快速增加;当亚油酸含量大于2 mmol·L-1时,I850/I830比值大于1.25。这表明,在对照组中,酪氨酸上-OH既与水形成氢键又与蛋白质上其他中性基团形成氢键。但随着氧化程度增加,蛋白质分子间氢键逐渐解体,到达2 mmol·L-1时,酪氨酸上的-OH完全暴露在水环境中,与溶剂水分子生成氢键,也就是说MP分子间的氢键作用随着氧化程度的升高而减少。
2.6 氧化对MP凝胶静电相互作用的影响
Zeta电位与分散体系凝结的稳定性密切相关,可用于体现胶体粒子之间的静电相互作用[23-24]。通常蛋白质分子表面带净负电荷,静电相互作用表现为斥力,Zeta电位值为负值。当溶液中存在的胶粒携带了大量正或负电荷,即Zeta电位的绝对值较大时,胶粒间斥力占优势,不会发生絮凝。但当胶粒的Zeta电位绝对值较低时,粒子会相互接近并发生絮凝。

图4 氧化对MP凝胶微观结构的影响

图5 归一化的760 cm-1处条带强度随亚油酸浓度的变化

图6 归一化的I850/I830强度随亚油酸浓度的变化
在图7中,Zeta电位绝对值随着亚油酸浓度的增加而降低,表明静电相互作用随着氧化程度的增加而减弱。氧化引起蛋白质分子结构的变化,影响蛋白表面电荷,即导致Zeta电位的变化。MP分子中的某些基团会与水分子结合,如带电基团与水分子进行离子-偶极相互作用,Asn、Gln上的酰胺基团,Thr、Tys、Ser残基的-OH以及肽键进行偶极-偶极相互作用,非极性残基也能与水分子进行偶极-诱导-偶极相互作用。如带正电荷的赖氨酸与自由基和醛类物质反应生成中型的羰基衍生物[25]。Zeta电位的下降可能是由于随着氧化程度的增加,包埋的带电荷的氨基酸残基暴露出来,与氧化产物反应,生成电中性的其他物质,导致了Zeta电位的降低。
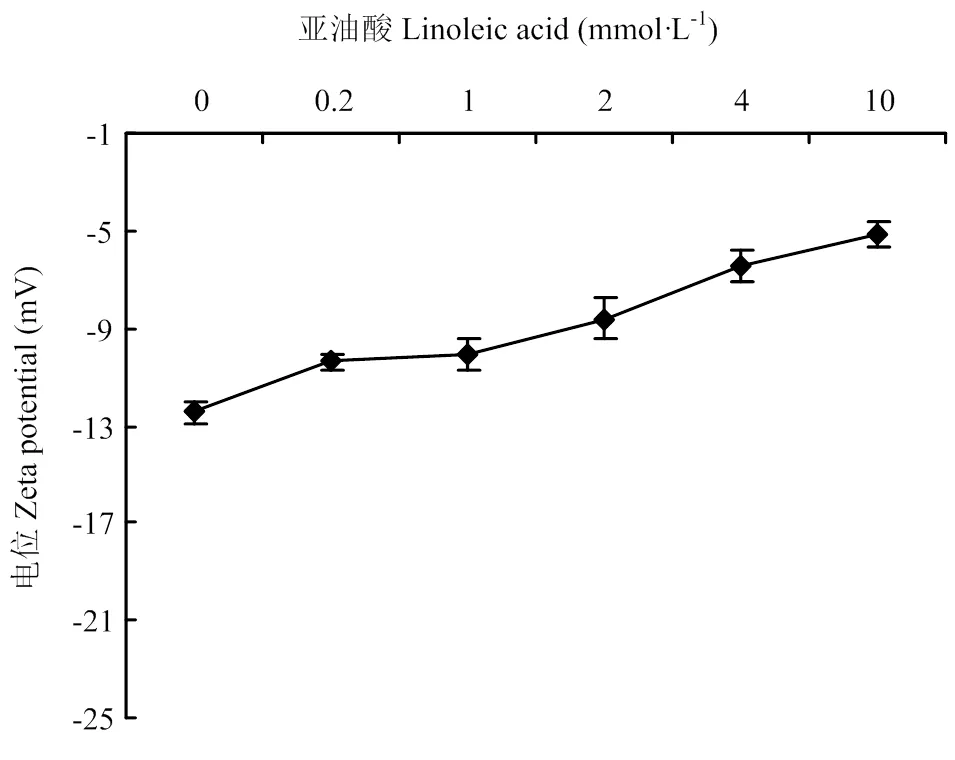
图7 Zeta电位随亚油酸浓度的变化
2.7 氧化对巯基含量的影响
蛋白质中包含的巯基有两种形式,一种是暴露于蛋白质表面的,另一种是包埋在蛋白质内部的。总巯基包括以上二者,而活性巯基只包括前者[26]。可认为总巯基含量的减少代表二硫键的生成[27]。
如图8所示,随着亚油酸浓度的升高,总巯基含量和活性巯基含量均呈现降低的趋势。在亚油酸浓度为10 mmol·L-1时,总巯基和活性巯基含量最低,表明氧化过程中二硫键不断生成。二硫键在MP凝胶形成以及维持凝胶功能特性和结构方面起着重要作用[28-29]。加热时MP分子展开,暴露出内部的巯基与疏水基团,巯基反应生成二硫键,疏水基团聚集,形成具有一定强度的三维网络结构,有助于稳定其中的脂质和水分,形成更好的凝胶网络结构,增加凝胶强度。
2.8 氧化对MP分子氨基酸含量的影响
表1中,Cys的含量随着氧化程度的升高而降低,Cys的巯基在凝胶形成过程中能够形成二硫键;侧链疏水性最强的3种氨基酸Leu,Ile和Phe的含量随氧化程度的变化不显著;但疏水性氨基酸(Ala,Met,Val,Leu,Ile和Phe)总量变化显著,并且最大值发生在亚油酸浓度为2 mmol·L-1处。Ser,Glu和Cys 3种氨基酸残基能够形成MP分子内氢键,这3种氨基酸的含量随着氧化程度的升高而降低。正电荷的氨基酸Lys,Arg和His随氧化程度变化不显著,但是解离后带负电荷的Glu含量随着氧化程度的升高而减少。
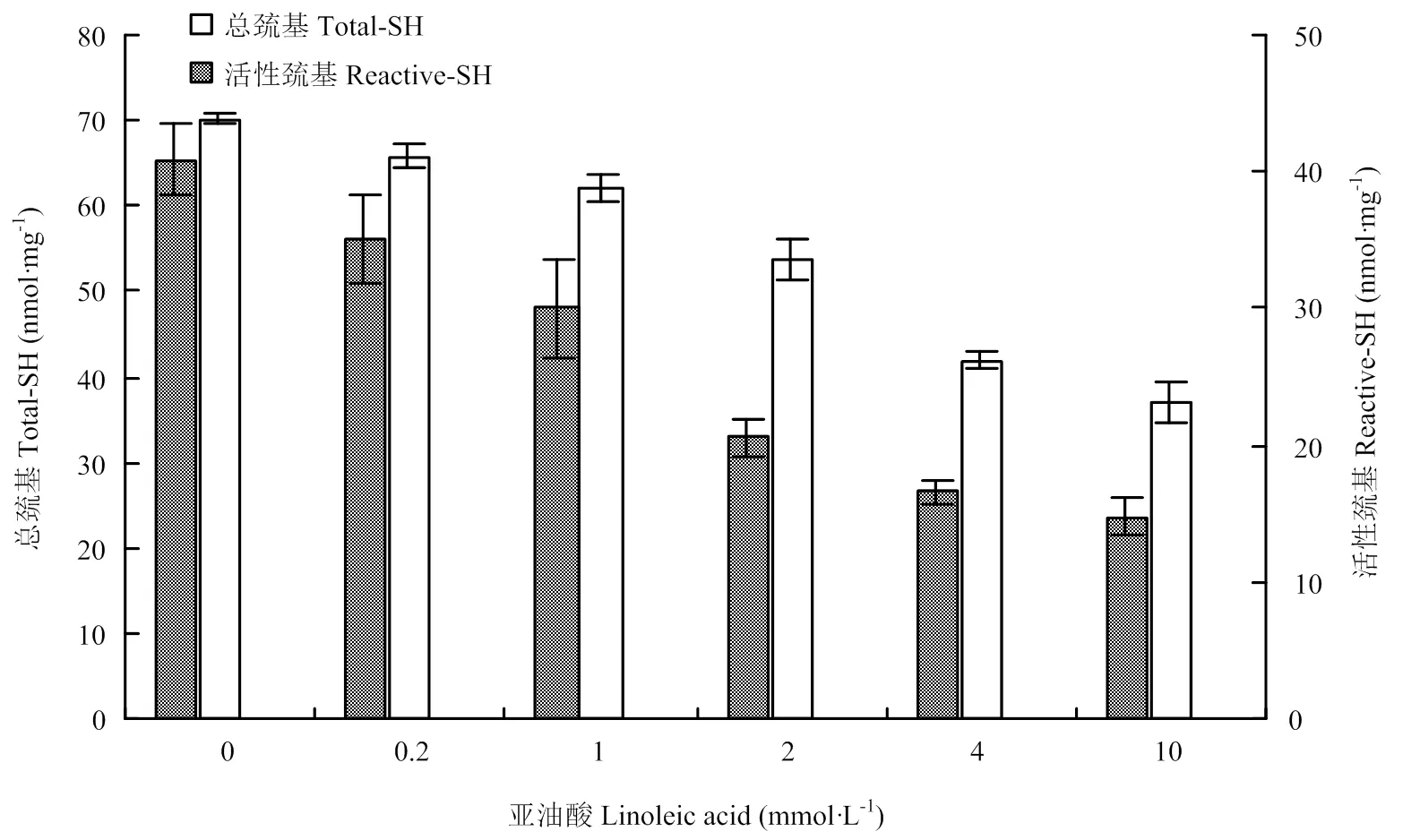
图8 氧化对总巯基和活性巯基含量的影响
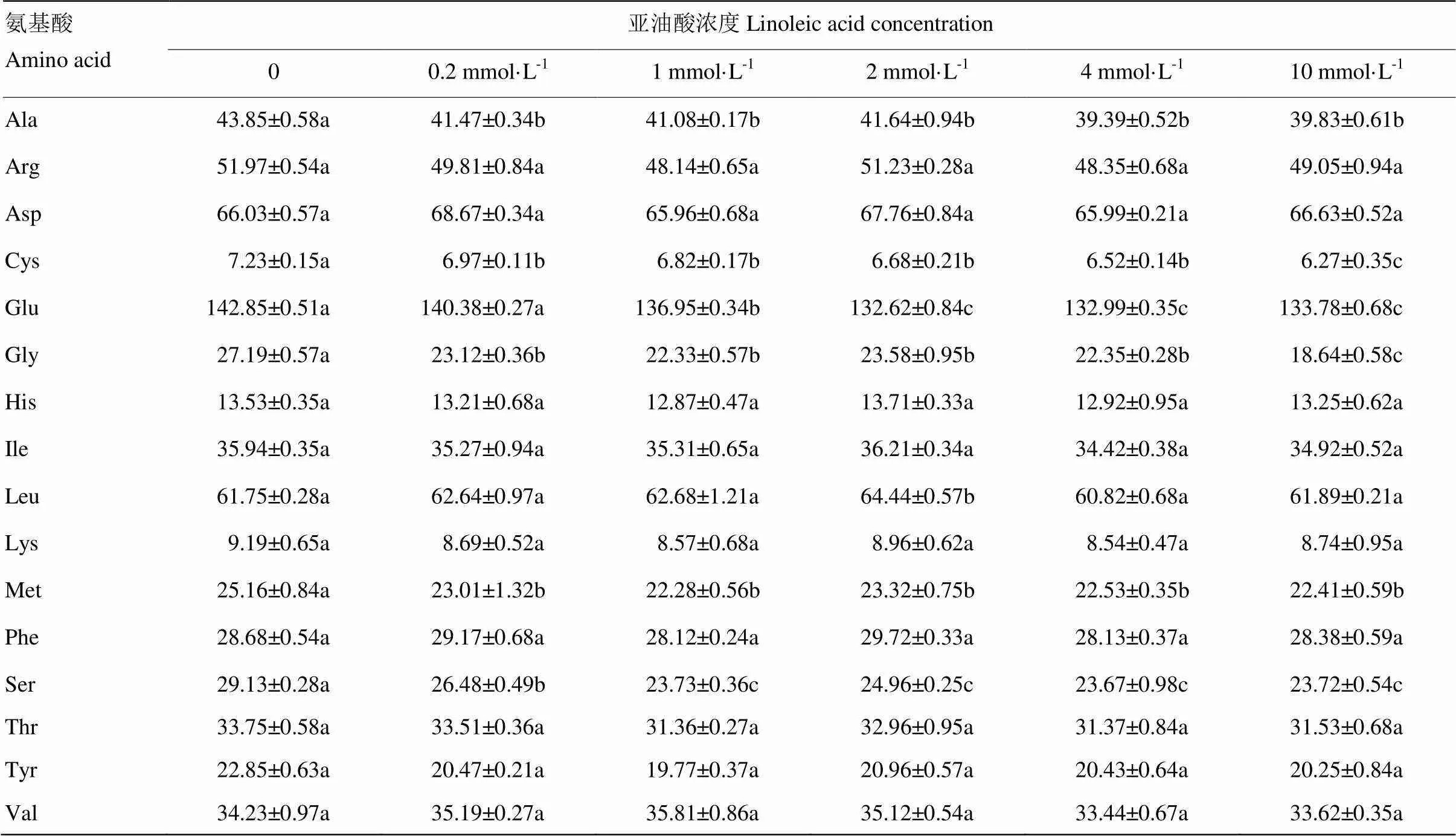
表1 不同氧化程度下MP的氨基酸含量
所有数据表示平均值±标准差(n=3),同一行不同字母显著相关性(<0.05)
Data are expressed as the mean±SD (n=3), different superscripted letters in the same line indicate significantly different at<0.05
2.9 主成分分析
用SPSS软件对凝胶特性和作用力进行主成分分析(表2)。从表2可见,第一个主成分能解释总体方差变异的72.124%,两个主成分的累积解释方差已经达到95.096%,且这两个主成分的特征值均超过1,基本可以解释原来所有指标包含的信息,故选取这两个主成分作为评价不同氧化程度下MP凝胶特性和化学作用力关系的综合指标进行评价(图9)。
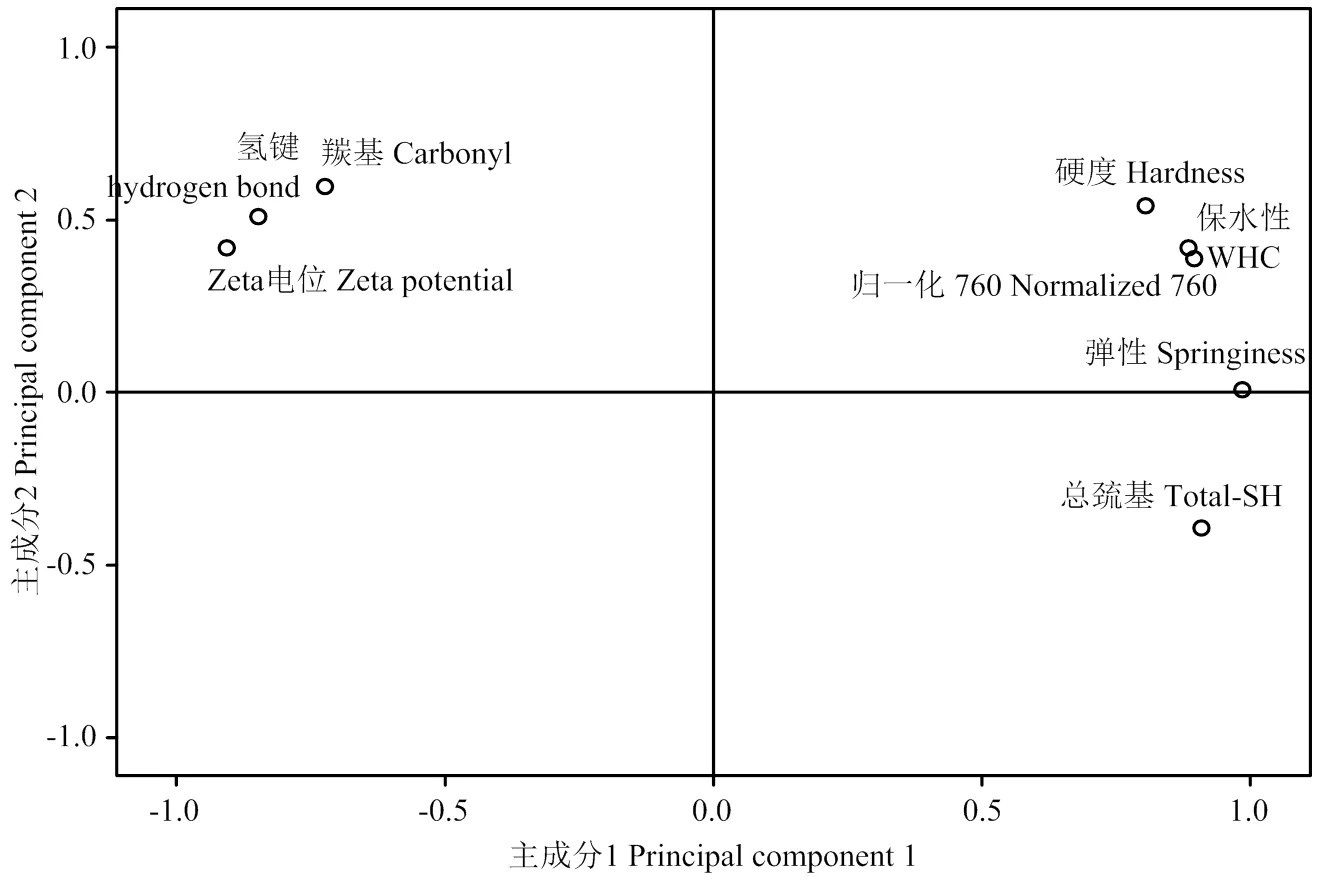
图9 不同氧化程度下主成分评分

表2 不同氧化程度处理下MP凝胶的主成分分析
从图9可见,第一主成分与硬度、弹性、保水性、总巯基和I760均呈现正相关性,与羰基含量、氢键和Zeta电位呈现负相关性。第二主成分与羰基含量正相关性比较高,与总巯基呈现负相关性。硬度、弹性、保水性与I760都处于第一象限并且比较接近,这表明疏水相互作用对脂质酶氧化体系下MP凝胶形成起着重要甚至是决定性作用。
3 讨论
3.1 不同氧化体系下的MP凝胶质构特性比较
在脂肪氧化酶-亚油酸-MP体系中,亚油酸是油脂氧化反应产生自由基的底物,本试验中随着亚油酸含量增加,MP中羰基含量不断增加,这表明MP氧化程度随亚油酸含量增加而逐渐升高。因此,可以用亚油酸含量高低代表氧化程度大小。DEAN等[22]也获得了相同的结论。本试验中,亚油酸含量从0增加到2mmol·L-1时,MP凝胶硬度逐渐增加到最大值,随着亚油酸浓度继续增加,凝胶硬度迅速下降。原因可能是氧化改变了凝胶的疏水作用力或二硫键[30]。凝胶弹性在亚油酸含量为0.2mmol·L-1时比对照组略有增加,之后随着氧化程度继续增加,弹性逐渐降低。胡忠良[31]研究了羟自由基氧化体系(H2O2+FeCl3)对鸡胸肉MP凝胶硬度和弹性的影响,发现随着氧化程度的升高,凝胶的硬度、弹性均先增加后降低,与本试验结果类似。而李银等[32]发现在羟自由基氧化体系下猪肉MP凝胶硬度随着H2O2浓度增加逐渐降低,造成这种差别的原因可能是MP的来源不同,本试验中的MP来自鸡胸肉,而李银等[32]的MP则来自猪长肌;也可能是试验设计的问题,如果氧化体系反应物浓度间隔太大,有可能漏掉其中的某些变化。
3.2 本氧化体系下的MP凝胶特性与微观结构
MP凝胶的保水性与凝胶硬度一样,随着氧化程度升高逐渐增加,当亚油酸浓度为2mmol·L-1时达到最大值,而后逐渐降低。在MP形成凝胶的过程中,亚油酸-脂肪氧化酶氧化体系会生成自由基中间物以及氢过氧化物如α, β-不饱和醛(丙烯醛和4-羟基-2-壬烯醛)和丙二醛(MDA)[33-34],可能会促进蛋白质分子之间以及蛋白质分子-脂质交联的形成,从而提高了MP凝胶的保水性和硬度。XIONG等[35]的观点是氧化使蛋白质的溶解度和巯基含量减少,导致蛋白凝胶保水性的下降。但也有研究发现,氧化并不一定降低蛋白质的加工特性,KELLEHER等[36]对鲭鱼肉糜研究发现随着氧化程度增加,肉糜保水性也持续增加。良好的凝胶网状结构能更好地束缚水分,增强凝胶抗压能力,使得凝胶的硬度和保水性增加。使用扫描电镜对凝胶的微观结构进行观察,发现在亚油酸浓度为2mmol·L-1时,MP形成的凝胶网络最为均匀细腻,孔径均一,呈现“蜂窝状”胶束;而亚油酸浓度为10mmol·L-1时,形成的凝胶网络均匀性最差,孔径变大。这可能是由于亚油酸浓度在0—2 mmol·L-1范围内,轻度氧化能促进蛋白质分子变性和展开,但变性速度随亚油酸浓度增加仅缓慢增加,致使较多变性的MP分子能从容重排,形成致密细腻的凝胶结构;而在高浓度氧化剂下,剧烈的氧化使过多的蛋白质分子快速变性并聚集,来不及有序重排,因此形成的凝胶网络均匀性最差,孔径变大。胡忠良等[31]利用羟基自由基体系研究氧化对MP凝胶微观结构的影响时,也发现过度氧化导致凝胶微观结构的变差。
3.3 氧化反应与作用力变化
测定蛋白质疏水作用力的方法主要有两种,一种是ANS探针法,另一种为拉曼光谱法,前一种方法必须在极稀的溶液中进行测定,后者更适合于凝胶蛋白质样品的测定,因此本试验用拉曼光谱的I760强度表达MP凝胶的疏水作用力[37]。结果发现,随着氧化程度的增加,疏水作用力先增加后降低,在2mmol·L-1处获得最大值。在MP凝胶的形成过程中,随着氧化程度的升高(0—2 mmol·L-1),MP分子部分展开,使得疏水性基团暴露,增强了疏水相互作用,此外脂质酶氧化体系的二级产物、氢过氧化物和过氧自由基会与氨基酸基团反应,如赖氨酸、半胱氨酸和组氨酸能与α, β-不饱和醛反应,从而引入一条疏水性侧链,这使得疏水相互作用在低氧化程度下增强。但是,当亚油酸浓度继续增加(2—10 mmol·L-1),疏水相互作用降低,可能是因为疏水性基团被氧化为亲水性基团,比如蛋氨酸被氧化为蛋氨酸亚砜。LI等[38]用ANS探针法研究了经FeSO4-抗坏血酸氧化体系处理的肌球蛋白的疏水性变化趋势,发现表面疏水性随着氧化程度的增加而增加;WU等[39]报道了大豆蛋白氧化会导致表面疏水性的降低。造成各种结果不一致的原因很多,包括测定方法,蛋白质原料、氧化体系等试验设计和条件等。
拉曼光谱I850与I830共轭双峰比值变化能反映出MP中氢键的变化趋势图[19]。当I850/I830≥1.25时,代表酪氨酸上的-OH与溶剂水分子生成氢键;I850/I830≤0.5时,表明酪氨酸残基包埋在疏水环境中,与蛋白质分子上其他极性基团生成氢键。本试验中未经氧化处理的对照组比值为0.98,表明酪氨酸残基形成的氢键既包括暴露的氢键,也包括埋藏的氢键;随氧化程度增加,I850/I830比值增加,表明MP酪氨酸残基苯环上的-OH与MP分子其他残基(如-COOH)生成的氢键逐渐转变为与水分子生成的氢键,即MP分子间的氢键作用随着氧化程度的升高而减少。在蛋白质经过高度氧化后,MP分子展开,而且MP分子疏水性降低,这使络氨酸残基处于亲水性微环境,埋藏的MP分子内部的氢键转变为MP分子与水分子之间的氢键。XU等[40]研究加热过程中(20℃—70℃)猪肉MP I850/I830的变化,发现共轭双峰的比值从1.13升高到2.56,他们认为加热使酪氨酸残基暴露在水溶液环境中。SUN等[41]对猪肉MP研究也证实埋藏的络氨酸残基会导致I850/I830共轭双峰值的降低,与本试验结果一致。本研究中MP凝胶的静电作用力随着氧化程度的升高而减弱,这可能是由于带电荷的氨基酸含量发生变化导致。一般情况下,总巯基的减少表示二硫键的生成[27]。MP分子中含有的大量巯基,在氧化体系中能被不同程度的氧化,并且产生相关共价化合物[42-43]。巯基(-SH)能被氧化成为二硫键(-S-S-)、次磺酸(RSOH)、亚磺酸(-SO2H)和磺酸(-SO3H)等形式[44]。其中巯基(-SH)被氧化成为可逆的氧化形式:二硫键(-S-S-)和次磺酸(RSOH),导致二硫键含量增加;但是也可能会被氧化成为不可逆的氧化形式:亚磺酸(-SO2H)和磺酸(-SO3H),这会导致MP分子中总巯基含量以及二硫键含量的降低。本研究中巯基含量随氧化程度的升高而持续降低,说明氧化一定程度上导致二硫键增加。随着亚油酸浓度的升高,氧化程度不断增强,MP分子的半胱氨酸残基的-SH被氧化成二硫键或其他含硫氧化物[45],其总巯基和活性巯基含量降低是必然的。
3.4 氧化体系下MP组成、作用力与凝胶特性的内在关系
本研究中疏水性氨基酸Ala、Leu、Ile和Phe的含量随氧化程度的变化不显著,Val和Met含量随氧化程度升高而降低,但疏水性氨基酸的总量(Ala、Met、Val、Leu、Ile和Phe)随氧化程度升高而显著变化,在亚油酸为2mmol·L-1处达到最大值。在氧化过程中,疏水性氨基酸暴露于表面,并通过疏水相互作用相互联接,因此导致测定的MP凝胶疏水相互作用也在亚油酸2mmol·L-1时达到了最大。通过对MP凝胶特性和作用力指标进行主成分分析发现,疏水相互作用对氧化体系下MP凝胶特性形成起决定性作用,这解释了MP凝胶的硬度在2mmol·L-1处最大的原因,同时也说明了氧化通过改变MP分子中疏水氨基酸残基含量和分布,改变凝胶的疏水相互作用,进而控制凝胶的质构特性。Ser,Glu和Cys 3种氨基酸残基可形成分子内氢键,蛋白质氧化破坏了这3种氨基酸,使这3种氨基酸数量下降,从而导致了分子内氢键降低。MP凝胶中的氢键可能与凝胶的弹性相关。PARK等[21]对经过氧化的MP进行氨基酸分析时同样发现,Cys和Met的含量随着亚油酸浓度的升高而降低,与本研究一致。本试验中带正电荷的氨基酸基团(Lys,Arg,和His)和带负电的氨基酸基团(Asp)随亚油酸浓度变化不显著,但是带负电荷的Glu被氧化修饰,与脂质氧化二级产物以及自由基结合,生成羰基,这导致了蛋白质分子电位降低,凝胶中静电斥力降低。良好的凝胶是分子间引力和斥力相平衡的结果,斥力是防止凝胶絮凝的关键性作用力。这解释了高氧化程度时凝胶微观结构出现高孔径变大,胶束不均匀的现象。因此氧化通过降低MP分子中Glu含量改变凝胶的静电斥力,进而改变凝胶的超微结构和弹性。
4 结论
氧化作用改变了MP的组成,使其作用力发生变化,致使MP的超微结构、质构特性和保水性发生变化。Ser、Glu和Cys 3种氨基酸残基能够形成分子内氢键,随着亚油酸浓度的增加,蛋白质氧化程度越来越高,蛋白质氧化破坏了3种氨基酸,使这3种氨基酸数量下降,从而减弱了分子内氢键作用;Cys的巯基在凝胶形成过程中能够形成二硫键,Cys的含量随着氧化程度的升高而降低,导致二硫键增加。氧化降低了MP分子中解离后带负电荷的Glu含量,从而减弱凝胶的静电相互作用,进而影响凝胶的超微结构和凝胶的弹性。疏水性氨基酸的总量随氧化程度升高而增加,在亚油酸为2 mmol·L-1处达到最大值,导致MP凝胶的疏水相互作用在亚油酸2 mmol·L-1时达到了最大,疏水相互作用对脂质酶氧化体系下MP凝胶形成起着决定性作用,所以MP凝胶的硬度和保水性在2 mmol·L-1处最大,凝胶的超微结构最佳。
[1] ESTEVEZ M, VENTANAS S, CAVA R. Protein oxidation in frankfurters with increasing levels of added rosemary essential oil: effect on color and texture deterioration., 2010, 70(7): 427-432.
[2] LUND M N, LAMETSCH R, HYIID M S, JENSEN O N, SKIBSTED L H. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcine longissimus dorsi during chill storage., 2007, 77(3): 295-303.
[3] DECHER E A, XIONG Y L, CALVERT J T, CRUM A D, BLANCHARD S P. Chemical, physical and functional properties of oxidized turkey white muscle myofibrillar proteins., 1993, 41(2): 186-189.
[4] BERTRAM H C, KRISTENSEN M, ØSTDAL H, BARON C P, YOUNG J F, ANDERSEN H J. Does oxidation affect the water functionality of myofibrillar proteins., 2007, 55(6): 2342-2348.
[5] SNIDER D W, COTTERILL O J. Hydrogen peroxide oxidation and coagulation of egg white., 1972, 37(4): 558-561.
[6] SRINIVASAN S, XIONG Y L. Gelation of beef heart surimi as affected by antioxidants., 1996, 61(4): 707-711.
[7] XIONG Y L, BLANCHARD S P, OOIZUMI T, MA Y. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein., 2010, 75(2): 215-221.
[8] KELLEHER S D, HULTIN H O, WILHELM K A. Stability of macherel surimi prepared under lipid-stabilizing processing conditions., 1994, 59(2): 269-271.
[9] WANG S F, SMYTH A B, SMITH D M. Gelation properties of myosin: role of subfragments and actin in macromolecular interactions in food technology., 1996, 650: 124-133.
[10] ZHANG Z Y, YANG Y L, TANG X, CHEN Y, YOU Y. Chemical forces and water holding capacity study of heat-induced myofibrillar protein gel as affected by high pressure., 2015, 188: 111-118.
[11] WANG J Y,YANG Y L,TANG X Z,NI W X,ZHOU L. Effects of pulsed ultrasound on rheological and structural properties of chicken myofibrillar protein., 2017, 38: 225-233.
[12] XIONG Y L, LOU X, WANG C, MOODY W G, HARMON R J. Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions., 2000, 65(1): 96-100.
[13] UCHIDA K, KANEMATSU M, MORIMITS Y, OSAWA T, NOGUCHI N, NIKI E. Acrolein is a product of lipid peroxidation reaction. Formation of free acrolein and its conjugate with lysine residues in oxidized low density lipoproteins., 1998, 273(26): 16058-16066.
[14] LEVINE R L, GARLAND D, OLIVER C N, AMICI A, CLIMENT I, LENZ A G, AHN B W, SHALTIEL S, STADTMAN E R. Determination of carbonyl content in oxidatively modified proteins., 1990, 186(1): 464-478.
[15] 杨玉玲, 游远, 彭晓蓓, 陈银基. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响. 中国农业科学, 2014, 47(10): 2013-2020.
YANG Y L, YOU Y, PENG X B, CHEN Y J. Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle., 2014, 47(10): 2013-2020. (in Chinese)
[16] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels., 2010, 58(5): 1040-1046.
[17] ZHANG Z Y, YANG Y L, YANG X Z, CHEN Y J, YOU Y. Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel., 2015, 21(4): 597-605.
[18] NONAKA M, LI-CHAN E, NAKAI S. Raman spectroscopic study of thermally induced gelation of whey proteins., 1993, 41(8): 1176-1181.
[19] LI-CHAN E, NAKAI S, HIROTSUK M. Raman spectroscopy as a probe of protein structure in food systems., 1994: 163-197.
[20] ELLMAN G L. Tissue sulfhydryl groups., 1959, 82(1): 70-77.
[21] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems., 2007, 103(2): 607-616.
[22] DEAN R T, FU S L, STOCKER R, DAVIES M J. Biochemistry and pathology of radical-mediated protein oxidatio., 1997, 324: 1-18.
[23] HUNTER R J.. New York/London: Academic press, 2013.
[24] RUNKANA V, SOMASUNDARAN P, KAPUR P C. Mathematical modeling of polymer-induced flocculation by charge neutralization., 2004, 270(2): 347-358.
[25] HERMASSAN A M. Aggregation and denaturation involved in gel formation., 1979, 92(5): 81-103.
[26] HAMADA M, ISHIZAKI S, NAGAI T. Variation of SH content and kamaboko-gel forming ability of shark muscle protein by electrolysis., 1994, 42: 131-135.
[27] ZHANG Z Y, REGENSTEIN J M, ZHOU P, YANG Y L. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel., 2017, 34: 960-967.
[28] OPSTVEDT J, MILLER R, HARDY R W, SPINELLI J. Heat-induced changes in sulfhydryl groups and disulfide bonds in fish protein and their effect on protein and amino acid digestibility in rainbow trout ()., 1984, 32(4): 929-935.
[29] VISSCHERS R W, DE JONGH H H. Disulphide bond formation in food protein aggregation and gelation., 2005, 23(1): 75-80.
[30] LIU G, XIONG Y L. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofibrillar proteins., 1996, 44(3): 779-784.
[31] 胡忠良. 鸡胸肉肌原纤维蛋白氧化对其热诱导凝胶和理化特性的影响[D]. 南京: 南京农业大学, 2012.
HU Z L. Effects of protein oxidation on heat-induced gel and physicochemical properties of chicken breast myofibrillar protein[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese)
[32] 李银, 李侠, 张春晖, 孙红梅, 董宪兵. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低. 农业工程学报, 2013, 29(12): 286-292.
LI Y, LI X, ZHANG C H, SUN H M, DONG X B. Oxidation and decrease of gelling properties for meat myofibrillar protein induced by hydroxyl radical., 2013, 29(12): 286-292. (in Chinese)
[33] UCHIDA K, KANEMATSU M, SAKAI K, MATSUDA T, HATTORI N, MIZUNO Y, SUZUKI D, MIYATA T, NOGUCHI N, NIKI E, OSAWA T. Protein-bound acrolein: potential markers for oxidative stress., 1998, 95(9): 4882-4887.
[34] UCHIDA K, SAKAI K, ITAKURA K, OSAWA T, TOYOKUNI S. Protein modification by lipid peroxidation products: formation of malondialdehyde-derived N ε-(2-Propenal) lysine in proteins., 1997, 346(1): 45-52.
[35] XIONG Y L, DECKER E, FAUSTMAN C, LOPEZBOTE C J. Protein oxidation and implications for muscle foods quality., 2000: 85-111.
[36] KELLRHER S D, HULTIN H O, WILHELM K A. Stability of macherel surimi prepared under lipid-stabilizing processing conditions., 1994, 59(2): 269-271.
[37] 张自业. 盐和超高压处理对肌原纤维蛋白凝胶特性与作用力的影响及调控机理研究[D]. 南京: 南京财经大学, 2016.
ZHANG Z Y. Study on effects of salt and high pressure treatment on properties and chemical forces of myofibrillar protein gel and the regulation mechanism[D]. Nanjing: Nanjing University of Finance and Economics, 2016. (in Chinese)
[38] LI S J, KING A J. Lipid oxidation and myosin denaturation in dark chicken meat., 1996, 44(10): 3080-3084.
[39] WU W, ZHANG C M, HUA Y F. Structural modification of soy protein by the lipid peroxidation product malondialdehyde., 2009, 89(8): 1416-1423.
[40] XU X L, HAN M Y, FEI Y, ZHOU G H. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic., 2011, 87(3): 159-164.
[41] SUN W, ZHAO Q, ZHAO M, YANG B, CUI C, REN J. Structural evaluation of myofibrillar proteins during processing of Cantonese sausage by Raman spectroscopy., 2011, 59(20): 11070-11077.
[42] ØSTDAL H, SKIBSTED L H, ANDERSEN H J. Formation of long-lived protein radicals in the reaction between H2O2-activated metmyoglobin and other proteins., 1997, 23(5): 754-761.
[43] BARON C P, ANDERSEN H J. Myoglobin-induced lipid oxidation. A review., 2002, 50(14): 3887-3897.
[44] EATON P. Protein thiol oxidation in health and disease: Techniques for measuring disulfides and related modifications in complex protein mixtures., 2006, 40(11): 1889-1899.
[45] BUTTKUS H A. The reaction of malonaldehyde or oxidized linolenic acid with sulfhydryl compounds., 1972, 49(10): 613-614.
(责任编辑 杨鑫浩)
The Effects of Oxidation on Textural Properties and Water Holding Capacity of Heat-Induced Myofibrillar Protein Gel
YANG YuLing, ZHOU Lei, YOU Yuan, TANG XiaoZhi, WEI SuMeng
(College of Food Science and Engineering, Nanjing University of Finance and Economics/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing 210023)
【Objective】This study was designed to investigate the influence of protein oxidation on the textural properties and water holding capacity of myofibrillar protein (MP) gel, and to reveal the root cause of gel properties changes with the degree of protein oxidation, in order to provide the theoretical basis for controlling the gel properties and the quality of chicken products.【Method】Live chickens were slaughtered and the chicken breast muscle was used to extract MP. Effects of protein oxidation on the textural properties of MP gel were studied in the lipoxygenase-linoleic acid-MP system using a texture analyzer. Water holding capacity (WHC) of MP gel was measured by high-speed centrifuge. I760 and I850/I830 measured by Raman spectroscopy were used to represent the hydrophobic interaction and hydrogen bonds of MP gel, and the potential value was determined by Zeta potential to reflect electrostatic repulsion.The change of disulfide bond was determined by the change of total sulfhydryl group (SH). The ultrastructures of the gel were observed by scanning electron microscopy. The amino acid composition and content were investigated by an amino acid analyzer. 【Result】The carbonyl content and the degree of oxidation of MP increased with increasing linoleic acid concentration in the lipoxygenase-linoleic acid-MP system. When the content of linoleic acid increased from 0 to 2 mmol·L-1, the gel hardness and WHC increased to the maximum, and then gradually decreased as the concentration of linoleic acid increased. Springiness slightly increased at low oxidation degree, and then decreased with more linoleic acid added. When the concentration of linoleic acid was 2 mmol·L-1, the network of the MP gel was dense, porous and uniform in pore size. The gel pore size became larger and uneven at higher linoleic acid concentration. I760 reached the maximum at 2 mmol·L-1with the increase of the degree of oxidation, which indicated that hydrophobic interaction force reached maximum. The intramolecular hydrogen bonds could be formed by the three amino acid residues Ser, Glu and Cys, and the content of these three amino acids decreased with the increase of the degree of oxidation. Meanwhile, the I850/I830 of the Raman spectrum increased with the increase of the degree of oxidation and finally >1.25, indicating that the hydrogen bonds between MP molecules decreased with the increase of the degree of oxidation. After dissociation, the content of negatively charged Glu decreased with the increase of the degree of oxidation, which led to the decrease of the absolute value of Zeta potential with the increase of the degree of oxidation, indicating that the electrostatic interaction decreased with the increase of the degree of oxidation. The sulfhydryl group of Cys could form disulfide bond in the gel formation process and the content of Cys decreased with the increase of the degree of oxidation, resulting in the change of the total sulfhydryl content in the same direction, which indicated the formation of disulfide bonds in the oxidation process. The total amount of hydrophobic amino acids (Ala, Met, Val, Leu, Ile and Phe) changed with increasing degree of oxidation and reached maximum at 2 mmol·L-1linoleic acid, which provided evidence that hydrophobic forces reached their maximum at 2 mmol·L-1. The principal component analysis suggested that hydrophobic interaction was the key force controlling the gel properties in the lipoxygenase- linoleic acid-MP system. 【Conclusion】Moderate oxidation of MP helped to improve the properties of MP gels, and the gel hardness of MP reached the maximum at 2 mmol·L-1in the lipoxygenase-linoleic acid-MP system. The reason was that oxidation changed the composition and hydrophobic forces of MP. When the linoleic acid was 2 mmol·L-1, the total amount of hydrophobic amino acid in MP molecule was the highest and the hydrophobic force was the largest, and the microstructure of the gel was uniform and dense, so that the texture and WHC of MP gel were the highest.
myofibrillar protein; gel properties; oxidation; amino acid; protein molecule forces
10.3864/j.issn.0578-1752.2018.18.013
2018-03-14;
2018-05-15
国家自然科学基金(31371798)、江苏省高校优势学科建设工程资助项目
杨玉玲,E-mail:yulingy@sina.com
