“观察DNA 和RNA 在细胞中的分布”实验的改进
2018-10-10杨忠顺林易凡
杨忠顺 林易凡
(广东省深圳中学 广东深圳 518001)
“观察DNA 和RNA 在细胞中的分布”是课程标准必修1“活动建议”里的一个重要实验[1]。 该实验原理是利用甲基绿、 吡罗红与DNA 和RNA的亲和力不同, 将DNA 与RNA 分别染成绿色和红色。染色后在光学显微镜下观察,绿色主要分布在细胞核,红色主要分布在细胞质,从而让学生得出DNA 主要分布在细胞核中, 而RNA 主要分布在细胞质中的结论。
1 实验教学中存在的问题
教材设计的实验,材料来源容易,适于大多数地区采用[2]。实验教学时,即使严格根据教材的步骤操作,许多学生仍观察不到理想的实验结果。使用人口腔上皮细胞为实验材料时, 发现大多数情况下细胞核也被染成红色,不能达到区分DNA与RNA的效果; 而用洋葱内表皮细胞做实验材料时,教材并未给出详细步骤,参照口腔上皮细胞,不经酒精灯烘烤,30℃条件下用8%盐酸解离5 min 后再染色, 发现洋葱表皮细胞细胞核也十分容易被染成红色, 而且还有质壁分离的现象出现。 此外,使用预混的甲基绿-吡罗红染料(由公司购买,在保质期内使用),直接进行染色,镜检过程中会发现有大量深色颗粒,影响观察。
使用8%盐酸解离易使细胞核也染成红色的问题,康思婷的研究结果提到了多种可能[3]。首先盐酸解离过程中易使DNA 变形,其次是pH 值对染料染色的影响,最后是DNA 在高温条件下易变性。 俞如旺等的研究结果显示,烤干与烘干,经过盐酸解离都会使细胞核染为红色[4]。 而不经盐酸解离, 使用中性的生理盐水或pH 值在7.35 左右的磷酸缓冲液环境承载口腔上皮细胞, 染色均不受影响(后文中有相关实验证明)。 因此判断使细胞核染为红色的原因, 可能主要在于盐酸解离过程中导致的DNA 变形,DNA 由于变形解旋为单链,使得其与吡罗红的亲和力大幅增加,而与甲基绿的亲和力则大幅下降。
之前的文献报道中提出的解决方案主要包括取消盐酸解离的步骤或用醋酸缓冲液代替。 在实际操作中发现取消盐酸解离的步骤, 直接染色的确能够达到一定的效果, 但是对于人类口腔上皮细胞和洋葱内表皮细胞,染色较浅且不稳定,偶有染不上色的情况; 对于洋葱内表皮细胞, 撕取的0.5 cm×0.5 cm的内表皮, 染色中易浮在染液液滴之上,导致染色不均匀。
2 Triton X-100 作为透膜剂的探究实验
Triton X-100(聚乙二醇辛基苯基醚)分子量为646.86,分子式为C34H62O11,是一种非离子型表面活性剂。在生物学和工业生产中常用作去垢剂,以增加细胞膜的通透性, 还能在此过程中保持膜蛋白的天然构象。 Triton X-100 易购买,pH 值为中性, 性质非常稳定, 常温下避光可以长时间保存。 基于以上原因,笔者尝试探究TritonX-100 作为此实验的透膜剂。
为了探究Triton X-100 作为透膜剂改善染色效果, 笔者设计了2 组实验分别探究Triton X-100 在“观察DNA 和RNA 在细胞中的分布”实验中的使用浓度和透膜时间。 实验材料选取更易观察的洋葱内表皮细胞。
参考免疫细胞化学中的动物细胞透膜浓度,设置3 个Triton X-100 实验组别, 浓度分别为0.1%、1%和10%, 除此之外还有8%盐酸解离组别和不解离的对照组。

表1 洋葱内表皮细胞在不同条件下的解离
制备pH 值为7.35 左右的磷酸缓冲液(PBS)稀释Triton X-100, 稀释浓度分别为0.1%、1%和10%,其中0.5%~1%为免疫细胞化学中透膜的常用浓度, 而梯度两端的浓度在设置上分别与常用浓度相差一个数量级, 以验证过低或过高浓度对透膜的影响。 而在温度选择上,由于Triton X-100常作为表面活性剂使用, 应用中无需加热, 因此Triton X-100 的透膜选取室温进行,透膜时间5 min。透膜后使用清水缓慢冲洗10 s,然后染色。染色过程5 min,染色后用滤纸吸去多余染液,盖上盖玻片后在显微镜下观察。 不解离对照组撕取洋葱内表皮后直接染色,吸去多余染液后镜检。
结果如图1所示, 细胞核只有盐酸解离组别呈红色, 不解离与Triton X-100 透膜组别均为蓝绿色,而细胞质不解离组别着色最浅,随着Triton X-100 浓度的增加, 着色越来越深,10% Triton X-100 组细胞质已呈现为偏绿色, 而盐酸解离组别质壁分离明显,细胞质皱缩。 综合上述结果,0.1%~1%的Triton X-100 均能在不影响细胞核着色的前提下,使细胞质着色加深,故Triton X-100比较适宜的使用浓度为0.1%~1%。

图1 不同Triton X-100 透膜浓度对洋葱内表皮细胞染色的影响
在确定Triton X-100 的适宜使用浓度后,继续探究Triton X-100 透膜时间对洋葱内表皮细胞染色的影响。 共设置4 个时间梯度,分别为2min、5min、10min 和15min, 透膜后染色镜检过程同上述步骤。染色结果如图2所示,随着透膜时间的增加,细胞核的颜色变化不大,均成绿色,而细胞质颜色则越来越深, 说明透膜时间的增加可以使染料更有效的结合RNA。 考虑到实验课时间有限,染色时间控制在5min 比较合适,且能达到较好的透膜效果。
随后验证Triton X-100 在人类口腔上皮细胞染色中的作用。 用1%浓度的Triton X-100 透膜5 min(用1% 的Triton X-100 PBS 溶液代替生理盐水,透膜后在烘箱中烘干,染色时间均为5 min)与直接染色相比,结果如图3所示,透膜组胞质着色偏红,直接染色组胞质着色较浅,个别细胞呈现蓝绿色。
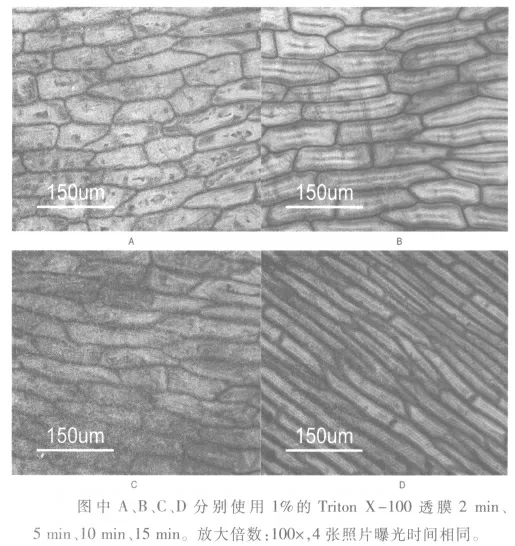
图2 不同Triton X-100 透膜处理时间对洋葱内表皮细胞染色的影响
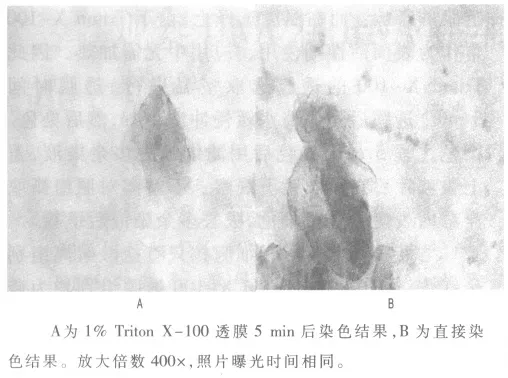
图3 Triton X-100 透膜处理对人类口腔上皮细胞染色的影响
3 本实验其他问题的改进方案
关于“观察DNA 和RNA 在细胞中的分布”实验效果不理想的问题,已有多篇文献有过报道。首先是针对染料中有深色颗粒影响镜检的问题,通过过滤的方法,可以有效去除染液中的杂质,使镜检过程中出现的深色颗粒状物质消失[5]。 在实际应用中笔者为提高过滤的效率和稳定性, 采用了商品化的0.22 μm 滤器,使用60 mL 的一次性针管过滤,发现效果很好,效率很高,为一个班级过滤染液只需几分钟。
其次对于人类口腔上皮细胞实验难度大、洋葱内表皮细胞实验容易的问题,经过实践发现确实如此,因此很多报道推荐用洋葱内表皮细胞完全取代口腔上皮细胞进行实验。相比于人类口腔上皮细胞, 洋葱内表皮细胞的确有细胞体积大,低倍镜即可清楚观察、 取材容易、 步骤简便、肉眼下即可找到等优势。但是如果只使用植物细胞观察,放弃动物细胞则未免有失偏颇,虽然教材没有明确要求,但是作为统一的整体,动物和植物都有代表,会使学生对于核酸功能的普适性认识更加清楚,在教学中更有信服力。 由于取材都很容易,所以作者认为动、物植物细胞在本实验中应该分组进行,再全班讨论,加强学生对不同实验材料区别和实验结果共性的认识,从而达到更好的学习效果。
而对于人类口腔上皮细胞临时装片制作中酒精灯烤干过程中的问题, 有条件的学校可以使用56~60℃烘箱烘干代替酒精灯烤干, 效果更佳,稳定、可控。由于烤干的过程中火焰的大小、离火焰的距离和移动玻片的频率对于烤干的效果都有较大影响,整个班级在操作过程中难免会有小组因为这一步缺乏经验导致的失误而功亏一篑。而使用烘箱烘干5 min,可以得到大致相同的实验结果。
4 总结
综合上述实验结果,在“观察DNA 和RNA 在细胞中的分布” 实验中, 使用0.1%~1%浓度的TritonX-100 代替8%盐酸,透膜5 min,能起到增加细胞膜通透性、使染料着色更容易的效果,并且对于植物细胞和动物细胞都有较好的效果。
若不解离直接染色,亦能达到一定的效果,只是胞质一般着色较浅。对于洋葱内表皮细胞样本,染色前滴一小滴PBS 缓冲液可使样本贴紧载玻片,不易折叠,便于染色;对于人类口腔上皮细胞,笔者认为其他研究者所报道过的直接涂片的效果较好,省去了烘干或烤干的过程,如使用透膜剂或盐酸解离,烘箱烘干的效果好于酒精灯烤干。
关于Triton X-100 的安全性问题, 其性质稳定,如接触黏膜、皮肤后,有一定的刺激性,但在正常的较低浓度的使用环境中, 还没有报道对人体健康有重大不良影响, 并且因其广泛应用于洗涤剂、个人护理用品、纺织加工等领域,可以成为中学教学中代替盐酸的解离剂。如有条件,学生在实验过程中佩戴一次性乳胶手套和口罩, 安全性有保障。
