滩羊尾脂组织候选基因mRNA表达量分析研究
2018-10-10马丽娜李颖康
马丽娜,马 青,李颖康
(宁夏农林科学院动物科学研究所,宁夏 银川 750002)
近年来,随着人们生活水平的不断提高以及对心血管疾病的高度关注,高脂肉类逐渐受到冷落,脂尾(臀)型绵羊品种也越来越不受消费者欢迎。此外,过多的尾脂沉积随着养殖设施的不断改善对绵羊已无太大意义,而且还会增加饲养成本,因此,低脂型肉羊品种将成为今后的培育方向。研究绵羊尾部脂肪沉积的分子调控机制,进而减少多余的尾部脂肪沉积,对于低脂肉用绵羊品种的培育具有重要的理论价值与实际意义。滩羊是宁夏回族自治区的特色畜种之一,滩羊肉也是羊肉中的精品,其肉质细嫩、脂肪分布均匀、无膻味,深受消费者欢迎。但是由于滩羊属于长脂尾,尾脂重,不能被利用,影响了该品种的进一步开发利用,因此,培育尾脂小的滩羊品系,提升该品种生产性能水平,是当前急需解决的问题。为此,笔者对前期研究中利用基因芯片扫描和选择信号检测筛选得到的滩羊尾脂组织中与脂肪合成代谢相关的 6个重要候选基因(PDGFD、CAV1、PPARG、HSL、PLA2G16、RETN) 进行 mRNA 表达量研究,以期为进一步阐明滩羊尾部脂肪沉积的分子调控机制,以及滩羊尾型选育和品种改良提供参考。
1 材料与方法
1.1 样本采集与前处理
采集滩羊尾脂组织24份,浸泡在RNAlater中,置于-70℃保存。提取RNA后用于候选基因相对表达量分析。
1.2 引物设计及合成
参照GenBank公布的绵羊6个候选基因(PDGFD、CAV1、PPARG、HSL、PLA2G16、RETN)序列和18S rRNA基因序列,采用Primer Premier 5.0在其保守区域各设计1对引物。各候选基因及内参基因的引物序列及预期扩增产物大小见表1。引物由生工生物工程(上海)股份有限公司合成。
1.3 滩羊尾脂样本总RNA提取
用Trizol法提取组织样本中的总RNA。操作步骤如下:用研钵研磨组织样品,放入加有1 mLTrizol的离心管中静置5~10 min;加入0.2 mL氯仿上下剧烈混匀15~30 s,然后静置3 min(冰浴或室温);4℃、12 000 r/min离心 15 min;取水相到新的EP管中,加入0.5 mL异丙醇,混匀,冰浴10 min;4℃、12 000 r/min离心 10 min;倾倒上层液体,用1 mL 75%冰乙醇沉淀,混匀;4℃、12 000 r/min离心10 min;干燥。加入DEPC处理水溶解RNA,测定浓度,-80℃保存。

表1 候选基因及内参基因引物序列
1.4 RNA电泳
取5 μL提取的总RNA样本,用1%琼脂糖凝胶进行电泳,以检测RNA的完整性。
1.5 反转录
利用TIANScript RT Kit进行反转录,具体操作按产品说明书进行,步骤如下:向反应管中加入50 μL 反应体系的第一部分,包括:总 RNA 1 μL、Oligo (dT)(18S rRNA 用随机引物)2 μL、Super-Pured NTP 2 μL, 用 RNase-Free ddH2O 定容至14.5 μL,混匀。 70℃加热 5 min,迅速在冰上冷却2 min,简短离心。收集反应液后加入以下各组分:上述混合液 14.5 μL、5×First-Strand Buffer 0.5 μL、RNasin 0.5 μL、TIANScrip M-MLV 1 μL,轻轻吸打混匀,25℃温浴 10 min,42℃温浴 50 min,95℃加热5 min。用RNase-Free ddH2O将反应体系稀释到 50 μL,-20℃保存。
1.6 Real-time PCR检测
1.6.1 Real-time PCR反应体系及程序:采用20 μL反应体系,包括:2×SuperReal PreMix Plus 10 μL,上游引物(10 μmol/L)0.6 μL,下游引物(10 μmol/L)0.6 μL,cDNA 100 ng,50×ROX Reference Dye Ⅱ0.4 μL,加入灭菌纯化水至20 μL。扩增程序为:95 ℃,15 min;(95 ℃,15 s,58 ℃,30 s,72 ℃,30 s)×45个循环。
1.6.2 样品Real-time PCR检测:将各样品cDNA10倍稀释后取2 μL作为模板,分别用目的基因引物和内参基因引物进行扩增。同时,在60~95℃进行熔解曲线分析,每个样品cDNA重复检测3次。
1.7 统计分析
采用2-△△CT法进行数据的相对定量分析。
2 结果与分析
2.1 样品RNA提取质量
取5 μL提取的RNA样品,用1%琼脂糖凝胶进行电泳。由图1可知,电泳获得28 S、18 S和5 S共3条清晰的条带,表明RNA无明显降解。经紫外分光光度计检测,样本的OD260nm/OD280nm值在1.8~2.0,表明提取的 RNA纯度较高,可用于后续试验。
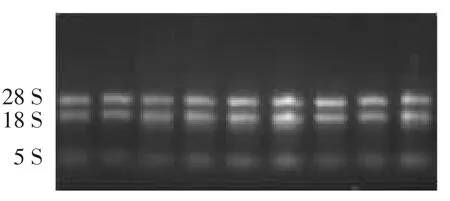
图1 总RNA琼脂糖凝胶电泳检测结果
2.2 各候选基因Real-time PCR检测
内参基因及各候选基因的实时扩增曲线及产物熔解曲线见图2~图8。
2.3 各基因mRNA相对定量分析
由表 2 可以看出,6 个基因(PDGFD、CAV1、PPARG、HSL、PLA2G16、RETN) 在滩羊尾脂组织均有表达,其中HSL基因的mRNA表达量显著高于其他基因(P<0.05)。

表2 6个候选基因的mRNA在尾脂中的相对定量结果

图2 内参基因(18S rRNA基因)实时扩增曲线及产物熔解曲线
图3 CAV1基因实时扩增曲线及产物熔解曲线

图4 P DGFD基因实时扩增曲线及产物熔解曲线
图5 PLA2G16基因实时扩增曲线及产物熔解曲线
3 讨论
脂肪组织的生长分为脂肪细胞的增殖 (体积的增大)和分化(数量的增加)两方面,其是由多种基因参与调控的复杂过程,其中,PPARG基因起着不可替代的作用。脂尾型绵羊从出生开始就在尾部储存大量脂肪,尾部脂肪占全身脂肪的很大部分。近年来,人们对羊肉的消费观念发生了改变,大脂尾羊的优势逐渐减小,生产者越来越倾向于通过增加整体经济效益来降低成本,而体脂和尾脂的过度沉积会影响羊只出售,因此,尾脂尺寸的减小是当前阶段肉羊选种育种的主要方向之一。
图6 P PARG基因实时扩增曲线及产物熔解曲线
图7 RETN基因实时扩增曲线及产物熔解曲线
图8 HSL基因实时扩增曲线及产物熔解曲线
抵抗素(resistin,RETN)、小凹蛋白 1(caveolin-1,CAV1)、脂肪特异性磷脂酶 A2(adiposespecific phospholipase A2,PLA2G16) 是脂肪细胞的关键调控因子,在细胞分化、增殖等方面发挥重要的作用[1]。 近年来研究发现,RETN、CAV1、PLA2G16均参与脂肪的代谢、分化过程,为了进一步证实上述3个因子对绵羊的尾脂沉积与代谢性状的影响,有研究采用半定量RT-PCR方法检测了 RETN、CAV1、PLA2G16基因在滩羊尾脂组织中的表达[2-3]。滩羊是长脂尾型绵羊,其独特的尾脂在维持机体正常的新陈代谢和体温过程中扮演了重要的角色,但截至目前国内外有关尾脂沉积与代谢调控机制的报道较少。近年来,有国外学者提出 RETN、CAV1和 PLA2G16基因可能参与了脂肪沉积与代谢生物学过程[4],因此,研究 RETN、CAV1和 PLA2G16基因在滩羊尾脂沉积调控中的作用及机制,对揭示滩羊尾脂沉积与代谢的具体机制有重要的科学意义。PDGFD是PDGF 4个家族成员中促进增殖作用最强的一个,它最早是在人类血小板中被检测并纯化出来的,其隐藏在α颗粒中并释放出来,对血小板起到激活作用。PPARG能够调控脂肪细胞的生长分化过程。PPARG在蛋白质、葡萄糖及脂质的代谢过程中也具有重要调控作用,能够调控细胞增殖、细胞周期和生长发育过程中部分相关基因的表达。林婄婄等[5]对不同脂尾型绵羊脂肪组织中的PPARG基因发育性表达进行了研究,结果表明,PPARG基因的表达在品种间存在差异,广灵大尾羊(长脂尾型)尾脂组织中PPARG基因的表达量高于小尾寒羊(短脂尾型),且月龄对PPARG基因的表达无显著影响。刘真等[6-7]基于蒙古羊(短脂尾型)和藏羊 (瘦尾型)群体的 Illumina Ovine SNP 50K芯片分型数据,采用FST法有效检测到受选择的基因,其中,部分基因与绵羊重要性状相关,并通过相对定量试验证明PPARG基因和PDGFD基因与尾部脂肪沉积密切相关,可以作为尾型选育的候选基因。栾兆进等[8]研究发现,激素敏感脂肪酶(hormone-sensitive lipase,HSL)基因(HSL)对肌内脂肪的沉积可能具有抑制作用。
