过表达miR-124a对J774.1细胞中TNF-α和IL-6表达水平及细胞周期的影响
2018-10-10尹芳蕊庞春艳耿立霞王永福
尹芳蕊,庞春艳,耿立霞,王永福
(包头医学院第一附属医院风湿免疫科 包头医学院风湿免疫研究所 内蒙古自治区自体免疫学重点实验室,内蒙古 包头014010)
类风湿性关节炎(rheumatid arthritis,RA)是慢性炎症性自身免疫性疾病,影响约世界1%人口,是造成伤残的最普遍原因之一,但迄今为止 RA 病因和发病机制尚未完全明确,被认为是遗传、免疫和环境相互作用的结果[1-2]。免疫系统中巨噬细胞、树突状细胞、肥大细胞和NK细胞失调发生在RA的不同阶段,在其发展过程中具有重要意义,早期RA 可无典型症状或仅呈现出单一临床症状,且缺乏特异性诊断方法,探寻灵敏度高、特异度好的早期诊断标志物和特异的治疗靶点是 RA 诊断治疗的最终目标[3]。微小RNA(microRNA, miRNA )是非编码小分子 RNA, miRNA与机体的免疫调节密切相关,多种 miRNA 在RA中异常表达[4-6],与 RA 的发生、发展、预后和转归关系密切,检测 与RA 有关的 miRNA 谱,可为 RA 的早期诊断提供新的依据,为 RA 的治疗提供新的选择[7]。人类miR-124的3个编码基因位于8q12.3、8p23.1和20q13.33,miR-124的表达异常可诱发多种疾病产生及发展。miR-124 高度保守,在脑和脊髓神经元中大量表达,目前研究多集中在其与神经和脑疾病的相关性方面。miR-124a可促进神经元的分化[8],是一种脑神经保护和脑功能恢复的新的生物标志物[9]。研究[10-11]表明:miR-124可抑制肿瘤细胞的增殖、侵袭和转移,促进肿瘤细胞的凋亡。
miR-124与风湿病的相关研究国内外少见报道。Nakamachi等[12]研究发现:miR-124可抑制佐剂性关节炎鼠模型的关节炎症状,减少滑膜细胞增殖、白细胞浸润、软骨或骨破坏,用pre-miR-124处理后佐剂性关节炎鼠模型的破骨细胞计数及核因子κB受体激活因子配体(receptor activator of nuclear factor κB ligand,RANKL)、整合素β1(integrin β1,ITGB1)和核因子活化的T细胞的细胞质(activated T cells cytoplasmic 1,ATc1)表达水平均降低。
以上研究在动物水平验证了miR-124可改善佐剂性关节炎鼠模型临床症状,抑制关节炎的发展,但miR-124与RA细胞水平的研究尚未见报道。本研究从细胞水平设计通过miRNA-124a的过表达腺病毒载体,感染RA细胞模型小鼠巨噬细胞J774.1,探讨miRNA-124a对小鼠巨噬细胞J774.1的可能作用机制,以期为RA的治疗提供细胞水平的实验依据。
1 材料与方法
1.1 细胞株、主要试剂和仪器 J774.1细胞株购自上海轩研生物科技有限公司,过表达miR-124a的腺病毒液和miR-124a腺病毒阴性对照液购自武汉淅玛公司,白细胞介素6(IL-6)及肿瘤坏死因子α(TNF-α) ELISA试剂盒购自上海生物工程有限责任公司,胎牛血清、胰蛋白酶和DMEM培养液购自美国Gibco公司,反转录试剂盒、Trizol和荧光定量试剂盒购自日本 TaKaRa 公司,荧光显微镜购自日本Olympus公司,酶标分析仪购自深圳雷杜生命科学股份有限公司,荧光定量 PCR 仪购自中国 BIOER公司,FACSCantoⅡ流式细胞仪购自美国BD公司。
1.2 细胞培养及miRNA转染 J774.1巨噬细胞用含100 mL·L-1FBS的DMEM/F12 培养基培养。将生长状态良好的J774.1细胞,胰酶消化培养,取对数生长期细胞,以每毫升1×106个细胞均匀接种于培养皿,当细胞融合度达到60%时进行转染,细胞实验分为3组,即miR-124a过表达组(感染miR-124a腺病毒载体)、空载腺病毒组(感染阴性病毒液)和空白对照组(不做任何处理),设置3个复皿,感染48 h后在倒置显微镜的荧光视野和明视野下观察细胞感染状态,流式细胞仪检测感染效率,感染效率=感染阳性细胞数/检测总细胞数×100%。
1.3 ELISA法检测细胞上清液中IL-6 和TNF-α水平 上述3组感染48 h后的细胞上清液按IL-6和TNF-α检测试剂盒的说明书进行操作,检测IL-6和TNF-α的表达水平。加样,37℃温育30 min,洗涤5次,加酶标抗体50 μL,温育、 洗涤,加显色液显色,检测其吸光度(A)值,根据标准曲线计算出IL-6和TNF-α的水平。
1.4 RT-PCR法检测细胞中IL-6 和TNF-α mRNA表达水平 3组细胞感染48 h后,弃除培养液,PBS清洗2次,用 Trizol 法提取上述3组细胞的总RNA,反转录试剂盒将 RNA反转录合成cDNA,RT-PCR法检测IL-6和TNF-α mRNA的相对表达水平,引物由上海生工生物有限公司合成。根据Ct值采用 2-ΔΔCt法计算目的基因的相对表达水平,ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=实验组Ct值-对照组Ct值。
1.5 流式细胞术检测细胞周期 收集3组样本细胞制成单细胞悬液,细胞数量为每毫升2×106个细胞,75%冰冻乙醇4 ℃过夜,重悬细胞后加入20 μL RNA酶,37℃水浴30 min,加入400 μL碘化丙啶(PI)进行DNA染色,轻轻混匀后4℃避光孵育60 min,使用BD流式细胞仪检测,每组进行3次独立重复实验,实验数据用 ModFit LT软件进行分析。

2 结 果
2.1 荧光显微镜下观察miR-124a过表达腺病毒感染J774.1细胞 miR-124a过表达腺病毒感染J774.1细胞48 h后,应用荧光显微镜观察可见细胞发出绿色荧光,表明腺病毒成功有效地感染J774.1细胞(图1,见插页三)。
2.2 流式细胞仪检测3组细胞感染48 h后的感染效率 3组细胞感染48 h后,胰酶消化并收集,流式细胞仪分析腺病毒感染J774.1细胞的效率,结果显示:空白对照组、miR-124a过表达组和空载腺病毒组感染效率分别为42.8%和45.1%。见图2。

A: Blank control group B:Empty vector group C:miR-124a group.
Fig.2 Infection efficiencies of J774.1 cells in various groups detected by flow cytometry
2.3 ELISA法检测3组细胞感染48 h后细胞上清中TNF-α和IL-6水平 3组细胞感染48 h后,ELISA法检测结果显示:miR-124a过表组细胞上清中TNF-α和IL-6水平明显低于空白对照组和空载腺病毒组(P=0.038,P=0.042;P=0.043,P=0.044)。见表1。
表1 3组细胞上清中TNF-α和IL-6水平
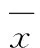
Tab.1 Levels of TNF-α and IL-6 in cell supernatant in three groups [n=3,±s,ρB/(ng·L-1)]
*P<0.05vsblank control group;△P<0.05vsempty vector group.
2.4 RT-PCR法检测3组细胞中TNF-α和IL-6 mRNA表达水平 3组细胞感染48 h后,RT-PCR法检测TNF-α和IL-6 mRNA表达水平:miR-124a过表达组细胞中TNF-α和IL-6 mRNA表达水平明显低于空白对照组和空载腺病毒组(P=0.001,P=0.002;P=0.001,P=0.003)。见表2。
2.5 流式细胞术检测3组细胞感染48 h后不同细胞周期的细胞百分率 miR-124a腺病毒转染J774.1细胞48 h,与空白对照组和空载腺病毒组比较,miR-124a过表达组G1期细胞百分率明显升高(P<0.01),S和G2期细胞百分率明显降低(P<0.01),表明miR-124a感染小鼠巨噬细胞 J774.1 细胞后可以阻滞细胞周期于G1期。见表3。
表2 3组细胞中TNF-α和IL-6 mRNA表达水平
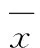
Tab.2 Expression levels of TNF-α and IL-6 mRNA in cells in three groups (n=3,±s)
*P<0.05vsblank control group;△P<0.05vsempty vector group.
表3 3组不同细胞周期细胞百分率
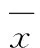
Tab.3 Percentages of cells at different cell cycles in three groups (n=3,±s,η/%)
*P<0.05vsblank control group;△P<0.05vsempty vector group.
3 讨 论
RA是慢性侵蚀性关节炎为特征的全身性自身免疫病,病变特点为关节滑膜炎症、骨侵蚀和关节破坏日益严重,最后导致程度不等的功能障碍和畸形,病因至今仍未阐明,免疫失衡和过度炎症可能是RA发病的核心环节。近年来研究[13-14]显示:辅助性T淋巴细胞和巨噬细胞及其分泌的细胞因子可侵蚀破坏关节,巨噬细胞作为一种炎症细胞,能够产生高浓度的细胞因子和促炎介质,从而加重炎症反应,最终导致关节破坏;巨噬细胞为RA的起始细胞,巨噬细胞的损伤和激活会引起机体炎症性反应。小鼠巨噬细胞J774.1具有正常巨噬细胞功能,可以产生TNF-α和IL-6[15]。因此本研究选择小鼠巨噬细胞J774.1作为RA研究的载体。体内的Th1/Th2 辅助T细胞及其分泌的细胞因子在体内维持机体的免疫自稳,Th1细胞主要分泌 IFN-γ和TNF-α 等细胞因子,Th2细胞分泌 IL-4和IL-6等细胞因子,然而在RA发生发展过程中这种平衡被破坏[16]。其中IL-6和TNF-α等重要促炎性细胞因子参与RA多种致病机制,人源化IL-6受体拮抗剂可以改善RA患者症状[17-18]。
miRNAs可通过调节炎性细胞因子表达而减缓RA临床症状,Yang 等[19]研究显示:miR-124参与胆碱能抗炎通路,对全身和局部炎症有明显的抑制作用,α7烟碱型乙酰胆碱受体 (alph α7 nicotinic acetylcholine receptors, α7nAChR)通过调节 miR-124 的表达,减少了IL-6 和TNF-α 的产生和释放,miR-124通过靶蛋白 STAT3 来减弱 IL-6的产生,通过降低TNF-α转化酶稳定性来调节 TNF-α蛋白表达。Qiu等[20]发现:miR-124是1个重要的炎症相关miRNA,miR-124可抑制TLR通路中IL-1受体相关激酶1 (IL-1 receptor-associated kinase 1) 和TNF 受体相关因子6(TNF receptor associated factor 6),发挥抗炎作用。王易林等[21]发现:在脂多糖诱导的小鼠急性肺损伤模型上,活化的过氧化物酶增殖体激活受体γ(peroxisome proliferators activated receptor γ,PPARγ) 通过上调miR-124 抑制小鼠肺组织炎性因子 IL-6和TNF-α 的表达,具有保护和防御急性肺损伤的作用。本研究结果显示:小鼠巨噬细胞J774.1细胞感染48 h后,miR-124a过表达组细胞上清中TNF-α和IL-6表达水平明显低于空白对照组和空载腺病毒组,细胞中TNF-α 和IL-6 mRNA表达水平明显低于空白对照组和空载腺病毒组,提示过表达的miR-124可以抑制RA细胞模型J774.1细胞炎性因子TNF-α和IL-6的释放,从而减缓RA的病情迅速进展。
本实验采用腺病毒感染J774.1细胞48 h后,采用流式细胞术检测miR-124a腺病毒转染J774.1细胞48 h后各组细胞的周期分布:miR-124a过表达组G1期细胞百分率与空载腺病毒组和空白对照组比较明显升高,S和G2期细胞百分率明显降低,提示miR-124a转染小鼠巨噬细胞J774.1细胞后可以阻滞细胞周期于G1期,miR-124a可能通过影响细胞周期的方式影响J774.1细胞的增殖。Nakamachi等[22]将miR-124a的前体转染RA患者滑膜细胞后可以抑制其增殖,并阻滞细胞周期于G1期,miR-124a结合在细胞周期激酶2(cyclin-dependent kinase 2,CDK-2) 和 单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)的3′端的非编码区,抑制CDK-2和MCP-1的表达。
综上所述,miR-124a抑制RA致病过程中重要炎症介质IL-6和TNF- α的分泌,并影响RA常用的细胞模型J774.1 细胞的增殖,在此推测miR-124a在RA发病中可能起着正调控作用,可能成为RA新的治疗靶点,但目前对其作用机制了解尚少,还需进一步深入探讨。
