外源性胰岛素对斑马鱼血糖及其转运的影响
2018-10-09鲁程瑶丁倩雯张洪玲张进雄周志刚
鲁程瑶, 张 震, 丁倩雯, 李 解, 刘 宇, 冉 超, 张洪玲, 张进雄, 周志刚
中国农业科学院饲料研究所, 农业农村部饲料生物技术重点实验室, 北京 100081
糖类参与构成鱼体细胞结构,为鱼类正常生命活动提供能量,也是合成体脂和非必需氨基酸的重要原料。摄入的糖类在消化道内经淀粉酶、麦芽糖酶水解为单糖被吸收;吸收后的单糖在肝脏及其他组织进一步氧化分解释放能量,或用于合成糖原、脂肪、氨基酸,或参与合成其他生理活性物质。葡萄糖氧化分解是多数哺乳动物能量来源的主要途径,血糖(葡萄糖)是糖类在体内的主要运输形式,糖原是糖类在体内的储存形式。但大量研究表明,鱼类主要以蛋白质和脂质作为能源物质,与哺乳动物相比,鱼类对糖类的利用能力低下,被认为是先天性的糖尿病患者[1]。当饵料中糖类含量超过一定限度时,鱼类会出现抗病力降低、生长迟缓、死亡率提高、脂肪肝等现象[2~5]。
胰岛素是唯一降血糖的激素,被认为是调节和维持哺乳动物血糖平衡最为重要的调节因子[6,7]。但是在鱼类糖代谢研究中,胰岛素分泌不足被认为是导致鱼类糖耐受能力低下的主要原因[1,8,9]。此外,胰岛素可促进组织摄取血液中的葡萄糖,从而维持血糖的稳定,其中葡萄糖转运蛋白家族(glucose transporters,GLUTs)发挥着重要作用,即葡萄糖通过细胞膜上的GLUTs经易化扩散作用进入细胞,因此,鱼类葡萄糖转运迟缓也被归为导致鱼类糖利用能力低下的原因之一。
斑马鱼(Daniorerio)属于辐鳍亚纲、鲤科、短担尼鱼属的一种硬骨鱼。斑马鱼个体小、后代数量多、养殖周期短,便于实验室养殖[10],且其全基因组测序已完成[11],转基因及敲除斑马鱼系也已建立[12,13],因此,斑马鱼是进行营养基因组学和营养免疫分析的理想模式生物[14]。其也可用于生长、营养、免疫、毒理等研究领域[15~18],可节约时间成本和经济成本。
本研究旨在确定斑马鱼是否存在糖利用障碍并探究其原因,以及进一步探讨外源性胰岛素对斑马鱼维持血糖稳定的作用及机制。
1 材料与方法
1.1 试验材料
试验用斑马鱼购自北京中蔬大森林花卉市场,3月龄左右的健康活泼、规格一致的斑马鱼暂养于中国农业科学院饲料研究所农业部饲料生物技术重点开发实验室的循环水养殖系统内,每天接近饱食投喂饲喂2次(8:30和16:30),暂养7 d后开始试验,养殖全程水温控制在28.0~30.0℃,pH 6.8~7.5,光照周期为12 h/12 h,每周更换30%的养殖水。
1.2 斑马鱼血浆采集及测定
采用断尾法采血。将斑马鱼置于冰水浴中麻醉,吸尽鱼体表面水分,用无菌手术剪剪断鱼尾后,置于肝素钠抗凝管中,高速冷冻离心机4℃、2 000 r/min离心2 min后吸取血浆,每3~5尾鱼血样混合。
1.3 葡萄糖耐受试验及胰岛素含量测定
斑马鱼最后一次饲喂结束后,饥饿72 h,随后冰水浴麻醉,吸尽鱼体表面水分,称重后按每0.1 g体重注射1 μL溶液的比例腹腔注射浓度为0.1 g/mL的葡萄糖溶液。在腹腔注射后的0.5 h、1 h、2 h、3 h、6 h采血浆并分别根据南京建成生物工程研究所葡萄糖测定试剂盒和上海酶联生物技术有限公司胰岛素试剂盒的操作说明检测血糖及胰岛素含量。处理组中雌、雄比例为1∶1,各20尾;对照组(仅腹腔注射灭菌去离子水)中雌、雄比例为1∶1,各10尾鱼。
1.4 胰岛素梯度试验
Polakof等[19]统计,鱼类胰岛素腹腔注射剂量一般为1~100 IU/kg,哺乳动物的用量一般为1~2 IU/kg,以此为依据,将胰岛素加入到0.1 g/mL葡萄糖溶液中,制成低(1.25 IU/kg)、中(12.5 IU/kg)、高(125 IU/kg)3个浓度的胰岛素和葡萄糖共注射溶液。斑马鱼最后一次饲喂后,饥饿72 h,随后冰水浴麻醉,吸尽鱼体表面水分,称重后按每0.1 g体重腹腔注射1 μL溶液的比例注射。在腹腔注射后的0.5 h、1 h、2 h、3 h、6 h采血浆检测血浆胰岛素含量。处理组中雌、雄比例为1∶1,各20尾;对照组中雌、雄比例为1∶1,各10尾鱼。
1.5 斑马鱼肝胰脏总RNA提取
斑马鱼最后一次饲喂后,饥饿24 h,随后置于冰水浴麻醉并无菌剖取肝胰脏,将肝胰脏置于加有1 mL Trizol试剂的1.5 mL EP管中并进行匀浆,再向匀浆液中加入200 μL三氯甲烷后剧烈震荡,静置5 min后于4℃、12 000 r/min离心10 min。将上清液转移至新的EP管中,加入等体积异丙醇,颠倒混匀,置于-20℃过夜进行核酸沉淀。随后,4℃、 12 000 r/min离心10 min得到沉淀,于超净台内吹干后加入30~50 μL DEPC水。测定RNA浓度后,按照1 μg的量进行反转录,RNA反转录试剂盒购自北京全式金生物科技有限公司。
1.6 实时荧光定量PCR检测目的基因表达
实时荧光定量PCR使用Tiangen SYBR Green染料,体系为10 μL:5 μL SuperReal Pre-Mix Plus、正反向引物各0.5 μL、cDNA模板2 μL,加RNase-Free ddH2O至10 μL。采用两步扩增法:95℃预变性10 min;95℃变性5 s,55~60℃退火30 s,共40个循环。反应结束后统计Ct值,采用2-ΔΔCt法处理数据后绘图,并以核糖体蛋白S11(rps11)表达水平作为参照。每个基因表达量的检测设置6个生物学重复。引物序列见表1。

表1 斑马鱼引物序列Table 1 Primer sequences for zebrafish.
注:insa:胰岛素a;insb:胰岛素b;glut3:葡萄糖转运蛋白3;glut10:葡萄糖转运蛋白10;glut12:葡萄糖转运蛋白12;glut13.1:葡萄糖转运蛋白13.1;glut13.2:葡萄糖转运蛋白13.2。
1.7 数据分析
采用GraphPad Prism 5统计软件对试验数据进行单因子方差分析,结果以平均值±标准误(mean±SE)表示,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 糖负荷对斑马鱼高血糖的影响
为了探究糖负荷状态下斑马鱼的血糖变化以及性别间是否存在差异,分别对雌、雄斑马鱼开展葡萄糖耐受试验。结果显示(图1),虽然腹腔注射对鱼造成应激,引起血糖升高,但与对照组相比,无论雌、雄,斑马鱼腹腔注射葡萄糖后血糖水平均显著升高(P<0.001),需1 h才到达峰值,随后逐渐降低[2 h时显著降低(P<0.001)],直至6 h才恢复到正常水平。并且,各个时间点雌、雄斑马鱼血糖水平没有显著性差异。外源葡萄糖注射造成了斑马鱼的持续高血糖,表明斑马鱼存在糖利用障碍。

图1 性别对斑马鱼血糖的影响Fig.1 Effect of gender on blood glucose of zebrafish.
2.2 斑马鱼持续高血糖的原因分析
为探究造成斑马鱼持续高血糖的原因,对斑马鱼血浆胰岛素水平以及胰岛素基因、葡萄糖转运蛋白基因的表达情况进行了分析。由2.1可知,斑马鱼在糖负荷状态下,血糖在1 h时达到最高,2 h时降低并且能在组与组间分析差异,6 h时恢复到正常水平,因此,后续试验中仅对1 h、2 h、6 h的斑马鱼血浆中胰岛素含量进行检测。
在糖负荷状态下,与对照组相比,葡萄组斑马鱼血浆胰岛素水平并未显著升高(图2A),但斑马鱼胰岛素基因insa、insb的表达显著上调(图2B~D);葡萄糖转运蛋白基因的表达在2 h时才呈现上升趋势,不存在显著差异,且滞后于胰岛素基因的表达,6 h时表达水平降低,其中glut12、glut13.1差异极显著(P<0.01)(图3)。结果提示,斑马鱼持续高血糖的原因包括胰岛素分泌不足和葡萄糖转运迟缓。
2.3 外源性胰岛素对斑马鱼血糖的调节作用
由图4可看出,低(1.25 IU/kg)、中(12.5 IU/kg)、高(125 IU/kg)3种浓度的胰岛素与葡萄糖溶液共注射进入斑马鱼体内后,均表现为0~1.0 h血糖升高,2~6 h逐渐降低恢复至正常水平,说明外源性胰岛素具有降低斑马鱼血糖的作用。但是125 IU/kg胰岛素浓度组的血糖一直处于较低水平,且变化趋势不明显,表明125 IU/kg胰岛素注射浓度过高;1.25 IU/kg、12.5 IU/kg浓度胰岛素均能使斑马鱼血糖在2 h时恢复到正常水平,且二者没有显著差异,故选择1.25 IU/kg为最适腹腔注射浓度。
2.4 外源性胰岛素对胰岛素分泌及其基因表达的影响
糖负荷状态下,注射最适浓度的胰岛素(1.25 IU/kg),斑马鱼血糖在1 h达到峰值,但胰岛素组血糖含量显著低于葡萄糖组(P<0.05),并且2 h时血糖已恢复至正常水平,而葡萄糖组3 h时血糖仍处于较高水平(图5)。进一步对斑马鱼血浆胰岛素水平及其基因表达情况进行分析,外源补充胰岛素使斑马鱼血浆胰岛素水平升高,6 h时仍极显著高于葡萄糖组(P<0.001)(图6A);而胰岛素基因表达则被抑制,即1 h时insa的表达极显著低于葡萄糖组(P<0.001),2 h时insa、insb的表达均显著低于葡萄糖组(P<0.05),且对胰岛素基因的抑制直至6 h才得到缓解(图6B~D)。结果表明外源性胰岛素能促进糖负荷状态下斑马鱼血糖的恢复,但是对肝胰脏胰岛素基因表达具有反馈抑制作用。

图2 糖负荷状态下斑马鱼血浆胰岛素含量(A)及其基因表达(B~D)Fig.2 Plasma insulin content(A) and insulin gene expression (B~D) of zebrafish under glucose loading.注:*、**、***分别表示处理组与对照组在P<0.05、P<0.01和P<0.001水平上差异显著。

图3 糖负荷状态下斑马鱼葡萄糖转运蛋白基因表达Fig.3 Expression of glucose transporters genes under glucose loading.注:**表示处理组与对照组相比差异显著(P<0.01)。

图4 不同浓度胰岛素对雄性斑马鱼(A)和雌性斑马鱼(B)血糖的影响Fig.4 Effects of different concentrations of insulin on blood glucose in male (A) and female (B) zebrafish.

图5 外源胰岛素对斑马鱼血糖的影响Fig.5 Effect of exogenous insulin on zebrafish blood glucose.
2.5 外源性胰岛素促进对葡萄糖的转运
前述研究表明,糖负荷状态下,葡萄糖转运迟缓是造成斑马鱼持续高血糖的原因之一。而对于外源性胰岛素是否能促进对葡萄糖的转运,需要进一步分析。由图7可看出,注射胰岛素后,1 h时glut3、glut10、glut12、glut13.1和glut13.2基因表达均无显著差异;2 h时呈现上调趋势,其中glut3、glut12的表达水平均显著高于葡萄糖组(P<0.05);6 h时,除glut13.1上调(P>0.05)外,各基因的表达水平与2 h相比下调,但未达到显著水平。说明糖负荷状态下,外源性胰岛素具有促进斑马鱼对葡萄糖的转运的作用。
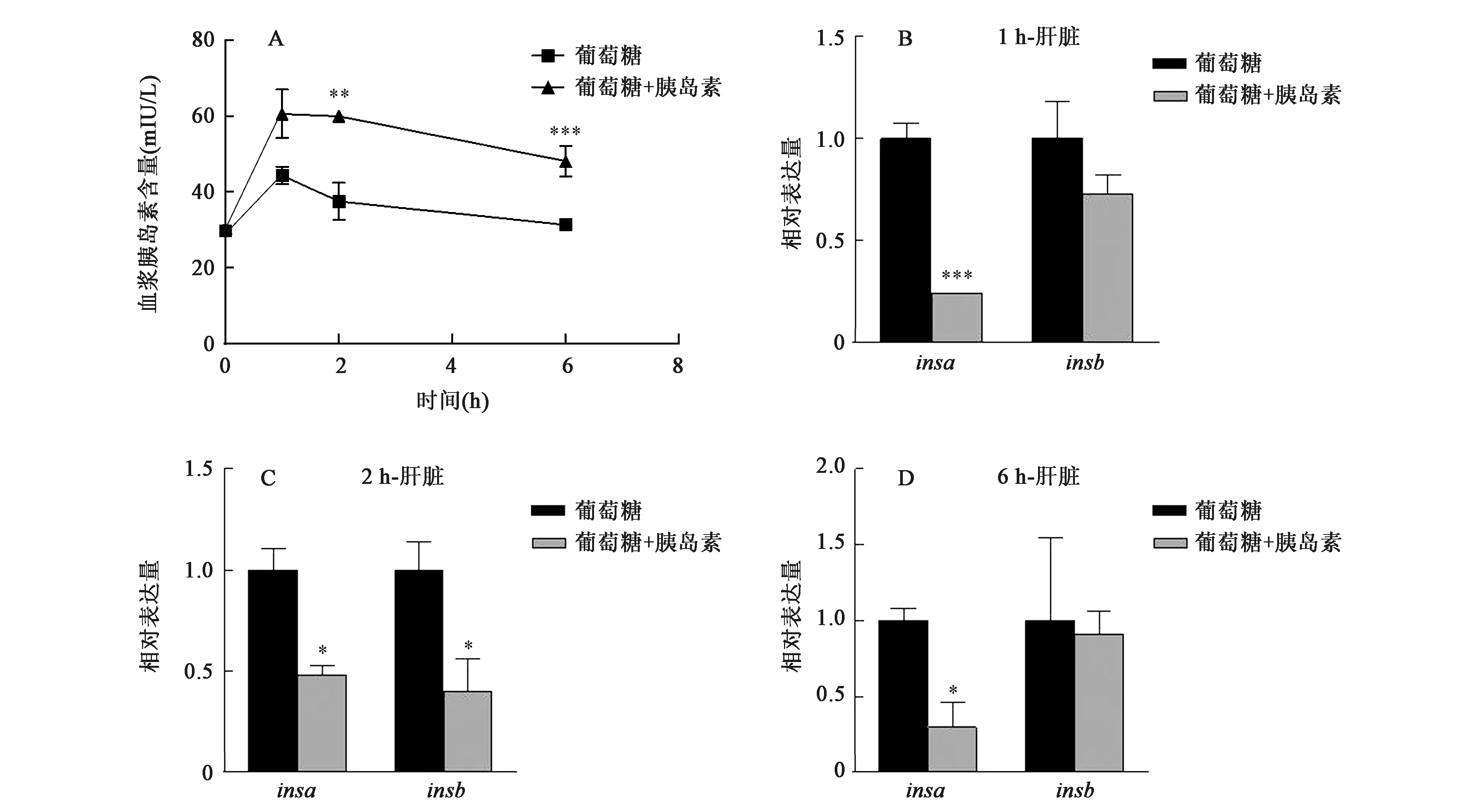
图6 糖负荷状态下外源胰岛素对斑马鱼胰岛素含量(A)及其基因表达(B~D)的影响Fig.6 Effect of exogenous insulin on insulin content(A) and gene expression (B~D) under glucose loading.注:*、**、***分别表示处理组与葡萄糖组在P<0.05、P<0.01和P<0.001水平上差异显著。

图7 糖负荷状态下外源胰岛素对斑马鱼葡萄糖转运蛋白基因的表达情况Fig.7 Effect of exogenous insulin on expression of zebrafish glucose transporters genes under glucose loading.注:*表示与葡萄糖组相比差异显著(P<0.05)。
3 讨论
糖类是鱼体必需的代谢供能底物之一,与鱼体的生理功能和生存能力密切相关。哺乳动物的食物中的糖含量一般在50%~60%,杂食性和草食性鱼类饵料糖含量一般在30%~40%,肉食性鱼类饵料糖含量一般不超过20%[20]。如肉食性的鲑鳟、鲈鱼及点篮子鱼,当其饵料中糖含量超过25%时,其消化率、饲料利用率和生长率明显降低[21,22]。正常人在口服一定剂量的葡萄糖溶液后30 min左右血糖达到最高,经2.0 h左右回到空腹水平。但从现有的鱼类糖耐受试验结果来看,与人和哺乳动物相比较而言,大多数鱼类在葡萄糖负荷后血糖均升高,并维持较长时间的高血糖现象[19,23](表2)。本研究结果与大多数鱼类研究结果一致,斑马鱼腹腔注射葡萄糖溶液后,6 h才逐渐恢复至正常水平,表现出持续的高血糖现象。而且,人类、猕猴以及大鼠中,雄性的血糖水平高于雌性[31~37],但是本研究结果表明雌、雄斑马鱼的血糖变化趋势一致,说明斑马鱼的血糖不存在性别差异。

表2 鱼类糖耐受试验结果Table 2 Glucose tolerance tests of fish.
胰岛素可以促进细胞摄取葡萄糖,促进糖原合成,并抑制糖原降解。对于哺乳动物,血糖升高后方能诱导和促进胰岛素分泌。正常人基础血浆胰岛素水平为5~20 mIU/L;口服葡萄糖30 min左右上升至峰值(可为基础值的5~10倍,多数为50~100 mIU/L),然后逐渐降低,3 h后降至基础水平。但是对于摄取糖类是否可以诱导鱼类胰岛素分泌尚存争议[38~45]。本研究发现,斑马鱼在糖负荷状态下,与对照组相比,葡萄糖组胰岛素基因表达上调,但血浆胰岛素水平并未出现显著差异。这与在虹鳟中获得的结果一致[41]。而且与葡萄糖组相比,注射胰岛素组斑马鱼血糖显著降低,即胰岛素组斑马鱼2 h时血糖已恢复至正常水平,而葡萄糖组3 h仍处于高血糖状态;说明胰岛素分泌不足是引起斑马鱼糖负荷后持续高血糖的原因之一,而外源补充胰岛素能促进斑马鱼血糖的降低。
然而,糖负荷状态下,外源补充胰岛素会抑制机体自身胰岛素的分泌及相关基因的表达。用浓度为150 mg/dL的葡萄糖体外灌注犬的胰腺,当外源性猪胰岛素以180~420 μU/mL的浓度加入灌注液时,胰腺分泌的胰岛素显著减少,外源性胰岛素反馈抑制自身胰岛素的分泌[46]。体内研究亦表明,外源性胰岛素对机体自身胰岛素的分泌及相关基因的表达具有负反馈作用[47~50]。如在注射胰岛素的低血糖大鼠中,胰岛素原mRNA水平减少58%(P<0.01);在注射胰岛素的高血糖大鼠中,胰岛素原mRNA水平减少44%(P<0.01)[51]。本研究与上述研究结果一致,糖负荷状态下外源补充胰岛素使斑马鱼胰岛素基因表达显著下调(P<0.05),说明外源性胰岛素对斑马鱼肝胰脏胰岛素基因也具有反馈抑制作用。
机体糖稳态是通过维持机体糖异生以及葡萄糖的吸收和储存之间的平衡得以实现的。由消化道吸收或非糖物质转化而来的葡萄糖经血液循环运送到各组织,供全身利用。由于葡萄糖是一种极性分子,不能经自由扩散通过细胞脂质双分子层的疏水结构,除小肠和肾小管可以通过钠-葡萄糖协同转运蛋白(sodium-glucose co-transporters,SGTLs)主动转运吸收葡萄糖外,其他组织细胞都必须经细胞膜上的葡萄糖转运蛋白(GLUTs)将葡萄糖转运进细胞[52]。过去,大多数学者将鱼类对葡萄糖利用率低下的部分原因归结为转运载体的缺失[53]。但随着科学技术的发展以及分子技术手段的不断提升,诸多研究表明鱼类存在GLUTs并在调节葡萄糖的吸收方面发挥重要作用[39,54,55]。与对照组和胰岛素组结果一致,葡萄糖组在腹腔注射葡萄糖后6 h血糖恢复到正常水平,但GLUTs基因表达未显著上调,且出现上升趋势的时间点滞后于血浆胰岛素水平及其基因表达,说明葡萄糖转运迟缓也是造成斑马鱼持续高血糖的原因之一。
本研究还发现在外源性胰岛素的作用下,GLUTs的表达增加,说明外源性胰岛素能促进斑马鱼血糖转运,但其作用方式及机制有待于进一步探究。鉴于GLUTs在哺乳动物葡萄糖转运中发挥的重要作用,若能探明鱼类GLUTs的种类、表达量、功能及作用机制,将有助于了解鱼类的糖代谢机制,为促进鱼类对糖类的利用提供有力支持。
