SOX9基因在癌症发生发展中的作用机制研究进展
2018-10-09赵敏蝶刘学东
吴 尽, 肖 慧, 赵敏蝶, 丁 新, 郑 冬, 刘学东
东北林业大学野生动物资源学院, 哈尔滨 150040
SOX9是调控性别和骨骼发育不可或缺的转录因子。该因子协调Y染色体上SRY基因一过性表达所起始的一系列基因互作,从而调控具有两性潜能的生殖腺形成睾丸。目前,对于SOX9在性别和骨骼等发育中的关键作用已有较明确的证据和结论。癌症是威胁人类生命健康最严重的疾病之一,其发病率与死亡率一直高居各种疾病之首。目前已发现的癌症类型有100多种,但病因与发病机制尚未完全阐明。癌细胞是产生癌症的病源,有无限增殖、可转化和易转移三大特点,能够无限增殖并破坏正常的细胞组织。癌细胞除了分裂失控外(能进行多极分裂),还会局部侵入周遭正常组织甚至经由体内循环系统或淋巴系统转移到身体其他部位。近年来,有证据表明SOX9基因的表达与癌症发生相关联,其分子机制研究目前仍处于不断推进和积累阶段。本文将对SOX9调节癌症发生的机理进行综述,包括SOX9基因在癌细胞中的表达机制及其调节、SOX9调节癌症发生理论假说,以及SOX9作为潜在药物靶标的可能性评估,以期为临床上治疗SOX9介导的癌症提供理论基础,同时为相关机制的研究提供参考。
1 SOX9基因的发现及其功能概述
早在1994年,Wagner等[1]在骨骼发育缺陷(campomelic dysplasia, CMD)的患者体内第一次发现SOX9(SRY-related high mobility group-box gene9)的存在。随后,Foster等[2]在同一年确定人类的SOX9基因位于染色体17q24.1~q25.1,长度为3 934 bp,含两个内含子和一个开放阅读框,可编码509个蛋白。位于常染色体的SOX9基因与位于性染色体Y上的性别决定基因SRY(Sex determining region of Y chromosome)同源[3],SOX9基因编码表达转录因子SOX9,含HMG盒(HMG-box),属SOX家族。SOX家族有20个成员,参与胚胎发育、性别决定、人类遗传综合征和恶性肿瘤发生[4],根据HMG结构域内的同源性以及其他结构特征和功能,可将SOX家族分为9个亚组[5]。其中SOX9在胚胎发生、男性性发育、器官发育、软骨细胞分化和干细胞特性中起着关键作用[2,6~8]。同时,SOX9对于神经发育和胰腺发育也有一定影响[9~11]。例如在男性性发育过程中,SOX9能够与类固醇生成因子1(steroidogenic factor 1)互作,从而促进睾丸支持细胞产生抗穆氏管荷尔蒙(anti-Müllerian hormone),抑制雌性生殖系统的产生[12],它还与一些其他基因相互作用以促进男性性器官的发育[13,14]。相似的,在软骨发育过程中,Sox9与L-Sox5和Sox6形成复合物,使L-Sox5和Sox6的表达上调,从而激活Col2a1、Aggrecan和Col11a2等软骨特异性分子的转录,促使间充质干细胞向软骨细胞方向分化[15]。
2 SOX介导的癌症发生发展调控机制与假说
2.1 SOX9在癌细胞中过表达的分子机制
临床研究发现,SOX9基因在大肠癌、前列腺癌和结直肠癌等许多实体癌中上调表达,并能促进癌细胞的生长[16]。癌症是危害人类健康的主要病因之一。近十年来,我国癌症发病率呈增长趋势,死亡人数占全部病因的四分之一,位居第一[17],如何治愈癌症是世界性难题。来自临床的数据显示SOX9基因与癌症的发生、发展存在关联。部分实验研究揭示SOX9基因在多种人类癌症组织中过表达,尤其是结肠癌、胰腺癌、前列腺癌、肺癌、外周神经癌和大脑癌等肿瘤组织发生中起关键作用[18](表1)。
SOX9基因在多种实体瘤中的过表达受一些信号通路调控。在前列腺癌、结肠癌和乳腺癌中均发现Wnt/β-catenin信号通路可调节SOX9表达[23,32,33]。前列腺癌细胞中,GSK3β(glycogen synthase kinase 3β)被抑制后能够上调SOX9的表达,反之,抑制β-catenin后能够下调SOX9,这表明Wnt/Bcatenin信号通路在前列腺癌中调节SOX9的表达[23]。结直肠癌发生通常是由良性的腺瘤息肉发展为有转移能力的浸润性癌[34],Matheu等[18]的研究发现,与正常结肠组织相比,腺瘤和癌组织中SOX9的表达水平显著增高,并随着晚期结直肠癌肿瘤阶段的增加而增加。在结肠癌模型中,SOX9直接结合并激活了多梳蛋白Bmi1的启动子,抑制了肿瘤抑制因子Ink4a/Arf位点,同时SOX9还能与激活的K-Ras(一种在结直肠癌发展期间经常突变的癌基因)协作,进一步促进肿瘤的转移。为了进一步弄清结肠癌细胞中SOX9过表达的分子机制,Blache等[32]采用基因定点突变等方法发现Wnt信号通路的转录效应因子TCF4可以直接作用SOX9从而上调SOX9的表达。在乳腺癌细胞中,研究人员发现SOX9可与Wnt/β-catenin信号通路形成正反馈机制,即SOX9缄默会减少癌细胞的增殖和侵袭,以及Wnt通路中LRP6和TCF4的转录,并降低Wnt/β-catenin活性;同时,SOX9表达量也被Wnt信号调节上调。在此正反馈机制中,SOX9位于增强Wnt/β-catenin信号的反馈中心地位,起着非常重要的作用[33]。除Wnt信号通路外,在皮肤基底细胞癌中Shh-Gli2信号通路会诱导SOX9过度激活[35]。在肺腺癌和食道腺癌中存在相似的Notch1信号通路上调SOX9的现象[36,37]。Capaccione等[36]对762例肺腺癌样本进行qPCR分析,发现与癌细胞周围的正常组织相比,SOX9 mRNA上的表达水平更高;用蛋白质印迹法和荧光素酶检测法处理其中的50个样本,并检测SOX9蛋白水平的表达量,进一步发现与相邻的正常组织相比,70%的样本中SOX9蛋白水平的表达量过高。这些数据表明SOX9基因在肺腺癌细胞中过表达。Jiang等[38]还发现上调SOX9能够诱导肺癌细胞的运动和侵袭。通过深入研究,Capaccione等[36]发现Notch1信号可以直接通过SOX9启动子上游顺式作用元件中的结合位点来调节SOX9的表达,此作用不依赖TGF-β途径,并且SOX9参与Notch-1诱导的细胞运动、细胞侵袭和E-钙粘蛋白表达的丧失。除肺癌外,在食道腺癌细胞中Notch1信号也能介导SOX9过表达。此外,还有研究显示在泌尿道上皮癌细胞和胰腺癌细胞中,SOX9分别受到表皮生长因子受体-细胞外信号调节激酶信号通路和NF-κB信号通路的调节而过表达[19,20]。上述研究陆续阐明了各实体癌中SOX9过表达的分子机制,证明了SOX9与肿瘤癌症发生发展的相关性,及其在肿瘤形成中的重要功能,这为进一步研发相关抗癌药物提供了分子生物学基础数据。
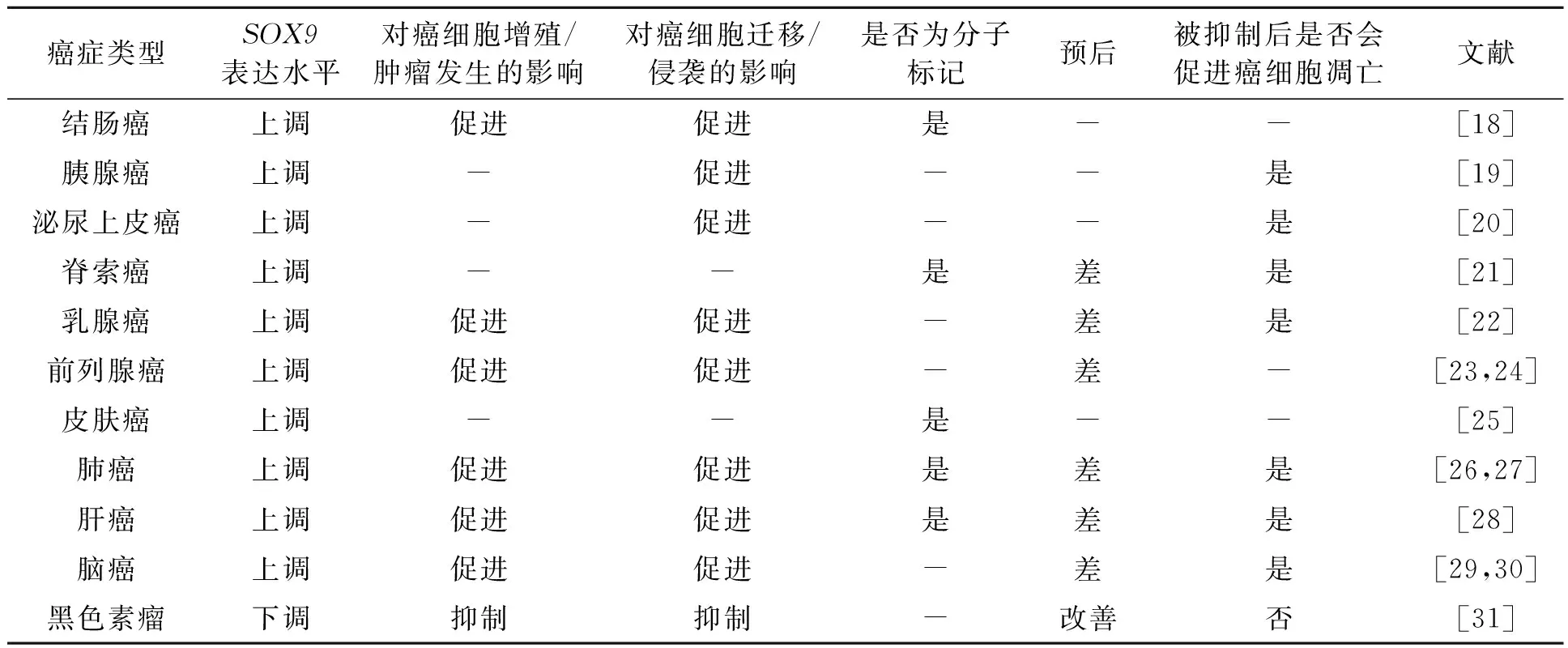
表1 SOX9在癌症中的表达及相关情况Table 1 SOX9 expression and related conditions in cancer.
注:“-”表示无数据。
2.2 负调控SOX9的表达机制
既然SOX9表达产物上调与部分癌症发生发展存在正相关性,细胞中是否存在内源性的负调控SOX9基因表达的机制呢?这个问题的研究对于回答SOX9基因及其产物是否能够成为治疗癌症的靶标具有重大意义。研究显示部分小RNA分子直接靶向SOX9并影响癌细胞的生长。脊索瘤是一种罕见的生长缓慢的肿瘤,它是由脊索的细胞残余引起的。Chen等[21]通过组织芯片和免疫组化分析发现SOX9在脊索瘤中表达广泛,且SOX9的较高表达水平与脊索瘤的不良预后相关。进一步的研究使用siRNA抑制脊索瘤中SOX9的表达,结果显示RNAi敲减SOX9能够抑制脊索瘤细胞生长、降低细胞运动性并诱导细胞凋亡以及细胞周期停滞。此外,SOX9抑制剂和化疗药物的组合能够增强脊索细胞的抗癌作用。这一结果提示SOX9能够成为治疗脊索瘤的潜在药物靶标。此外,在肝癌细胞中导入人工合成的microRNA miR-101-3p拟合物可以靶向负调控SOX9基因的表达,进而降低肝癌细胞的存活率。在该研究中,研究人员首先通过多个靶基因库预测出miR-101-3p靶向调节SOX9基因,并构建荧光素酶报告基因确定该靶基因的正确性。接着将miR-101-3p转染至肝癌细胞中,发现肝癌细胞的增殖被抑制,且大量凋亡[39]。Zhang等[40]进一步调查发现临床肝癌患者的五年生存率与miR-101的表达量高低存在正相关关系。这证明miR-101-3p能够靶向负调控肝癌细胞中的SOX9基因,抑制肝癌细胞增殖,促进肝癌细胞凋亡,并且能够通过这一系列作用影响肝癌患者的生存率。不仅是肝癌细胞,在胶质瘤细胞中miR-101也能起到相似的作用[41]。
抗生素也可缄默SOX9基因的表达。雷帕霉素是一种新型大环内酯类免疫抑制剂,研究发现它有望成为新的抗肿瘤药物[42]。Hardiman等[43]发现雷帕霉素能够抑制结直肠癌早期肿瘤的发生,这一过程通常伴随着SOX9表达水平下降。类似地,Garros-Regulez等[44]发现雷帕霉素通过缄默SOX2和SOX9基因的表达能够损害胶质瘤干细胞的活性。而Carrascogarcia等[45]发现,SOX9的表达水平能够影响雷帕霉素抑制癌细胞的作用功效。用相同浓度的雷帕霉素分别处理SOX9高表达和SOX9低表达的结直肠癌细胞,发现SOX9高表达的癌细胞凋亡率明显大于低表达的癌细胞。
除抗生素外,多肽也可对SOX9产生抑制作用。Brown等[46]在2011年发明了一种能够由多肽链组成的SOX9抑制剂,该抑制剂可以发挥功能性作用,通过对SOX9的抑制,达到治疗某些不良病理的目的。更重要的是,SOX9抑制剂会削弱癌细胞的自我更新和侵袭潜能,表明它可能被认为是晚期结直肠癌的新型治疗靶点。
2.3 SOX9调控癌症发生发展的理论假说及其作为治疗药物潜在靶标的可行性
在临床病理学上,SOX9的高表达与肿瘤发生发展呈正相关,而且在许多种癌症晚期,存在SOX9表达水平增高、肿瘤病人的整体存活率下降的现象[47]。这说明, SOX9在一些恶性肿瘤中起着促癌因子的作用。围绕这种促癌作用机制,有人提出如下观点:SOX9过表达为癌细胞提供了干细胞特性,能够维持结直肠癌干细胞和转移细胞的稳定性。近年来分子机制研究为这个观点提供了实验证据。例如,脊索瘤细胞与癌症干细胞相似,都具有化疗耐药、复发倾向和转移的特性,但是当敲除SOX9基因时,肿瘤干细胞标志物的表达减少[48]。相似地,在Carrascogarcia等[45]的实验中发现SOX9过表达为结直肠癌细胞提供了干细胞特性,SOX9能够维持结直肠癌干细胞和转移细胞的稳定性。SOX9在癌细胞中的功能非常重要,当抑制SOX9的表达,癌细胞的干细胞特性和转移能力也会受到影响,表明通过靶向负调控SOX9基因也许能成为一种新的治疗癌症的方法。同样的,来自Massague实验室的一项最新研究表明,SOX9对晚期肿瘤细胞的维持非常重要[49]。这一发现表明,将负调控SOX9表达定位为一种提高肿瘤治疗效果的策略,通过针对慢性周期性和静止性癌症干细胞样亚群来防止癌症复发是可行的。
3 展望
SOX9基因及其产物参与癌症发生发展为我们重新理解SOX9的功能提供了一个新的视角。但是目前证据还不足以全面阐明相关分子机制。作为转录因子,SOX9在癌症组织中所调控的基因表达网络具有什么特征?哪些通路调控癌症组织中SOX9基因的表达?SOX9如何维持癌症干细胞特性?这些问题仍有待解决。进一步研究SOX9调控癌症发生发展以及内源性负调控SOX9表达机制有助于阐明相关病理机理,并为疾病提供可行的治疗方法,对未来个性化与精准抗癌治疗的发展具有重要意义。
