抗菌肽Cn-AMP2双靶点抗菌机制的光谱学研究
2018-10-09王洁吴琦王宏兰孙晓杰衣同辉郭红艳齐晓丹刘哲丞
王洁 ,吴琦 ,王宏兰 ,孙晓杰 ,衣同辉 ,郭红艳 ,齐晓丹 ,刘哲丞
1.齐齐哈尔医学院物理教研室,黑龙江齐齐哈尔 161000;2.齐齐哈尔医学院临床生物化学教研室,黑龙江齐齐哈尔 161000;3.齐齐哈尔医学院生物化学实验室,黑龙江齐齐哈尔 161000;4.齐齐哈尔医学院生物化学教研室,黑龙江齐齐哈尔 161000
传统抗生素的发现和应用为治疗感染性疾病提供了非常有效的途径,但是细菌对传统抗生素耐药性日益严重,这导致了人们对寻找新型作用靶点和作用机制的抗菌药物研究。抗菌肽具有不同于传统抗生素的作用机制,不易产生耐药性,是抗生素的理想替代药物[1]。Cn-AMP类抗菌肽来源于拉丁美洲的绿椰子汁液[2]。抗菌肽Cn-AMP2是一条11个氨基酸组成的酸性多肽(氨基酸序列:TESYFVFSVGM)。该文通过Fmoc固相合成法合成了抗菌肽Cn-AMP2并测定其在不同溶液体系中的二级结构;然后测定了抗菌肽Cn-AMP2的抗菌活性。使用不同光谱探针测定了其对细菌细胞膜和基因组DNA的作用,现报道如下。
1 资料与方法
1.1 一般资料
9-芴甲氧羰基(Fmoc)-氨基酸、Rink amide MBHA树脂及2,2,2-三氟乙醇(TFE)购自吉尔生化(上海)有限公司;MH肉汤培养基购自北京陆桥技术有限公司。溴化乙锭和PBS溶液购置北京鼎国昌盛有限公司。
大肠埃希菌ML-35购自美国ATCC菌种保藏中心,大肠埃希菌ATCC25922,铜绿假单胞菌ATCC227 853,铜绿假单胞菌ATCC9027,肺炎克雷伯菌ATCC 700603,金黄色葡萄球菌ATCC25923,表皮葡萄球菌ATCC12228,藤黄微球菌ATCC4698,粪肠球菌ATCC 21912和枯草芽孢杆菌 ATCC6633购自中国普通微生物菌种保藏管理中心。
2545制备型高效液相色谱(Waters公司,美国);J-815型圆二色光谱仪(JASCO公司,日本);UV-2550紫外分光光度计(岛津公司,日本);RF-5301 PC型荧光分光光度计(岛津公司,日本)。
1.2 抗菌肽Cn-AMP2的合成与纯化
采用Fmoc固相多肽合成法合成多肽序列,使用Rink amide MBHA树脂为载体,9-芴甲氧羰基(Fmoc)-氨基酸为原料进行合成。合成结束后,粗肽用三氟乙酸(TFA)从树脂上切下来,利用2545制备型高效液相色谱进行制备。采用含0.1%TFA的双蒸水(A相)和含0.1%TFA的乙腈(B相)为流动相,用1 mL/min流速采用ACQUITY UPLC BEH300色谱柱进行梯度洗脱,收集纯品进行真空冷冻干燥得到多肽样品并进行质谱鉴定。
1.3 抗菌肽Cn-AMP2最低抑菌浓度MIC测定
将保存的菌株涂布LB固体培养基平板,于37℃培养24 h。挑取单克隆菌落接种MH液体培养基,37℃,180 rpm过夜振荡培养。用MH培养基将过夜培养的菌液稀释到 5×105CFU/mL,按 90 μL/孔加入到 96 孔细菌培养板中;将抗菌肽Cn-AMP2从1 mg/mL开始倍比稀释后,按10 μL/孔加入到菌液中;然后于 37℃,180 rpm,培养 24 h;测定 OD590nm,计算最低抑菌浓度MIC。重复操作3次,计算MIC平均值[3]。
1.4 抗菌肽Cn-AMP2二级结构测定
在25℃条件下,使用圆二色光谱仪测定抗菌肽Cn-AMP2的二级结构。分别在KP缓冲液(pH 7.0,50 mmol/L KH2PO4/K2HPO4,100 mmol/L KCl)及含有50%TFE的KP缓冲液中测定75 μmol/L多肽。测定波长范围OD190nm-OD250nm。使用摩尔椭圆率公式 [θ]=θ/10lCMn计算二级结构。
1.5 抗菌肽Cn-AMP2对细菌外膜渗透性实验
如果细菌外膜遭到破坏,N-苯基-1-萘胺 (N-phenyl-1-naphthylamine,NPN)会发出强烈荧光。选取大肠埃希菌和金黄色葡萄球菌,用含有5 mM NPN的pH 7.4,5 mM HEPES缓冲液调整对数生长期的细菌浓度调整为8×108CFU/mL后,加入终浓度为5 μg/mL,2.5 μg/mL和1.25 μg/mL的多肽进行测定。用生理盐水作为对照组。荧光测定的激发波长为350 nm、发射波长为420 nm。
1.6 抗菌肽Cn-AMP2与EB竞争性结合基因组DNA的荧光光谱
按照文献报道方法提取大肠埃希菌和金黄色葡萄球菌的基因组DNA。取浓度为500 μg/mL的大肠埃希菌和金黄色葡萄球菌基因组DNA溶液(含1.5 μg/mL EB)50 μL 加入加入等体积的抗菌肽 Cn-AMP2,37℃避光孵育10 min。用OD535nm波长激发,测量反应体系在OD550nm-OD750nm波长范围的荧光强度。
2 结果
2.1 抗菌肽Cn-AMP2的合成及纯化结果
使用Fmoc固相合成方式合成抗菌肽Cn-AMP2后,将冷冻干燥获得的粗肽用15%的乙腈溶解后,使用Waters 2545型高效液相色谱进行制备,收集多肽纯品并进行质谱鉴定(图1)。抗菌肽Cn-AMP2理论分子量为1 266.42 Da,质谱鉴定为1 266.40 Da(图2)。质谱鉴定结果表明多肽序列合成正确。
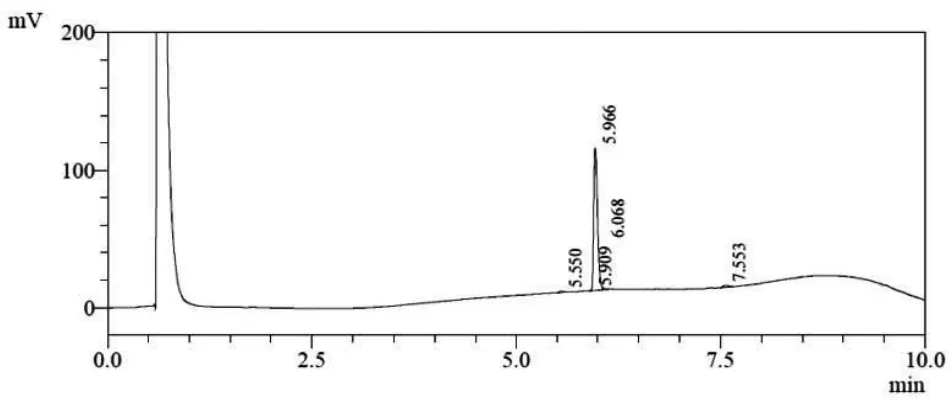
图1 抗菌肽Cn-AMP2纯化结果
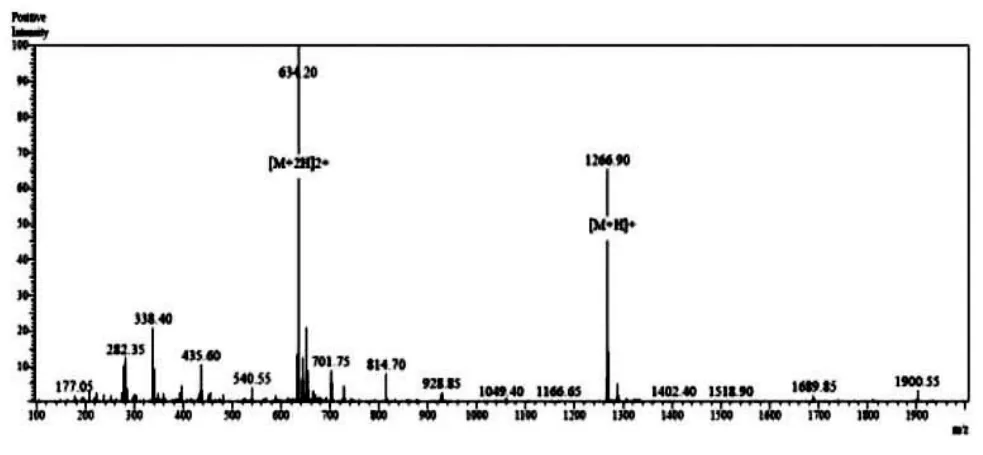
图2 抗菌肽Cn-AMP2质谱鉴定结果
2.2 抗菌肽Cn-AMP2最低抑菌浓度MIC测定结果
采用微量肉汤稀释法测定抗菌肽Cn-AMP2的最低抑菌浓度,实验结果表明抗菌肽Cn-AMP2对革兰阴性菌和革兰阳性菌都具有良好的杀伤效果,最低抑菌浓度在 50.0~100.0 μg/mL(表 1)。 实验结果说明抗菌肽Cn-AMP2是一条具有广谱抗菌活性的多肽。

表1 抗菌肽Cn-AMP2最低抑菌浓度MIC测定结果
2.3 抗菌肽Cn-AMP2二级结构测定结果
使用了KP缓冲液模拟生理环境,使用KP缓冲液/TFE混合溶液模拟细菌细胞膜疏水环境。在KP缓冲液中,抗菌肽Cn-AMP2在OD222nm波长处椭圆率为590 degree·cm2·dmol-1, 表明抗菌肽 Cn-AMP2 的结构为无规卷曲结构。但在KP缓冲液/TFE混合溶液,抗菌肽Cn-AMP2在OD222nm波长处椭圆率为-2 548 degree·cm2·dmol-1,表明抗菌肽 Cn-AMP2 的结构为螺旋结构(图3)。
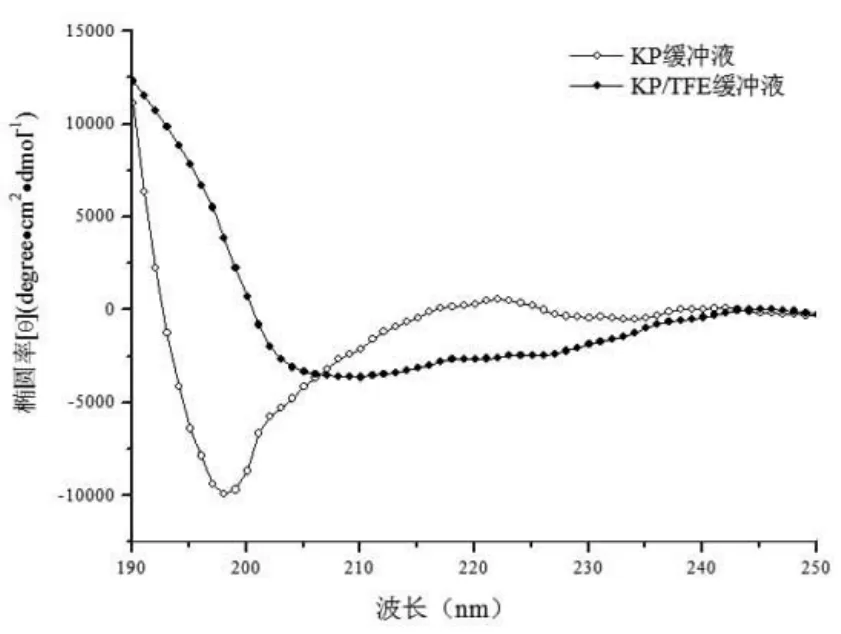
图3 抗菌肽Cn-AMP2在不同溶液体系中的二级结构
2.4 抗菌肽Cn-AMP2对细菌外膜渗透性实验结果
细菌外膜渗透性实验中,当不同浓度的抗菌肽Cn-AMP2与大肠埃希菌和金黄色葡萄球菌作用后,荧光染料NPN产生了强烈荧光(图4、图5)。实验结果荧光染料NPN在2~3 min左右插入到细菌细胞外膜的疏水性核心区。说明细胞膜是抗菌肽Cn-AMP2的作用靶点之一。
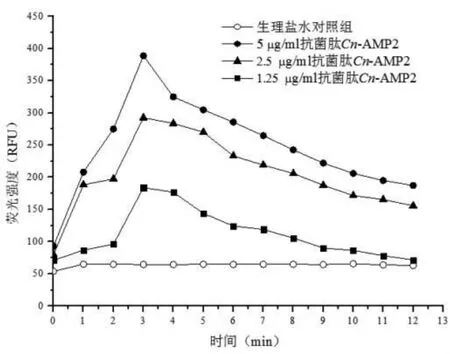
图4 抗菌肽Cn-AMP2与大肠埃希菌细胞膜作用结果
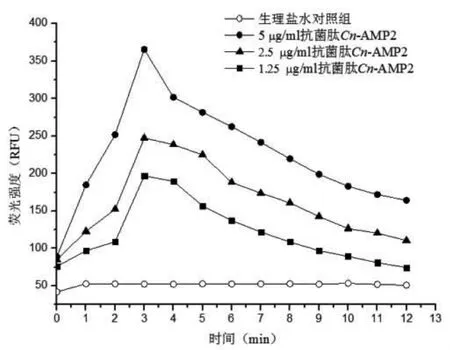
图5 抗菌肽Cn-AMP2与金黄色葡萄球菌细胞膜作用结果
2.5 抗菌肽Cn-AMP2与EB竞争性结合基因组DNA的荧光光谱
抗菌肽Cn-AMP2加入到基因组DNA和溴化乙锭EB的混合体系后,EB-DNA复合体系的荧光强度发生明显的衰减,并且随着抗菌肽Cn-AMP2浓度增加荧光强度不断降低;说明抗菌肽Cn-AMP2与EE竟争性结合大肠埃希菌和金黄色葡萄球菌基因组DNA,基因组DNA是抗菌肽Cn-AMP2的作用靶点之一[4](图 6、图 7)。
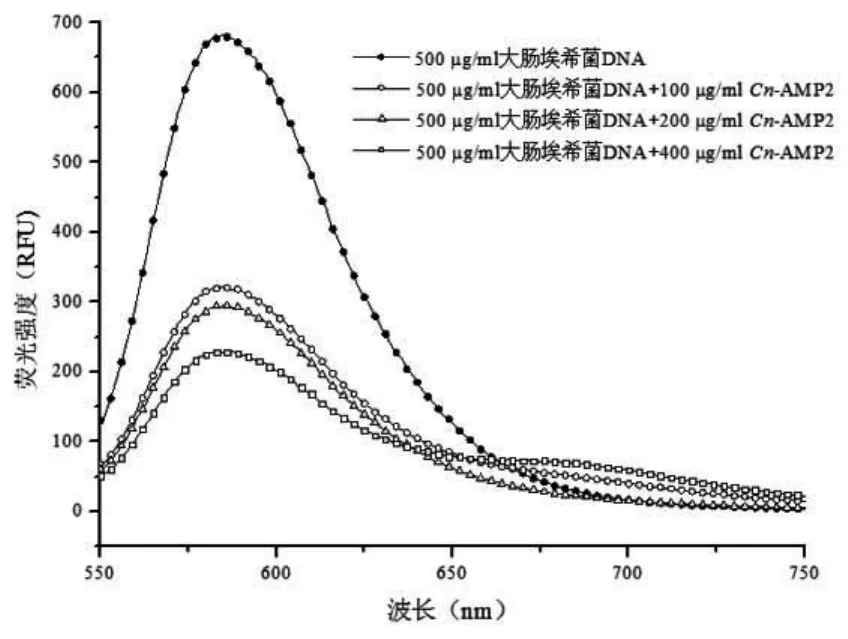
图6 抗菌肽Cn-AMP2与大肠埃希菌基因组DNA作用结果
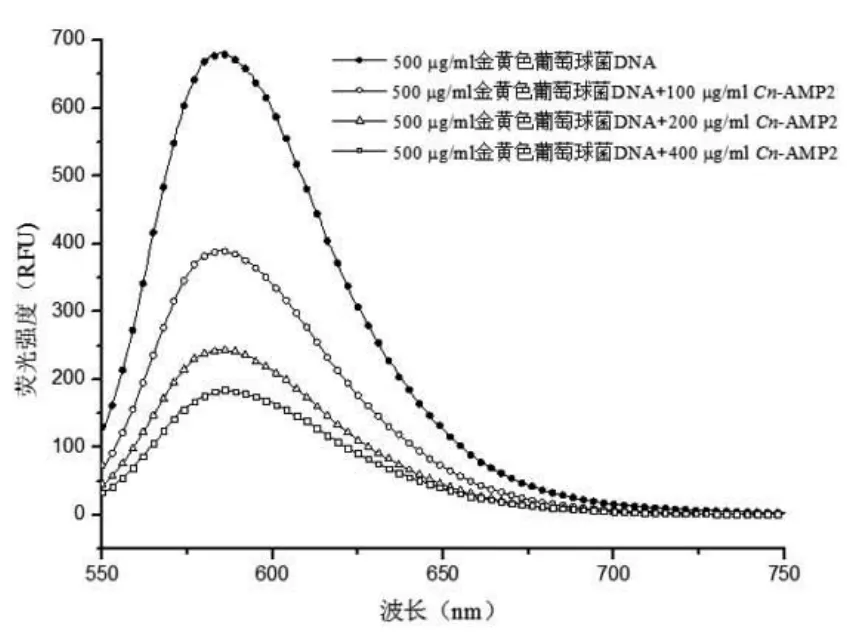
图7 抗菌肽Cn-AMP2与金黄色葡萄球菌基因组DNA作用结果
3 讨论
随着细菌耐药性问题的日益严重,抗菌肽的研究受到了广泛重视。抗菌肽杀伤病原菌的机理研究中,研究者多关注抗菌肽与细菌细胞膜的相互作用,并提出了“桶板模型”“地毯模型”“虫孔模型”和“膜区分模型”等来解释抗菌肽。随着研究的深入,基因组DNA,DnaK酶等胞内靶点也受到研究者的重视。抗菌肽PR-39和Lfcin等通过与胞内靶点结合,从而对细菌的基因表达及RNA转录等产生抑制作用,最终导致细菌死亡[5]。抗菌肽AN5-1和抗菌肽AN5-2则是对细胞膜和基因组DNA都产生作用,从而提高了抗菌活性[6]。
该次通过Fmoc固相合成的方式制备了抗菌肽Cn-AMP2,为了检测抗菌肽Cn-AMP2的抗菌活性,选取了8种临床常见的病原菌株。MIC测定结果表明抗菌肽Cn-AMP2对多种革兰阴性菌和革兰阳性菌具有杀伤作用,最低抑菌浓度为50.0~100.0 μg/mL。针对革兰阳性菌和革兰阴性菌比较,抗菌肽Cn-AMP2的抗菌活性无明显区别。以往文献报道中,抗菌肽Cn-AMP2对白色念珠菌等的抑菌浓度为80 μg/mL左右,说明抗菌肽Cn-AMP2具有广谱抗菌活性[7]。圆二色光谱测定表明抗菌肽Cn-AMP2在222nm波长处有特征吸收,说明其结构是α螺旋结构。目前已经发现的2 800多种抗菌肽中,α螺旋结构抗菌肽所占比例最高,说明抗菌肽Cn-AMP2的结构属于抗菌肽中最常见的二级结构。α螺旋结构抗菌肽的作用靶点多为细菌细胞膜,膜渗透性实验结果确认了细菌的细胞膜是Cn-AMP2的作用靶点之一。荧光光谱实验证明细菌基因组DNA是抗菌肽的另一个作用靶点,抗菌肽Cn-AMP2引发DNA结构发生变化,从而影响细菌基因组DNA的转录翻译,最终导致细菌死亡。这说明和抗菌肽AN5-1和NK-18相似,抗菌肽Cn-AMP2也是双靶点作用抗菌肽,但对于抗菌肽Cn-AMP2对基因组转录翻译的具体影响过程,尚需要进一步研究。
