微小RNA-30c在胃癌组织中的表达及意义
2018-10-08杨洁泉武步强
杨洁泉 武步强 王 武
(长治医学院附属和平医院普外一科,山西 长治 046000)
目前胃癌诊断主要手段是胃镜及镜下的活检。随着医学技术的进步〔1〕,胃癌的诊断治疗手段取得了长足的进步。但是早期胃癌的检出率只有10%~20%〔2,3〕。因此,寻找新的高敏感性和高特异性的肿瘤标志物,对胃癌的诊断及治疗具有重要的意义〔4〕。微小RNA(miRNA)与靶基因的mRNA的3′非翻译区(3′-UTR)完全或部分结合,使得mRNA降解或者抑制翻译产物的生成,从而参与调控个体发育、细胞凋亡、增殖及分化〔5~8〕。miRNA-30 家族作为 miRNAs 的重要组成部分,在人类和动物 miRNA的功能研究中起着不容忽视的作用。miRNA-30包括miR-30a、miRNA-30b 、miRNA-30c、miRNA-30d 和miRNA-30e。本文探讨胃癌组织中miRNA-30c的表达及意义。
1 材料和方法
1.1材料 胃组织标本取自2005年4月至2007年5月长治医学院附属和中医院就诊的胃癌患者。分别取癌中央部位组织和对应的癌旁正常胃黏膜组织。切除标本后,10 min内立即将组织储存于液氮罐中。所有标本病理明确诊断为胃癌。所有患者签署知情同意书。男37例,女68例,中位年龄66岁。胃癌细胞株NCI-N87、SGC-7901、MKN-49P、MGC-803和BGC-823,正常人胃上皮细胞GES-1购自ATCC细胞库。细胞使用含有1%链霉素-氨苄青霉素,10%胎牛血清的DMEM培养,并在37℃,含5%CO2的细胞培养箱内培养。RNA提取试剂盒(Thermo Scientific KingFisher Total RNA Kit)购自美国Thermo公司。反转录试剂盒及实时PCR试剂盒均购自德国QIAGEN公司。miRNA-30c mimic和抑制剂购自上海吉玛公司〔9〕。
1.2RNA提取 胃癌细胞系及胃癌组织与癌旁组织RNA的提取均采用Thermo试剂盒按照说明书进行操作〔10〕。提取出来的RNA经A260/A280比值检测,比值均为1.8~2.0,可进行下一步操作。
1.3RNA逆转录及定量 取1 μg提取的RNA进行反转录反应。通过使用High Capacity cDNA Synthesis试剂盒(美国应用生物系统公司)和miRNA特异性引物完成cDNA的合成。引物如下:miRNA-30c:GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGG-ATACGACAGCTGAG,同时反转录内参U6。miRNA表达的实时定量聚合酶链反应(qRT-PCR)分析使用如下引物进行。miRNA-30c:正义链5′-GGGGTGTAAACATCCTACACTC-3′;反义链5′- ATTGCGTGTCGTGGAGTCG -3′;U6:正义链5′-GCTTCGGCAGCACATATACTAAAAT-3′;反义链5′-CGCTTCACGAATTTGCGTGTCAT-3′。所有待测项目设立3个反应复孔。采集荧光信号,miRNA表达水平以倍数=2-ΔΔCt表示〔11,12〕。
1.4MTT法分析 选取生长密度为60%~80%的细胞进行miRNA-30c mimic或抑制剂转染。24 h后将细胞胰酶消化后,完全培养基重悬成细胞悬液。用血球计数板进行细胞计数。铺板细胞密度1 000个/孔,每组6复孔,连续检测4 d,铺板过程中要确保每孔加入细胞数目的一致。统一铺好板后,置37℃、5%CO2培养箱培养。从铺板后第2天开始,培养终止前4 h,每孔加入10 μl 5 g/L的MTT,无需换液。4 h后,吸弃培养液,每孔加入150 μl二甲基亚砜(DMSO)终止反应。振荡器振荡5~10 min,酶标仪490 nm检测吸光值〔13,14〕。
1.5术后生存率 105例患者都进行术后随访,随访期5年。生存时间以术后第1天开始计算,直至患者死亡或电话随访最后日期,以月为单位进行统计分析。
1.6统计学处理 采用SPSS20.0统计软件进行非参数秩和检验,χ2检验,采用Kaplan-Meier和Log-rank方法分析miRNA-30c表达与患者生存率的关系。
2 结 果
2.1miRNA-30c在胃癌组织和胃癌细胞系中的表达 miRNA-30c在大部分胃癌组织中表达显著降低。胃癌细胞系中miRNA-30c的表达低于正常胃上皮细胞。
2.2miRNA-30c表达与临床病理的关系 miRNA-30c的表达水平在不同性别、肿瘤大小、肿瘤分化水平间差异无统计学意义(P>0.05),高龄患者miRNA-30c的表达明显低于年龄较小患者,且随着肿瘤的分期增加miRNA-30c的表达降低,表明miRNA-30c可能具有抑制胃癌的作用,见表1。
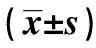
表1 miRNA-30c表达与临床病理的关系
2.3miRNA-30c表达与胃癌患者总生存期的相关 以ΔΔCt=-1.26为界值将miRNA-30c的表达分为高表达组和低表达组。Kaplan-Meier分析显示,高表达组患者预后明显好于低表达组(P=0.03),中位生存期分别为53(16~60)和41(12~60)个月(图1)。通过Log-rank分析发现,miRNA-30c可以作为独立的预后因子。
2.4miRNA-30c抑制胃癌细胞的增殖 对miRNA-30c固有表达低的BGC-823细胞转染miRNA-30c mimic(miRNA-30C表达为297.00±1.356)或空白mimic(miRNA-30C表达为0.978±0.233),对miRNA-30c固有表达高的NCI-N87细胞系转染miRNA-30c抑制剂(miRNA-30C表达为0.212±0.036)或空白抑制剂(miRNA-30C表达为0.951±0.200)。MTT结果表明miRNA-30c的过表达可以抑制细胞的增殖,而抑制miRNA-30c后,可以促进细胞的增殖(P<0.05,P<0.01),见图2,3。
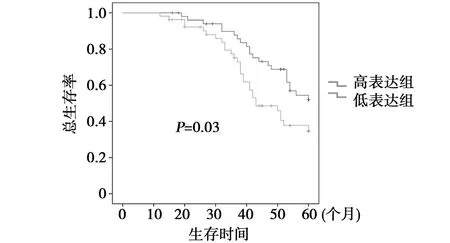
图1 miRNA-30c与胃癌患者预后的关系

与空白mimic组比较:1)P<0.05图2 miRNA-30c过表达对BGC-823细胞增殖的影响

与空白抑制剂组比较:1)P<0.05;2)P<0.01图3 miRNA-30c敲除后对NCI-N87细胞增殖的影响
3 讨 论
miRNA-30通过影响肿瘤细胞的增殖、迁移、侵袭和凋亡等生物学行为来调控肿瘤的发生发展。在肝癌、乳腺癌、肺癌、消化系统肿瘤中都发挥着重要作用〔15,16〕。本研究发现,无论是组织水平还是细胞水平,miRNA-30c的表达都是下降的,并且和肿瘤的分期及胃癌患者的预后呈正相关。miRNA-30c过表达可以抑制胃癌细胞的增殖。miRNA在人体发育的不同阶段有着不同的功能,并且其功能具有组织特异性。单个miRNA靶基因成千上万。一个miRNA可以与多个靶基因结合,而一个靶基因又可以同时受多个miRNA的调节〔17〕。因此miRNA与靶基因之间可以形成一个复杂的调控网络。肿瘤是由不可控制的细胞增殖和不恰当的损伤细胞存活引起的。细胞本身有多种机制调控细胞正常的分裂、分化和死亡。通过一系列基因的活化或者沉默精确地调节细胞增殖和分化。在肿瘤当中,可以选择性地开启或者关闭某些癌基因或者抑癌基因的功能。miRNA通过序列特异性的碱基配对抑制mRNA的翻译功能,从而在转录后水平调控基因的表达,影响细胞增殖、分化和凋亡。研究表明非编码miRNA是胃癌发生的主要因素之一,其对胃癌细胞的周期调控、细胞凋亡和肿瘤侵袭与转移都有重要影响〔18〕。
不足20%的早期胃癌可以得到诊断,80%的患者就诊时已为进展期胃癌,即已经发生肌层、浆膜层浸润或转移,5年生存率很低。因此,寻找胃癌的生物标志物对于早期发现、早期诊断和治疗胃癌及协助临床治疗十分迫切,并且有助于临床医生制定合适的治疗方案,以取得效果最优化。现阶段,胃癌的早期诊断主要依靠内镜下活检来进行,但是内镜下活检为侵入性操作,有一定的风险性。而miRNA不仅可以从组织当中提取,而且近年研究显示,miRNA还能够游离于细胞之外,稳定存在于血浆或血清中,具备疾病分子生物标志物的某些特点,在多种肿瘤和非肿瘤疾病的诊断和预后中显示了独特的价值〔15,16〕。本研究揭示了miRNA-30c在胃癌中可能发挥抑癌作用,为胃癌的早期诊断,预后判断和药物开发提供了理论依据。
