SIRT2对白细胞介素-1β诱导的兔关节软骨细胞凋亡的影响
2018-10-08范忠诚王琮仁
范忠诚 王琮仁 李 杨
(中南大学湘雅医学院附属海口医院骨科,海南 海口 570208)
骨关节炎作为一种退行性疾病,以软骨细胞异常减少、基质降解增多为主要特性,软骨细胞占软骨组织的5%左右,具有维持软骨组织内环境稳定、保持软骨组织完整性的作用,其凋亡增多是骨关节炎发生的机制之一〔1〕。氧化应激、物理因素、炎症因子等都可以诱导软骨细胞凋亡,正常情况下,软骨组织中存在少量的白(IL)-1β,而在关节炎患者的软骨组织中存在大量IL-1β,IL-1β是诱导软骨细胞凋亡的重要因子〔2,3〕。沉默信息调节因子(SIRT)2是一种组蛋白去乙酰酶,依赖于烟酰胺腺嘌呤二核苷酸,能够调控细胞能量代谢、增殖、凋亡等过程,其与关节炎的发生有关,在关节炎小鼠的软骨组织中发现SIRT2 mRNA和蛋白水平均下调〔4~6〕。本实验以兔膝关节软骨细胞为对象,研究SIRT2在IL-1β诱导的关节软骨细胞凋亡中的作用。
1 材料与方法
1.1材料 新西兰大白兔6只,雌雄不限,2月龄,购自长沙市开福区东创动物科技服务部。SIRT2过表达慢病毒由北京合生基因构建;0.25%胰蛋白酶购自美国Gibco;Ⅱ型胶原酶、MTT、IL-1β购自美国Sigma;DMEM/F12购自美国Thermo;细胞色素(Cytochrome)C抗体购自美国CTS;Annexin V-FITC/PI凋亡检测试剂盒购自美国BD;Realtime PCR试剂盒、RNA提取试剂盒、cDNA合成试剂盒购自大连宝生物;SIRT2抗体购自美国Abcam;胞质蛋白提取试剂盒、线粒体蛋白提取试剂盒购自上海生工。
1.2兔膝关节软骨细胞分离培养 步骤如下〔7〕:2月龄的新西兰大白兔,共6只,雌雄不限,购自长沙市开福区东创动物科技服务部。耳缘静脉注入空气将大白兔处死,无菌条件下取出膝关节,于超净台内用尖刀刮取膝关节软骨组织,剪成1 mm3的小块,加入5 ml 0.25%胰蛋白酶,于37℃恒温水浴箱内消化40 min,离心,弃掉上清,加入5 ml DMEM/F12培养基(含有0.2% Ⅱ型胶原酶),于37℃恒温水浴振荡器150RPM消化6 h,100 μm的无菌滤筛将残渣除去,计数,等体积在培养瓶分装,倒置相差显微镜下观察细胞的生长情况,观察到细胞贴壁后,每2天换液1次,细胞达80%~90%生长融合时进行传代。选择第3代细胞进行实验研究。
1.3细胞分组 取第3代兔膝关节软骨细胞,分为:Control组、IL-1β组、NC+IL-1β组、SIRT2+IL-1β组共4组,IL-1β组、NC+IL-1β组、SIRT2+IL-1β组细胞在实验开始时在细胞培养液中添加10 ng/ml IL-1β,SIRT2+IL-1β组、NC+IL-1β组细胞分别为感染SIRT2过表达慢病毒和对照慢病毒的兔膝关节软骨细胞。Control组、IL-1β组细胞在培养24 h以后,用于后续实验。慢病毒感染方法简述如下:取第3代兔膝关节软骨细胞,接种到6孔细胞培养板内,细胞培养密度为50%时,加入慢病毒液,MOI=10,培养3 d后,将细胞培养板置于荧光显微镜下,观察GFP绿色荧光表达情况,细胞感染效率高于95%,筛选稳定感染的细胞株,给予IL-1β刺激后,用Realtime PCR和Western印迹方法检测SIRT2表达。
1.4Realtime PCR检测SIRT2表达 Control组、IL-1β组细胞按照上述方法培养以后,以RNA提取试剂盒提取细胞中的总RNA,RNA用DEPC水溶解以后,取1 μl的RNA,稀释200倍,用紫外分光光度计检测OD260nm/OD280 nm的比值。以RNA作为模板,用cDNA合成试剂盒合成cDNA。取1 μl的cDNA,进行Realtime PCR,步骤同Realtime PCR试剂盒,PCR体系为:12.5 μl的2×SYBR Green qPCR混合物,1 μl的上下游引物(5 μmol/L),1 μl的cDNA模板,添加9.5 μl的ddH2O。引物为:SIRT2正义链5′-CAACCTGGAGAAATACCGTCTT-3′,反义链5′-CAGTCCTTTTTCCTTCAGCAG-3′。β-actin正义链5′-AGTGCGACGTGGACATCCG-3′,反义链5′-TGGCTCTAACAGTCCGCCTAG-3′。
1.5Western印迹检测SIRT2表达 Control组、IL-1β组细胞按照上述方法培养以后,在细胞中添加含有1 mmol/L的PMSF的细胞裂解液,将细胞裂解以后,转移到EP管中,12 000 r/min离心10 min,吸取上清溶液,保存在-20℃。用BCA法对蛋白进行定量检测。取蛋白样品,进行SDS-PAGE蛋白电泳,在上层胶中电压为80 V,在下层胶中电压为120 V,每个上样孔添加30 μg蛋白样品。取出蛋白凝胶,以150 V的电压转膜1 h以后,蛋白转移到NC膜上。用5%的牛血清白蛋白将非特异性的位点封闭以后,再把NC膜放在1/500的一抗中,4℃过夜,NC膜再与1/3 000的二抗室温中孵育2 h以后,按照ECL显色试剂盒显色后,用Band Scan分析条带的灰度值,计算SIRT2灰度值/β-actin的灰度值。
1.6MTT检测细胞增殖 取感染慢病毒后的兔膝关节软骨细胞,接种到96孔板内,细胞接种的密度为5×104个/ml,按照Control组、IL-1β组、NC+IL-1β组、SIRT2+IL-1β组分组处理后,分别在24、48、72、96 h时取出培养板,在每个孔内加入MTT溶液约10 μl,置于37℃孵育4 h以后,把上清溶液吸弃,再加入150 μl的DMSO溶液,置于低速摇床上孵育10 min,置于酶标仪上检测490 nm的OD值。
1.7流式细胞术检测细胞凋亡 取感染慢病毒后的兔膝关节软骨细胞,按照Control组、IL-1β组、NC+IL-1β组、SIRT2+IL-1β组分组处理24 h以后,以胰蛋白酶消化,2 000 r/min离心10 min,把上清吸弃以后,添加上样缓冲液混合后,此时细胞浓度为1×106个/ml,转移到流式管中,添加5 μl的PI及Annexin V-FITC,置于室温中孵育25 min后,用流式细胞仪检测。
1.8Western印迹检测胞质和线粒体中CytochromeC蛋白水平 取感染慢病毒后的兔膝关节软骨细胞,按照Control组、IL-1β组、NC+IL-1β组、SIRT2+IL-1β组分组处理24 h以后,按照试剂盒提取细胞线粒体和胞质中的蛋白,以Western印迹方法检测CytochromeC蛋白水平,具体步骤同上,胞质蛋白以β-actin为参照,线粒体蛋白以Porin为内参。
1.9统计学方法 采用SPSS21.0软件进行t检验,单因素方差分析及SNK-q检验。
2 结 果
2.1IL-1β诱导后SIRT2表达水平降低 关节软骨细胞经过IL-1β诱导处理以后,细胞中的SIRT2 mRNA和蛋白水平下降,提示IL-1β减少关节软骨细胞中SIRT2的表达,见图1,表1。

图1 IL-1β减少关节软骨细胞中SIRT2蛋白表达
2.2慢病毒感染促进IL-1β条件下关节软骨细胞中SIRT2的表达 经过IL-1β诱导处理以后,细胞中的SIRT2水平升高,提示成功构建了上调 SIRT2的关节软骨细胞,见图2,表2。
2.3SIRT2提高IL-1β条件下关节软骨细胞增殖活性 IL-1β处理后的关节软骨细胞的OD值明显降低,而过表达SIRT2后的关节软骨细胞经IL-1β诱导处理以后,细胞的OD值有所升高。过表达SIRT2拮抗IL-1β对关节软骨细胞增殖的抑制作用,见表3。
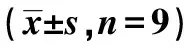
表1 IL-1β处理后关节软骨细胞中SIRT2水平

图2 慢病毒感染上调IL-1β作用后的关节软骨细胞中SIRT2的表达
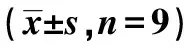
表2 各组SIRT2 mRNA及蛋白水平比较
与IL-1β组比较:1)P<0.05
2.4SIRT2抑制IL-1β条件下关节软骨细胞凋亡 IL-1β处理后的关节软骨细胞的凋亡率〔(26.14±2.87)%〕明显高于Control组〔(6.25±0.47)%〕,而过表达SIRT2后的关节软骨细胞经IL-1β诱导处理以后,细胞凋亡率〔(15.28±1.65)%〕较NC+IL-1β组〔(27.42±2.49)%〕明显降低,过表达SIRT2减少IL-1β诱导的关节软骨细胞凋亡。
2.5SIRT2减少IL-1β处理后关节软骨细胞线粒体释放CytochromeC IL-1β处理后的关节软骨细胞线粒体中CytochromeC蛋白水平明显降低,而胞质中CytochromeC蛋白水平明显升高。过表达SIRT2后的关节软骨细胞经IL-1β诱导处理以后,细胞线粒体中CytochromeC水平有所升高,胞质中CytochromeC水平有所降低。过表达SIRT2抑制IL-1β诱导的关节软骨细胞线粒体释放CytochromeC,见图3,表4。
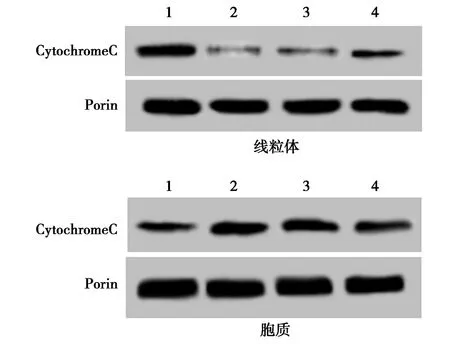
1~4:Control组,IL-1β组,NC+IL-1β组,SIRT2+IL-1β组图3 SIRT2过表达减少IL-1β处理后关节软骨细胞胞质及线粒体中CytochromeC蛋白水平

表3 SIRT2提高IL-1β条件下关节软骨细胞增殖活性
与Control组比较:1)P<0.05;与IL-1β比较:2)P<0.05,下表同
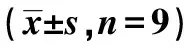
表4 SIRT2过表达对IL-1β处理后关节软骨细胞胞质和线粒体中CytochromeC蛋白水平的影响
3 讨 论
骨关节炎的发生以软骨组织破坏、软骨变性、关节间隙变窄为主要特性,而作为软骨组织的唯一组成细胞,软骨细胞功能紊乱是关节炎发生的关键〔8〕。研究表明,骨关节炎发生常常伴随有软骨细胞凋亡过度等现象,软骨细胞受到炎症因子等的刺激后,细胞凋亡水平升高,细胞损伤加重〔9,10〕。IL-1β作为一种炎症因子,在骨关节炎患者中的表达水平升高,其可以诱导软骨细胞凋亡发生〔11〕。本实验结果表明,IL-1β处理后的关节软骨细胞的增殖活性降低,细胞凋亡增多,提示成功构建了IL-1β诱导的关节炎软骨细胞模型。
沉默信息调节因子基因家族(Sir2)是一类组蛋白去乙酰酶,其与哺乳动物Sir2同源的蛋白共同组成Sirtuin蛋白家族,Sirtuin蛋白家族含有7个蛋白成员,在不同的组织和器官中表达水平不同〔12~15〕。SIRT1参与软骨细胞炎症,可以提高软骨细胞抵抗氧化应激能力并减少软骨细胞炎症等,SIRT1在骨关节炎中发挥保护作用,目前研究表明,SIRT2和SIRT1一样,作为Sirtuin蛋白家族的成员,都含有较高的去乙酰化酶的活性,均在骨关节炎软骨组织中表达下调,SIRT2可能也参与关节炎软骨细胞损伤发生〔16~19〕。本实验结果表明,IL-1β诱导后的关节软骨细胞中的SIRT2表达水平降低,这与上述研究报道结果一致,均表明SIRT2可能参与骨关节炎的发生。
有研究报道表明,IL-1β可以通过激活线粒体途径诱导关节软骨细胞的凋亡,IL-1β能够促进线粒体中CytochromeC的释放〔20,21〕。线粒体凋亡途径又称为内源性凋亡途径,是细胞凋亡发生的重要分支,在几乎所有的哺乳动物凋亡中存在,其诱导细胞凋亡发生与CytochromeC有关,CytochromeC是一个重要的凋亡激活因子,正常情况下,CytochromeC多存在于细胞线粒体内,当细胞受到病理因素的刺激以后,线粒体膜通透性转换孔打开,线粒体内的CytochromeC释放至细胞质中,激活位于细胞质中的凋亡反应,诱导细胞凋亡发生〔22,23〕。SIRT2具有抗细胞凋亡的作用,沉默其表达后可以减少细胞凋亡的发生,在急性髓系白血病细胞、帕金森病细胞模型等中已经得到证实〔24,25〕。本实验结果显示,IL-1β诱导后的关节软骨细胞线粒体释放的CytochromeC增多,而过表达SIRT2后的关节软骨细胞经IL-1β诱导后,细胞凋亡率有所降低,线粒体释放的CytochromeC减少,细胞增殖活性升高,说明SIRT2可以通过线粒体途径减少IL-1β诱导的关节软骨细胞凋亡损伤,SIRT2在软骨细胞凋亡中发挥保护作用。
总而言之,SIRT2能够通过减少线粒体释放CytochromeC抑制IL-1β诱导的关节软骨细胞凋亡,提高软骨细胞活性,SIRT2可能具有抗骨关节炎的作用,对于其作用机制还需要在以后进行验证和探索。
