MTHFR基因1298A>C位点多态性与亚洲人群乳腺癌易感性的Meta分析
2018-10-08叶彦军郝福军
叶彦军 郝福军 张 玲
(宝鸡市人民医院普通外科,陕西 宝鸡 721000)
乳腺癌是城市女性最常见的癌症,是农村女性第四大常见癌症,城市地区乳腺癌的发病率是农村地区的2倍〔1,2〕。亚甲基四氢叶酸还原酶(MTHFR)基因是叶酸代谢中的关键限速酶之一,与DNA甲基化及DNA合成相关,1298位点是MTHFR基因上研究较为集中的位点,该位点突变与MTHFR活性密切相关。本研究拟采用Meta分析评价MTHFR基因1298A>C位点多态性与乳腺癌发病风险的相关性。
1 资料和方法
1.1文献检索 计算机检索PubMed、EMBASE、web of science、中国生物医学文献数据库、CNKI数据库、重庆VIP数据库和万方数据库,各数据库检索日期均从开始建库到2016年8月,全面检索MTHFR基因1298A>C位点多态性与乳腺癌易感性的病例对照研究。英文检索词为:MTHFR,methylenetetrahydrofolate reductase和breast cancer,中文检索词为:MTHFR、亚甲基四氢叶酸还原酶、乳腺癌。纳入标准:①病理学或细胞学检查确诊为乳腺癌的患者;②MTHFR基因1298A>C位点多态性与乳腺癌易感性的病例对照研究;③报道了MTHFR基因1298A>C位点基因多态性的分布频数;④报道了MTHFR基因1298A>C位点多态性与乳腺癌易感性的OR值及95%CI。
1.2资料提取 由两位研究者独立进行文献筛选,排除明显不符合纳入排除标准的研究,对可能符合纳入排除标准的研究通过阅读全文来确定,资料提取完毕后两位研究者再交叉核对,对于难以确定是否纳入的试验,通过小组讨论解决分歧。
1.3统计分析 采用Stata12.0软件进行统计分析,OR及95%CI为疗效分析统计量。当纳入文献间无明显的统计学异质性时(I2≤50%,P>0.10),采用固定效应模型,反之,若纳入研究间有显著的统计学异质性时(I2>50%,P<0.10),分析异质性可能的来源,采用亚组分析和敏感性分析探讨其可能的来源,若无明显的统计学异质性时采用随机效应模型进行分析。分别计算以下几种遗传模型(AA vs AC、AA vs CC、AC vs CC、AA vs AC+CC、AA+AC vs CC)的基因型分布。采用Stata 12.0软件进行Begg检验以评估纳入研究的发表偏倚。
2 结 果
2.1文献检索结果 初检各数据库共获得文献343篇,通过阅读题目及摘要排除明显不符合纳入排除标准的文献264篇,剩余79篇文献通过阅读全文进一步确定,经过逐层筛选后,最终有17篇文献〔3~19〕符合纳入排除标准。纳入研究中2篇研究来自泰国〔12,17〕,1篇来自新加坡和中国的合作研究〔7〕,1篇来自克什米尔地区〔8〕,11篇来自中国大陆〔3,4,6,10,11,13~16,18,19〕,2篇来自中国台湾〔5,9〕。见表1。
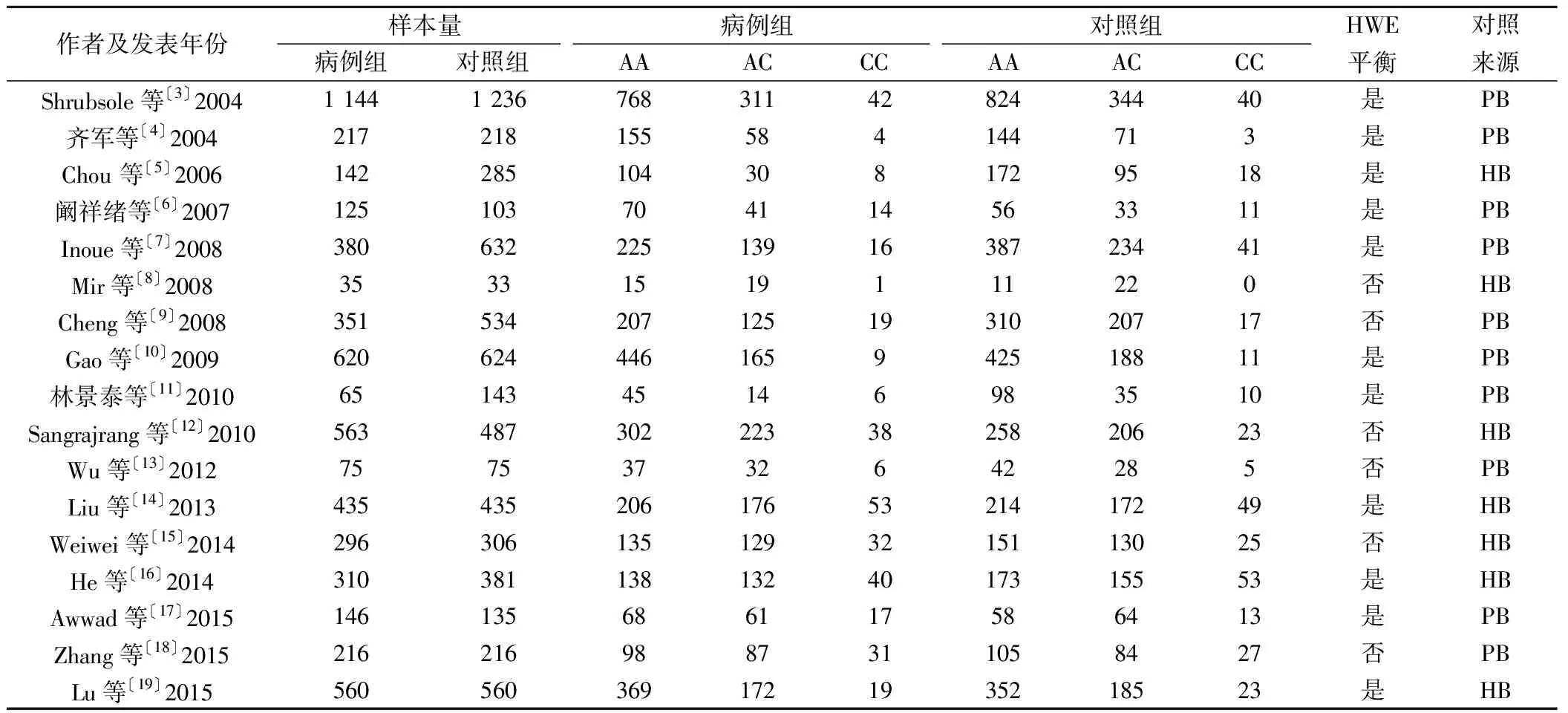
表1 纳入研究一般特征(n)
HWE:哈迪-温伯格平衡定律,HB:对照来源医院,PB:对照来源社区
2.2Meta分析结果 共有17篇〔3~19〕研究报道了MTHFR基因1298A>C位点多态性与乳腺癌易感性的OR和95%CI,其中,病例组共纳入5 680例乳腺癌患者,对照组共纳入6 403例志愿者。Meta分析结果结果如下:(1)杂合子模型AA vs AC:CMTHFR基因1298A>C位点多态性与乳腺癌易感性的差异无统计学意义(OR=1.07,95%CI0.99~1.15),异质性检验结果表明纳入研究间差异无统计学意义(I2=0.0%,P=0.653),故采用固定效应模型,见图1。
(2)杂合子模型AC vs CC:CMTHFR基因1298A>C位点多态性与乳腺癌易感性的差异无统计学意义(OR=0.89,95%CI0.76~1.05),异质性检验结果表明纳入研究间差异无统计学意义(I2=0.0%,P=0.891),故采用固定效应模型,见图2。
(3)纯合子模型AA vs CC:CMTHFR基因1298A>C位点多态性与乳腺癌易感性的差异无统计学意义(OR=0.92,95%CI0.79~1.08),异质性检验结果表明纳入研究间差异无统计学意义(I2=0.0%,P=0.906),故采用固定效应模型,见图3。
(4)显性基因模型AA vs AC+CC:CMTHFR基因1298A>C位点多态性与乳腺癌易感性的差异无统计学意义(OR=1.05,95%CI0.97~1.13),异质性检验结果表明纳入研究间差异无统计学意义(I2=0.0%,P=0.630),故采用固定效应模型,见图4。
(5)隐性基因模型AA+AC vs CC:CMTHFR基因1298A>C位点多态性与乳腺癌易感性的差异无统计学意义(OR=0.92,95%CI0.79~1.07),异质性检验结果表明纳入研究间差异无统计学意义(I2=0.0%,P=0.905),故采用固定效应模型,见图5。
为了定量评价纳入研究发表偏倚的可能性,本研究采用Begg检验定量评价发表偏倚,Begg检验结果提示差异无统计学意义(P=0.773),提示纳入研究间发表偏倚的可能性小,见图6。
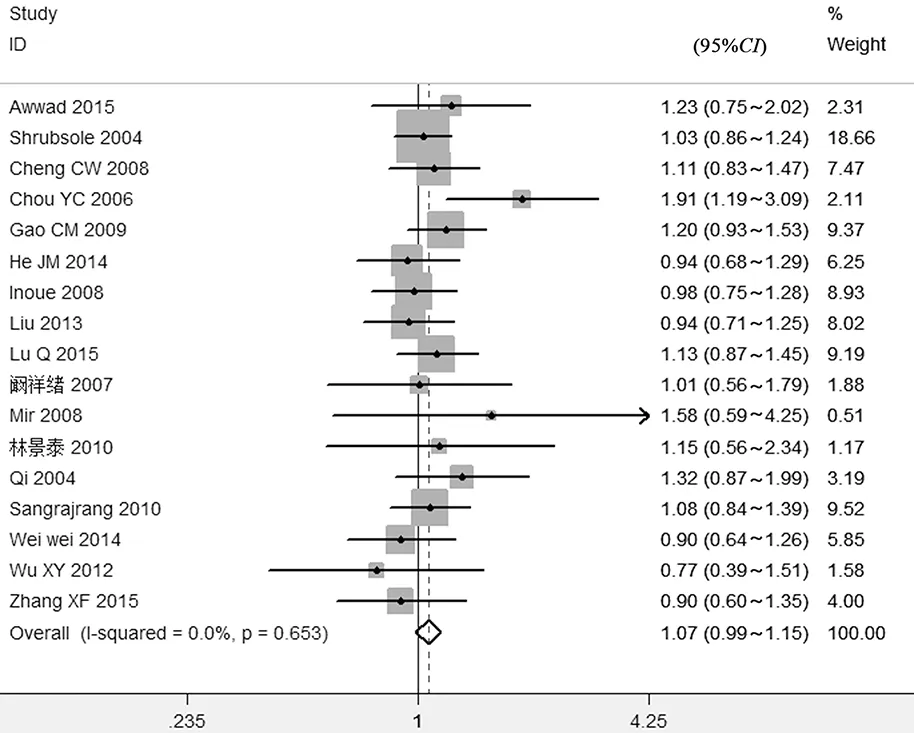
图1 MTHFR基因1298A>C位点多态性与乳腺癌相关性的Meta分析(AA vs AC)

图2 MTHFR基因1298A>C位点多态性与乳腺癌相关性的Meta分析(AC vs CC)
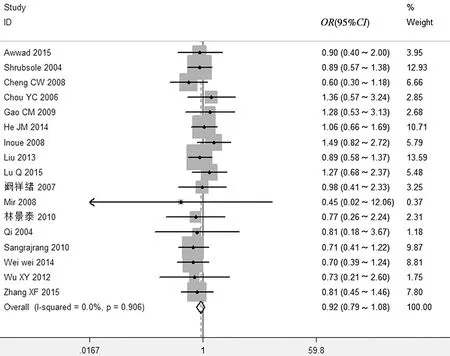
图3 MTHFR基因1298A>C位点多态性与乳腺癌相关性的Meta分析(AA vs CC)
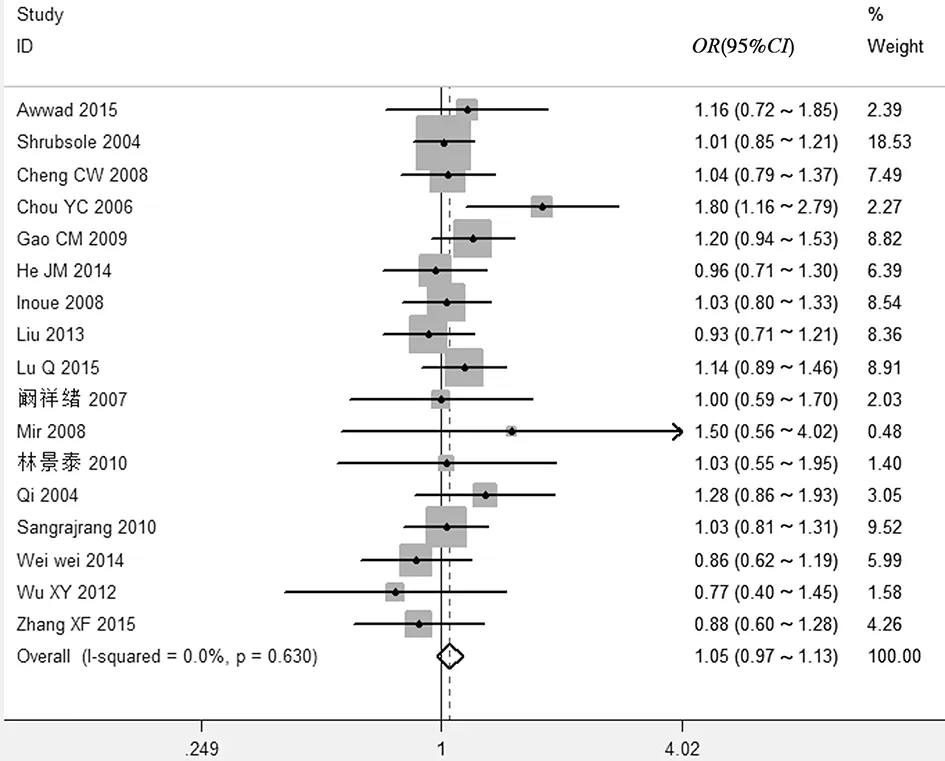
图4 MTHFR基因1298A>C位点多态性与乳腺癌相关性的Meta分析(AA vs AC+CC)
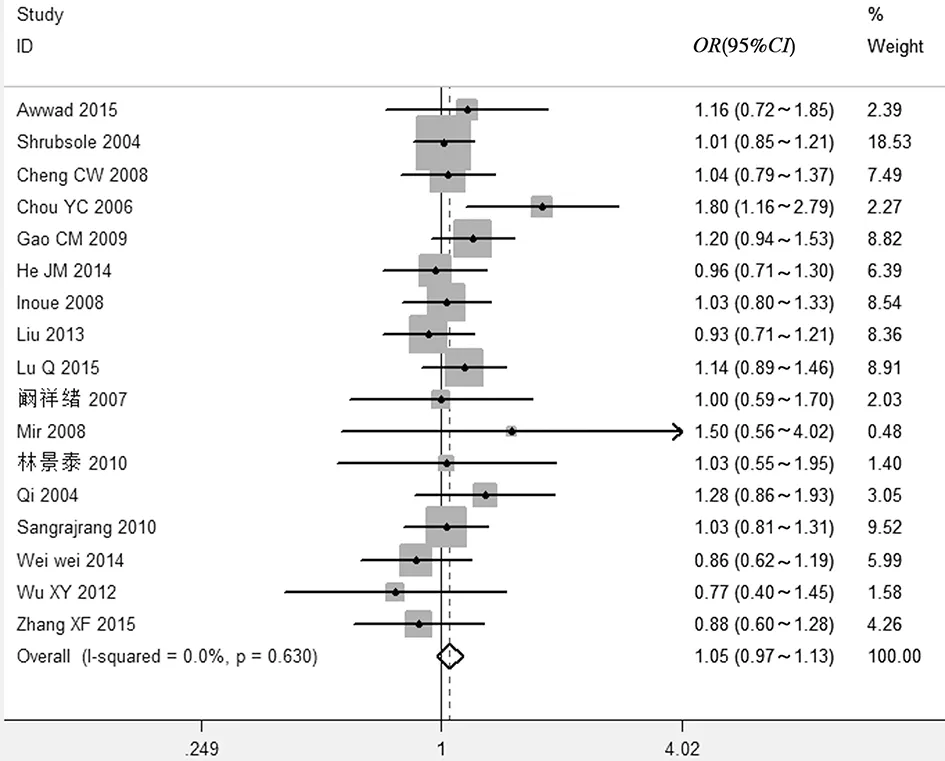
图5 MTHFR基因1298A>C位点多态性与乳腺癌相关性的Meta分析(AA+AC vs CC)

图6 Begg图
3 讨 论
探讨MTHFR基因多态性与乳腺癌的相关性,有助于筛查乳腺癌的易感人群。MTHFR基因位于1号染色体短臂的末端(1p36.6),参与DNA合成、修复及甲基化过程,是叶酸代谢途径的关键酶〔5〕。在叶酸的代谢过程中,MTHFR可催化5,10-亚甲基四氢叶酸向5-甲基四氢叶酸转化,MTHFR基因位点突变可导致MTHFR活性降低,导致同型半胱氨酸水平升高,进而影响DNA结构和DNA甲基化水平〔7〕。MTHFR的催化作用决定了DNA甲基化与DNA合成之间的平衡,其基因多态性可能会影响叶酸的代谢,可能会增加了乳腺癌的发生风险〔6〕。MTHFR基因的位点的多态性会使该酶的生物活性及热稳定性下降,可能会参与乳腺癌的发生及发展,多项研究也显示MTHFR基因多态性与乳腺癌发生、发展及预后密切相关〔12,16,19〕。MTHFR基因多态性的分布在不同的种族及地区存在明显差异,且不同地区乳腺癌的发病率存在着明显的差异,本研究Meta分析结果提示MTHFR基因1298A>C位点多态性与乳腺癌的易感性无相关性。
理论上讲,MTHFR基因多态性通过影响叶酸代谢异常,从而诱导DNA甲基化正常模式的畸变,可能会导致DNA修复系统的效率减低,通过影响DNA合成和甲基化导致乳腺癌的发生。也有研究〔12〕提出一种假说,即MTHFR基因多态性与乳腺发病风险受叶酸摄入量的影响,根据这个假说,当叶酸摄入较为充足时,携带MTHFR基因变异型者乳腺癌的患病风险降低,因为叶酸足够可以保证正常的甲基化,从而减少DNA损伤的风险。相反,当叶酸摄入不足时,携带MTHFR变异基因型的人DNA甲基化和DNA合成/修复异常成为诱导乳腺癌发生的主要机制。一项Meta分析〔20〕也评价了摄入叶酸和乳腺癌发病率的相关性,该研究共纳入14项前瞻性队列研究共计677 858例个体,Meta分析结果提示叶酸摄入量高的个体和摄入量低者乳腺癌的发病率差异无统计学意义(OR=0.97,95%CI0.90~1.05;P=0.451),剂量相关分析结果也提示每天增加叶酸摄入量并不能降低乳腺癌的发病风险(OR=0.99,95%CI0.98~1.01;P=0.361),但是叶酸每天的摄入量大于400 μg时会增加乳腺癌的发病率,叶酸的摄入量与乳腺癌的发病率呈“J”形相关。这也提示乳腺癌的发生受环境因素、激素水平及基因多因素交互作用所致。再者,有研究〔6〕提示不同人群MTHFR基因 1298A>C位点的多态性频率分布存在较大的差异,这也可能是导致不同地区乳腺癌易感性存在差异的原因之一,Shrubsole 等〔3〕在 研究中,发现对照与病例的 MTHFR基因在1298 位点中,1298位点CC的分布频率分别为3.3%和3.8%;而Narayanan 等〔21〕在欧洲人群的研究中发现,MTHFR基因1298 位点CC缺高达14.6 %。
本研究尚存在以下局限性:纳入研究均为中文和英文,没有纳入亚洲地区其他语种的文献,虽然Begg检验提示发表偏倚的可能性小,仍存在文献漏检的可能;有些研究对照人群来源于医院,有些研究对照人群来源于社区,在年龄和性别方面不完全匹配,可能会影响研究的内在真实性;乳腺癌是环境因素、易感基因及激素水平等多种因素共同作用的结果,由于原始数据的缺乏,无法分析MTHFR基因1 298位点多态性与其他因素的交互作用对亚洲人群乳腺癌易感性的影响,因此,上述结论仍需高质量的研究进一步去证实。
