重组酶聚合酶扩增技术(RPA)检测拟态弧菌
2018-10-08周广彪段建发胡晓珊
周广彪 段建发胡晓珊 魏 霜 凌 莉 蔡 颖*
1.汕头海关 广东汕头 515031;2.广州海关
拟态弧菌(Vibrio Mimicus)为革兰氏阴性菌,单鞭毛,具有动力性,与副溶血弧菌、霍乱弧菌等属正常海洋菌丛,广泛存在于河水、海水及海产品中,是很多甲壳类及海水鱼类的易感菌[1-2]。在美国、新西兰、孟加拉及不少非洲国家均有拟态弧菌致病报道,我国福建、上海、北京、江苏及浙江地区也有发病,多呈散发或暴发。拟态弧菌一年四季均可致病,以夏季为多;潜伏期3~72 h,平均24 h;主要症状有腹泻、呕吐、腹痛,以及大便呈水样或粘液血便;发病年龄不限,但小儿少见。因此,对拟态弧菌的检测在公共卫生上具有十分重要的意义[3-4]。
目前,传统方法仍是拟态弧菌检测重要手段,该法首先进行选择性增菌,再结合生化及血清学结果进行鉴定。传统方法的检测结果准确性高,但存在着效率低、耗时长、操作繁琐等显著不足。为满足致病菌快速检测的要求,技术人员发展了酶免疫法(EIA)及酶联荧光免疫检测法(VIDAS-CHL)、胶体金试纸条及API生化鉴定试纸条法、聚合酶链式反应(PCR)及实时荧光PCR法、环介导恒温扩增(LAMP)等快速灵敏的检测方法。其中,以实时荧光PCR为代表的分子检测方法,以其简便快捷、高灵敏度的技术优势,近年来在致病菌检测中的应用越来越广泛[5]。但荧光检测设备普遍售价偏高、产物片段偏小、引物探针设计要求较高等应用难点,在一定程度上限制了该类技术推广,尤其不利于在基层实验室的应用和非实验室环境下现场检测。
重组酶聚合酶扩增(Recombinase polymerase amplifcation,RPA)是继LAMP之后的新型等温核酸扩增技术之一[6],利用单链DNA结合蛋白(single-stranded DNA binding protein,SSB)将DNA双螺旋解链,在ATP的参与下重组酶与引物结合形成蛋白-核苷酸复合物,该复合物与靶序列匹配结合后再由DNA聚合酶启动合成反应。该方法主要具备以下优点:(1)37℃左右即可反应,不需要梯度温控来实现核酸解链、退火和延伸;(2)仅需1对引物,实验设计简单;(3)反应时间短,只需 30~50 min;(4)结果辨识成本低,使用普通琼脂糖凝胶电泳即可[7],而且产物还可进行测序确认。
目前国内尚未见到利用RPA技术检测拟态弧菌的报道,本研究拟根据编码拟态弧菌不耐热溶血素(Vibrio mimicus heat-labile hemolysin,VmhA)的基因保守序列,设计RPA检测的引物对,建立拟态弧菌的RPA检测方法,并测试其特异性和灵敏度,建立一种能够快速检测拟态弧菌VmhA的简便、高效、特异、灵敏、适于现场快速检测的技术方法。
1 材料与方法
1.1 材料与试剂
拟态弧菌(ATCC33653)、创伤弧菌(ATCC27562)、副溶血弧菌(ATCC17802)、河流弧菌(ATCC33809)、溶藻弧菌(ATCC17749)、霍乱弧菌(ATCC39315)、哈维氏弧菌(ATCC33842)、沙门菌(ATCC14028)、大肠埃希菌(ATCC25922)、金黄色葡萄球菌(ATCC25923)和单增李斯特菌(ATCC19114)均为本机构购买的标准菌株,其购买来源为中国科学院水生生物研究所、广东食品微生物安全工程技术研究开发中心和美国MBL公司。应用检测的样品均为本机构2016年法定和委托检验中的留样。所用细菌基因组DNA提取试剂盒为天根生化科技有限公司产 (货号DP302),引物由上海生工生物工程有限公司安排合成,电泳级琼脂糖、DNA Marker及显色I剂购自宝生物工程(大连)有限公司,RPA扩增试剂盒为TwistDX公司产TwistAmp Basic kits。
1.2 主要仪器与设备
PCR 扩增仪(Veriti,ABI公司)、核酸蛋白分析仪(ND-1000,Thermo 公司)、电泳仪(DYY-6C,北京六一)、凝胶成像系统(Tanon-1600,天能公司)。
1.3 方法
1.3.1 基因组DNA提取
先将上述标准菌株按照国家标准GB4789《食品卫生微生物学检验标准》进行复壮增菌及生化鉴定,再参照试剂盒说明书,提取基因组DNA,使用核酸蛋白分析仪检测DNA浓度及纯度并统一稀释为100 ng/μL 备用。
1.3.2 引物设计
参考试剂盒中RPA引物设计的要求,根据VmhA基因的保守序列,使用Oligo V6.22软件进行引物的设计和筛选,入选序列再利用Primer Blast工具(NCBI官方网站提供)进行特异性确认,后由上海生工生物工程有限公司安排合成。最终设计检测拟态弧菌的RPA引物,扩增条带467 bp,序列具体如下:上游引物:5′-GAGATATTGGCATCTTTACAAAATGGACGA-3′;下游引物:5′-TGAATCTATTAAGAGGTGCGCA CCCTTCAAGCACT-3′。
1.3.3 RPA检测方法建立
以1.3.1中制备的DNA为模板,采用上述引物进行RPA扩增,同时设置超纯水为阴性对照,测试恒温37℃反应时长分别为30 min、40 min、50 min及60 min时的扩增效果。RPA扩增体系的配制方法具体如下:将再水化缓冲液(Rehydration Buffer)29.5 μL加入到含有冻干酶粉的0.2 mL Twist Amp反应管(Twist AmpBasic kits,Twist)中,再先后加入去离子水 12.5 μL,上、下游引物各 2 μL(终浓度为 0.4 μmol/L),模板 DNA 1μL,最后再加入醋酸镁溶液2.5 μL(280 mmol/L)。待反应结束后,向产物中加入 50 μL酚/氯仿,充分混匀后12 000 rpm离心3 min,取上清液4 μL点样于1.5%琼脂糖凝胶,使用1×TBE缓冲液进行电泳,电泳条件为5 V/cm,恒压电泳40~60 min,最后在凝胶成像系统上观察并记录结果。
1.3.4 RPA检测方法特异性评价
按照1.3.3的RPA检测反应体系及适用扩增时长,对前述11种标准菌株的基因组DNA进行检测,评价建立的RPA检测方法特异性。
1.3.5 RPA检测方法灵敏度评价
将拟态弧菌标准菌株提取的DNA进行10倍梯度稀释,设计5个稀释度,以对应梯度稀释的DNA为模板,按照1.3.3所示的RPA检测反应体系进行灵敏度实验,并参照已报道的拟态弧菌检测引物VMH-F和VMH-R进行PCR灵敏度实验,引物序列 VMH-F:5′-GTCAAAGGGGTATGTGTTAAGGCG TAGTTCTG-3′;VMH-R:5′-CACAGCAGGTTCAAAT CATCGAGCAAACCC-3′,扩增产物长度为 106 bp[5],比较两种方法检测灵敏度。
1.3.6 RPA检测方法应用效果评价
选取本机构2016年检测留样样品50份,包括20份阳性样品,其中拟态弧菌确认阳性检出2份。样品主要为冻虾仁、冻凤尾对虾、冻牡蛎、活青蟹、金昌鱼以及水质监控样本,参考食品卫生微生物学检验国家标准进行样品处理,使用碱性蛋白胨水增菌培养10 h,取2 mL增菌液离心富集,使用细菌基因组DNA提取试剂盒(天根生化科技有限公司,货号DP302)提取DNA,使用建立的RPA方法进行拟态弧菌检验,以结果的一致性来评价方法的应用效果。
2 结 果
2.1 RPA检测方法的构建
以拟态弧菌标准菌株基因组DNA为模板,并以超纯水为阴性对照,测试了不同扩增时长的RPA检测效果(图1)。在40 min时便可达到较为理想的扩增效果,VmhA扩增条带与预期目的条带大小一致约467 bp,阴性对照未扩增到可见条带,本实验所建立的RPA检测体系能够准确检测VmhA基因。

图1 RPA技术检测VmhA基因的扩增时长结果
2.2 RPA检测方法的特异性评价
VmhA的RPA特异性评价结果显示,拟态弧菌能够扩增到467bp的特异性条带,其他10株标准菌株:创伤弧菌、副溶血弧菌、河流弧菌、溶藻弧菌、霍乱弧菌、哈维氏弧菌、沙门菌、大肠杆菌、金黄色葡萄球菌和单增李斯特菌均未检测到该产物,说明该方法具有较强的特异性(图2)。

图2 VmhA基因的RPA特异性检测结果
2.3 RPA检测方法的灵敏度比较
对比VmhA的普通PCR方法与RPA检测方法的灵敏度,检测结果显示(图3、图4),当普通PCR反应设置30个循环,模板DNA含量为0.1 ng时,可以检测到106 bp的目的条带;当RPA检测方法反应时间设置40 min,模板DNA含量为0.1 ng时,也可以检测467 bp的目的条带;当DNA含量为0.01 ng时;两种方法均未能检测到目的条带,说明RPA和普通PCR的灵敏度一致。

图3 VmhA基因RPA检测的灵敏度
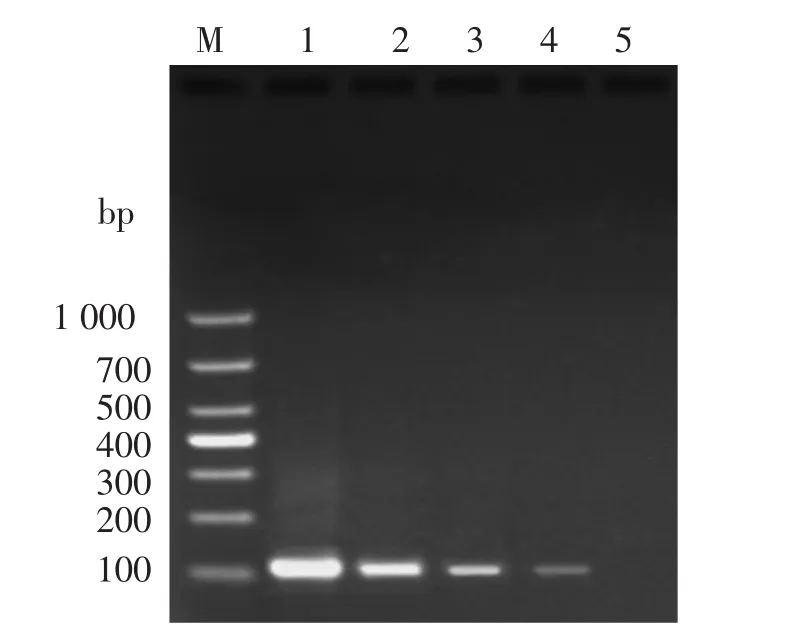
图4 VmhA基因PCR检测的灵敏度
2.4 RPA检测方法的应用效果
应用本研究建立的RPA检测体系,对本机构2016年检测的20份阳性检出留样、其中拟态弧菌确认阳性检出2份和30份阴性留样进行了复检,结果共有2份样本检出拟态弧菌,该留样检测结果与之前传统培养及生化鉴定的结果完全一致,表明该方法具有较好的应用效果。
3 讨论
RPA技术是近些年兴起的常温扩增技术,目前在病毒、病原菌及转基因的检测中均有成功的应用[8-14],但尚未见拟态弧菌的相关研究报道。本研究建立了针对拟态弧菌特异性VmhA基因的RPA检测方法,并对该方法进行了应用测试,结果显示该方法特异性强,灵敏度与普通PCR相当,可较好应用于水生动物及其加工产品的检测,且反应耗时短、对设备依赖程度低,适合现场及基层单位检测应用,为拟态弧菌的疫情监控、污染监测等提供了更为简便高效的解决手段。
研究表明,拟态弧菌的致病性是由黏附素、溶血素、肠毒素等多种毒力因子共同作用的结果,拟态弧菌不耐热溶血素由VmhA基因编码,该基因在拟态弧菌的临床及环境分离的菌株中高度保守,且与与霍乱弧菌溶血素编码基因的同源性较高,所以也是核酸检测、蛋白表达及抗体制备等方面的研究热点[5,15-16]。本研究亦是基于VmhA基因保守序列建立了RPA检测方法,在特异性、灵敏度及应用检测方面上也均能满足实际检测要求。
RPA技术最大的优点在于反应条件在37℃恒温反应,不需要进行复杂的反应参数优化,本研究对比测试不同反应时长的扩增效果,发现在40 min时扩增产物基本可满足检测需求,考虑时效性及污染防控,未选用扩增更长但可能更灵敏的反应参数。本文所用的PCR仪、核酸蛋白分析仪及凝胶成像分析系统并非RPA检测的必须仪器设备,有研究表明,使用金属浴、分光光度计及简易凝胶观察设备也可完成RPA检测[17-18],故该方法适用于现场及基层检测。此外,RPA技术反应温度接近人体温,可不依赖PCR扩增仪。有研究人员利用该特性建立了一种仅仅利用人体体温即能完成DNA扩增的RPA检测方法[19],显著拓展了该技术的应用条件。
灵敏度是评价检测方法优劣的一个关键参数,本研究建立的RPA技术用于检测VmhA方法,其灵敏度和普通PCR方法相当,此前报道也证明该技术与已报道的LAMP检测灵敏度一致[20-21]。但是RPA技术相比传统PCR有着反应更为快速(仅需30~40 min)、不依赖PCR仪,而对比LAMP有着引物设计难度小、产物片段单一且可测序确证的优点便于后续进行测序确证。所以RPA技术在基层实验室和现场检测中有着更高的实用价值。
同PCR方法一样,RPA技术也是扩增检测特定基因序列,该序列与目标菌的性状及行为表现并无必然的对应关系,当目标菌数量较少、活力较弱时,使用传统微生物检验方法不一定能检出为阳性,故在应用检测中可能存在假阳性问题[22]。本研究建立的RPA检测方法,对本机构50份留样的应用检测并未发现假阳性问题,可能与研究的样本数量偏小有关。
当然,RPA技术作为一种后起的检测手段,也有不足之处需要完善。首先是RPA体系对于蛋白酶活性要求比较高,需要保证体系中的各种酶促反应的准确进行,其技术的提升依赖现代酶学的发展应用;其次,RPA扩增体系中存在大量蛋白酶,故直接电泳无法分辨出目的核酸片段,必须经过纯化去除系统内所含的蛋白质[7];另外,RPA试剂为英国剑桥Babraham学院成立的TwistDx公司独家研发销售,试剂售价相对较高,但目前国内已有公司成功开发了类似替代产品,相信随着市场的扩大与成熟,其检测成本也会越来越低。作为一种新兴的核酸扩增技术,RPA具有特异性强、灵敏度高、操作快速便捷等明显优势,是现今呼声最高的“一种可替代PCR的技术”,在病原体检测及食品安全等众多领域已经有了越来越多的推广应用,技术发展及应用前景均较为广阔。
