基于Tamura纹理特征提取和SVM的多模态脑肿瘤MR图像分割
2018-10-08熊志勇
李 娜,熊志勇,谢 瑾,彭 川,任 恺
(中南民族大学 计算机科学学院,武汉430074)
脑肿瘤最常见的是胶质瘤,它的生长会逐渐压迫其所在区域的神经,引起身体机能的失调,造成极大危害.核磁共振(Magnetic Resonance,MR)成像技术对软组织分辨率高,可以准确描述大脑的解剖结构,在脑肿瘤的诊断、治疗和手术引导中有重要的意义[1].为了充分解读核磁共振图像,为临床诊断、治疗提供量化的信息,首先要对图像中的脑肿瘤区域进行精确分割,然后对该区域进行量化指标的计算.在实际操作中,由于脑肿瘤形状不一、结构多变、灰度不均,脑肿瘤边界多伴有水肿等,使不同患者的MR图像存在较大的差异,给脑肿瘤区域的分割带来了较大困难,分割过程中的很多问题仍需深入研究[2,3].
脑肿瘤患者的MR成像是三维多波段成像,通常包括 FLAIR 、T1、T2 和T1C 四种模态,不同的模态提供不同的脑肿瘤信息[4].比如,FLAIR模态肿瘤区域的图像与正常组织的图像灰度差异明显,T1C模态肿瘤区域的边界纹理特征明显.临床上,医生大多结合多模态MR图像进行肿瘤区域分割,分割过程中利用计算机辅助软件,手动一层一层地勾画肿瘤区域,这样的操作主观性很强,可重复操作性差[5-7].
常见的自动或半自动肿瘤分割方法多数是基于图像灰度信息的,如模糊聚类方法[8,9]、水平集方法[10]、AdaBoost迭代方法[11]、神经网络方法[12,13]以及SVM方法[14,15].SVM方法主要通过对样本的学习找到最优分类器,然后对像素点进行分类.在寻找最优分类器时,使用多维的特征来寻找,适合多模态的MR序列图像分割.目前用该方法设计分类器多数考虑的是MR图像的灰度信息,缺少对图像纹理信息的考虑,所以只反映MR图像特征的一个侧面.机器在辨识图像时,不应该仅仅利用灰度信息,而忽略掉图像的纹理信息.文献[16-18]已证明,将灰度(颜色)信息和纹理信息相结合,对图像进行分割可以得到比仅利用灰度信息或者仅利用纹理信息得到的分割效果要好,鲁棒性也更高.针对脑肿瘤图像分割的问题,本文将MR图像灰度信息和纹理信息相结合,提出一种基于多模态的脑肿瘤图像分割算法.该方法首先将多模态MR图像进行融合,对各个像素点建立高维特征,包括Tamura纹理特征[19]和灰度特征,在训练样本标记时,选择7×7的图像窗口中的中间像素点作为训练样本,再利用SVM模型对这些训练样本进行训练,求得最优分类器,最后,用训练好的SVM模型处理其它脑肿瘤图像.选取BRATS2013数据集上的20例患者图像进行测试,测试结果表明本文方法可以更好地提取脑肿瘤区域的边界,得到较好的分割精度.
1 基于Tamura的特征提取
Tamura从心理学的角度研究表明,人类视觉对于纹理的感知包含至少6个方面:对比度、方向度、粗糙度、线粒度、规则度、粗略度[19].实验表明,对比度、方向度和粗糙度3个定量分析指标对图像纹理的分析比较重要.本文引入这3个指标作为纹理信息,对4种模态下脑肿瘤图像进行纹理特征提取.给定一种模态下的待分割脑肿瘤图像I:(k,h,w)→{0,1,2,…,L+1},其中k∈[1,K],h∈[1,H],w∈[1,W],K,H,W,L分别为图像的序列(层次)、该序列图像的高、该序列图像的宽和该像素(体素)灰度级.
1.1 粗糙度
赵海英等[20]对当前主流的图像粗糙度计算方法进行了分析,结果显示Tamura提出的度量方式在表达图像粗糙度方面是最佳的.文献[21]将指数量化改为线性量化,此方法降低了算法的复杂度,鉴于本文的一幅脑肿瘤图像包含很多序列,是很多图像的组合,图像的数据量较大,本文也采用此方法降低算法的复杂度.本文粗糙度的计算方法如下:
(1)以像素(k,h,w)为中心,求大小为5×5的像素块的平均灰度值,记为A(k,h,w).
(2)以像素(k,h,w)为中心,计算平均灰度方差,公式如下:
En,u(k,h,w)=|An(k,h-n,w)-An(k,h+n,w)|,
En,v(k,h,w)=|An(k,h,w-n)-An(k,h,w+n)|,
En,u(k,h,w),En,v(k,h,w)分别为水平方向、垂直方向的平均灰度方差,其中n=1,2,3,4,5.
(3)依次计算n=1,2,3,4,5下的E值,求解最大E值所对应的n值,不分方向,无论水平还是垂直,
nbest(k,x,y)=max{Ek,o(k,x,y)|n∈[1,5],o=u,v}.
(4)以像素(k,h,w)为中心,计算大小为3×3的邻域平均粗糙度,
(5)计算像素(k,h,w)粗糙度与平均粗糙度之差的绝对值,即为该像素的粗糙度度量.
1.2 对比度
对比度是指图像选定区域中,最亮的部分和最暗的部分灰度之差,可以通过对像素周围灰度分布情况统计分析获得,本文对比度的计算方法如下:
(1)以像素(k,h,w)为中心,统计其邻域大小为3×3的像素块的平均灰度差值,记为Avggray(k,h,w).
(2)以像素(k,h,w)为中心,统计其领域大小为3×3的像素区域灰度值的四阶矩,公式如下所示:
式中,f(k,i,j)是位于脑肿瘤图像序列k,第i行,第j列的像素灰度值.
(3)以像素(k,h,w)为中心,计算图像大小为3×3的图像块的平均灰度方差,
(4)像素(k,h,w)的对比度值为:
1.3 方向度
方向度是图像块中的像素在某个方向呈现出的形态,体现出一定的方向性,可以通过统计梯度向量的方向角局部分布情况实现,具体步骤如下:
(1)计算像素(k,h,w)处的梯度方向量,向量模|ΔG(k,h,w)|和方向θ(k,h,w),具体计算方法见文献[19];
(2)事先选定一个阈值t,像素(k,h,w)的方向角为θ′(k,h,w),公式具体表达方式如下:
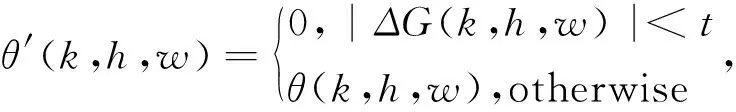
对于没有明显方向的图像,θ′的值会变化不大,比较平坦,当|ΔG(k,h,w)|的值小于阈值t时,我们把角度设置为0,故t为平滑修正方向角.关于阈值t的求法,有很多种,本文依据文献[20]的方法求得t=12;
(3)计算像素(k,h,w)及其邻域大小为3×3的图像块的像素中,所有像素的方向角的均值,记为Avgdir(k,h,w);
(4)像素(k,h,w)方向角减去平均方向角,即为像素(k,h,w)方向度度量值:
C2(k,h,w)=|θ′(k,i,j)-Avgdir(k,h,w)|.
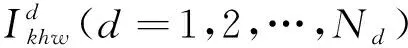
由于图像本身需要4种模态同时提取纹理特征,而且每幅图像都包含100多层断层图像,图像非常复杂,为了提高算法的效率,在训练模型时对图像进行均匀采样.对一个断层的图像,设置取样窗宽为Ws=7,即从断层图像Ikhw中每隔Ws行或Ws列产生一个取样图像Is,Is是7×7的图像块,取中间像素点,记录该点纹理信息和灰度信息描述Is图像块.
2 多模态脑肿瘤MR图像分割
SVM算法具有很好的泛化能力,在小样本学习方面也表现出色,当前已经有很多SVM算法在医学图像分割中得到较好的应用[22,23].SVM算法的分类原理是将取样样本空间映射到高维空间,在高维空间里建立一个最优决策超平面,使两类样本距离该平面距离最大化.SVM训练过程中,以训练误差为约束条件,以置信范围最小化为目标,对问题进行优化,特别是引入了核函数,对高维样本处理能力也较强,因此推广能力优于传统学习算法,特别是在解决小样本、非线性及高维模式识别问题中表现出特有的优势[24].
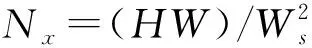
本文所提出的基于Tamura纹理和SVM的多模态脑肿瘤MR图像分割具体步骤如下:
(1)多模态脑肿瘤待分割图像进行灰度和Tamura纹理特征提取,分别提取图像像素的4种模态下的本身灰度值、3×3邻域像素灰度值平均值、3×3邻域像素灰度值平均值差值、5×5邻域像素灰度值平均值、5×5邻域像素灰度值平均值差值,并计算Tamura纹理粗糙度、对比度、方向度,每一个像素提取32个特征值,组成维度为32的特征向量;
(2)进行均匀取样,训练SVM模型;
(3)利用训练好的SVM模型对像素点分类,获取肿瘤区域和背景区域;
(4)形态学操作对肿瘤区域进行修正;
(5)得到分割图像.
3 实验结果与分析
本文选用MICCAI BRATS 2013(https://www.virtualskeleton.ch/BRATS/Start2013) 提供的20个病患的临床数据(患者年龄、性别未知),来定量分析本文方法的分割结果.20组数据每组都包含FLAIR、T1、T2 和T1C 四种模态下的图像和由多名专家共同完成的分割结果.这些数据中脑肿瘤区域的位置不一、大小不同、形态各异.所有数据每个序列图像的大小为220×220×155,去壳、配准等预处理都已经完成.为了评估分割性能,采用Dice相似性系数(Dice Similarity Coefficient,DSC)、灵敏度(Sensitivity)和阳性预测值(Predictive Positivity Value,PPV)等定量分析指标来评价分割结果.
图1为H02病人的4种模态下的原始图像,分别选取了第79序列和108序列,从左到右依次是FLAIR 、T1、T1C 和T2图像.图2为专家分割结果和本文分割结果的展示,可以看出,在肿瘤区域的边缘部分,有白色肿瘤组织误判为正常组织的点,也有正常组织被误判为肿瘤组织的点,肿瘤边缘部分表现出粗糙不平整,但从整体来看分割精度较好,每一层的Dice系数都达到了90%以上.
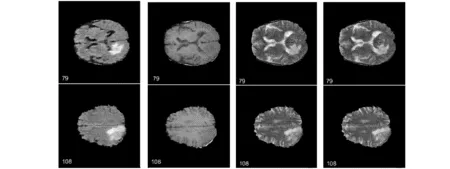
a) FLAIR b)T1 c)T1C d)T2图1 H02患者的4种模态MR图像Fig.1 Four modal MR images of H02 patients

a)79序列专家分割结果 b)79序列本文算法分割结果 c)108序列专家分割结果 d)108序列本文算法分割结果图2 H02图像分割结果与专家分割结果对比Fig.2 Comparison of H02 image segmentation results and expert segmentation results
图3为H06病人的4种模态下的原始图像,分别选取了第99序列和119序列.图4为专家分割结果和本文算法分割结果的展示,可以看出,两个序列中99序列的分割效果要优于119序列,119序列脑肿瘤区域在图上显示为不连通区域,正常组织和肿瘤组织间隔出现,分割难度较大.模糊的正常组织区域与肿瘤区域灰度值差异小,纹理特征也不是特别明显.另外,在训练时,按照均匀取样的方法,模糊区域的采样占输入样本的比例较小,所以导致这种脑肿瘤区域的分割精度不高.因此,针对图3中119序列,此类分割精度不高的问题,需要对该区域进行大量重新取样,增加该区域像素点的特征提取,提高该区域样本占总样本的比例,有针对性地进行训练.
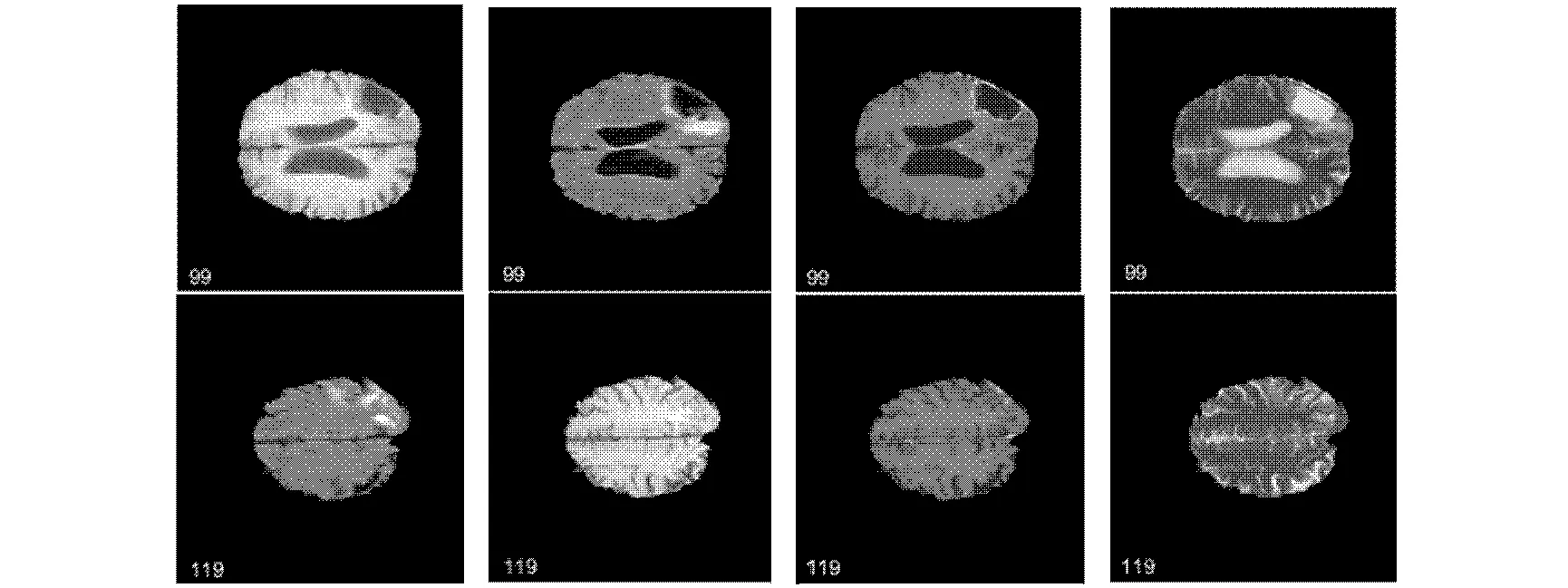
a) FLAIR b)T1 c)T1C d)T2图3 H06患者的4种模态MR图像Fig.3 Four modal MR images of H06 patients

a) 99序列专家分割结果 b) 99序列本文算法分割结果 c) 119序列专家分割结果 d) 119序列本文算法分割结果图4 H06图像分割结果与专家分割结果对比Fig.4 Comparison of H06 image segmentation results and expert segmentation results
表1给出本文方法与文献[15]方法分割性能量化对比,文献[15]是基于SVM算法未考虑纹理信息的分割结果,该算法的核函数选择的是高斯核函数.从表中结果可以看出,文献[15]方法的Dice系数偏低,将多模态特征信息融合,在提取灰度特征的过程中,会丢失不同模态信息中有利于分类的特征,对分割正确率有一定影响.本文方法采用在多模态信息融合过程中考虑图像块的纹理信息,特别是大多数的T1C和T2模态的纹理信息都能很好地区分肿瘤点与非肿瘤点,因此Tamura纹理信息能得到更高的分割精度.

表1 20例患者的平均分割结果Tab.1 Average segmentation results for 20 patients %
与同类混合算法比较,本文的性能较优.为了进一步验证本文算法的有效性,将本文算法与Havaei提出的kNN算法[25]和Pereira提出的多模态三维神经网络模型算法[26]等权威结果进行比较,本文算法Dice的平均值为0.89,Havaei算法Dice的平均值为0.85,Pereira算法Dice的平均值为0.88,本文算法的Dice平均值较优.
4 结语
为了实现脑肿瘤MR图像的有效分割,本文提出了一种结合Tamura纹理特征提取和SVM的分割方法.该算法首先将4种模态下的多序列MR图像的局部灰度特征与Tamura纹理度量相结合,从图像中提取足够多的特征信息,有效克服了脑肿瘤的个体差异,同时亦能适应脑肿瘤不同图像层之间的大小位置差异,弱化肿瘤边缘与正常组织灰度相近的影响;然后在SVM模型中输入已知样本进行训练;最后,用训练好的SVM模型处理其他脑肿瘤图像.该方法充分利用了不同类型脑肿瘤图像的特性,不仅考虑了图像的灰度信息,也考虑了图像的纹理信息.实验结果证明,本文提出的方法在分割精度上比一般基于灰度信息的图像分割方法有一定程度的提升.
