pEGFP-C1-MCH真核表达载体的构建及其在HEK293细胞系中的表达
2018-10-08侯赋园王德彬杨光忠
徐 婧, 侯赋园, 王德彬, 李 竣,胡 鑫, 杨光忠
(中南民族大学 药学院,武汉 430074)
黑色素聚集激素(MCH)最初于1983年从大马哈鱼(Oncorhynchusketa)垂体分离获得,因通过黑色素细胞中的黑色素聚集来调节硬骨鱼类的皮肤颜色而得名[1].MCH参与机体多种生理功能的调节,包括摄食调节、下丘脑-垂体-肾上腺轴、能量平衡、生殖和感官感知等[2],其中最受关注的是其在调节摄食和能量代谢中的作用[3].在大鼠与小鼠脑室内短期或长期注射MCH,均会引起摄食增加,进而导致肥胖[4],MCH过表达的转基因小鼠可表现为进食增多,最终导致肥胖[5];敲除MCH基因的小鼠中MCH基因水平的降低可以导致进食减少和代谢增强,进而导致小鼠体重减轻、体型瘦小[6].这些研究结果表明:MCH在哺乳动物中可能发挥着增强食欲、降低代谢的作用.本文通过构建MCH基因的绿色荧光蛋白表达载体,并使其在HEK293细胞系中稳定表达,为探讨MCH在能量代谢中的作用及机制提供细胞模型.
1 材料与方法
1.1 材料和仪器
胎牛血清(杭州四季青),高糖DMEM培养基(Gibco-BRL),DNA Marker(广州东胜),DNA凝胶回收试剂盒(Axygen),限制性内切酶(TAKARA),引物合成、DNA测序(武汉擎科),脂质体Lipofectamine 2000(Invitrogen),质粒提取试剂盒(Axygen),大肠杆菌DH5α和HEK293(本室保存).
冷冻离心机(Eppendorf 5417R台式,德国),高压双稳电泳仪(DYY-4C型,北京六一),水平电泳槽(DYCP-31D型,北京六一),自动凝胶图像分析仪(JS380,上海培清),核酸蛋白紫外测定仪(GenenQuant Ⅱ,ciences).
1.2 pEGFP-C1的大量获取
按标准方法将pEGFP-C1质粒转化入DH5α中,将菌液涂布于LB固体培养基(含50 μg/mL卡那霉素).挑出阳性菌落扩大培养于37 ℃含50 μg/mL卡那霉素的LB液体培养基中,130 r/min转速.收集细菌,提取质粒.经NheI单酶切,1.2%琼脂糖凝胶电泳鉴定.
1.3 MCH基因编码区的克隆
从脑组织中提取总RNA,将RNA逆转录为cDNA[7].参照Genbank中MCH基因的全长序列,设计引物:上游引物5′-GATCAGATCTGAACCACTGAAGAAACACTCG-3′(引入BgIⅡ酶切位点,下划线部分),下游引物5′-GATCCTGCAGCAACACTGGATTACAGAAAA-3′(引入PstI酶切位点,下划线部分).PCR反应体系为:0.25 μL TaKaRa Ex Taq(5 U/ μL),5 μL 10×Ex Taq Buffer(Mg2+Plus),4 μL dNTP Mixture(各2.5 mM),2 μL模板cDNA,上下引物各1 μL(10 μM),加双蒸水至50 μL.反应程序为:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 40 s,72 ℃ 40 s,35 cycles;72 ℃ 5 min.反应产物于1.2 %琼脂糖凝胶电泳鉴定,割胶回收PCR产物.
1.4 pEGFP-C1-MCH真核表达载体的构建
将pEGFP-C1双酶切,双酶切反应为:5 μL 质粒,2 μL 10×H Buffer,PstI与BgIⅡ各1 μL,11 μL双蒸水.于37 ℃反应1 h后1.2 %电泳鉴定后割胶回收.
取pEGFP-C1及MCH双酶切产物,加入1 μL T4DNA ligase,1 μL 10×T4DNA ligase buffer,加水至10 μL,于22 ℃反应4 h,按1.2将重组质粒转入DH5α菌株.挑取阳性菌落做菌落PCR,扩大培养含MCH片段的菌群.提取质粒,琼脂糖凝胶电泳鉴定产物大小,并送重组质粒测序鉴定.
1.5 pEGFP-C1-MCH重组质粒的转染
转染前24 h,将HEK293细胞铺板于六孔板中,使用DMEM完全培养基,于37 ℃、5% CO2饱和湿度中培养.待其汇合度为70% ~ 80%时,吸弃原培养液,PBS洗3次,加入1.5 mL无血清无抗生素DMEM培养基.分别取适量重组质粒pEGFP-C1-MCH及5 μL Lipofectamine 2000稀释于50 μL无抗生素无血清的DMEM培养基,轻轻摇晃混匀,5 min后静置20 min.逐滴加入六孔板中,混匀,转染6 h后更换完全培养基[8].
1.6 转染后倒置荧光显微镜观察细胞
转染24, 48, 72 h后于荧光倒置显微镜在488 nm波长紫外光激发下观察荧光蛋白表达情况.
1.7 重组质粒在转染细胞中的表达检测
pEGFP-C1-MCH转染细胞24 h后,消化收集细胞,利用半定量RT-PCR技术检测该质粒在HEK293细胞中的表达.先利用Trizol试剂提取细胞总RNA,再使用RNA逆转录试剂盒以2 μg细胞总RNA为模板合成cDNA第一条链,再各取2 μL cDNA 作为模板DNA用PCR技术分析MCH基因表达情况,以β-actin基因作为内参.MCH的上游引物为5′-GATCAGATCTGAACCACTGAAGAAACACTCG-3′,下游引物为5′-GATCCTGCAGCAACACTGGATTACAGAAAA-3′,β-actin的上游引物为5′-GGGTATGGAGTCTTGCG G-3′, 下游引物为5′- TTTCATTGTGCTGGGGG-3′,扩增条件均为94 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,35 cycles;72 ℃ 5 min.
2 结果与分析
2.1 pEGFP-C1-MCH重组载体的酶切鉴定
大量制备的载体及MCH片段分别经BgIⅡ,PstI双酶切及电泳检测后,产物大小正确,分别为4.7 kb和477 bp(见图1).将载体片段和目的片段连接、转化,挑取阳性克隆,提取质粒DNA后,重组质粒分别经单酶切(BgIⅡ),双酶切(BgIⅡ与PstI)检测,产物大小分别约为5.2,4.7 kb,与原载体及插入片段大小匹配.由于插入片段过小,在重组质粒双酶切产物电泳图中未能显示477 bp的条带(见图2).
2.2 重组载体的测序鉴定
挑取有插入片段的阳性克隆测序.双向测序结果表明:重组克隆中插入了相应的MCH基因目的片段.经Blast序列比对显示,插入片段大小、方向正确,证明目的片段MCH基因正确地插入了pEGFP-C1质粒.
2.3 pEGFP-C1-MCH质粒在HEK293细胞中的表达
重组质粒pEGFP-C1-MCH质粒DNA转入HEK293细胞后,将转染细胞置于倒置荧光显微镜下观察,在48 h 可观察到部分细胞表达EGFP;72 h后,表达的EGFP的细胞数量逐渐增多,细胞中有较强的荧光蛋白表达(见图3),EGFP均匀分布在胞质中.
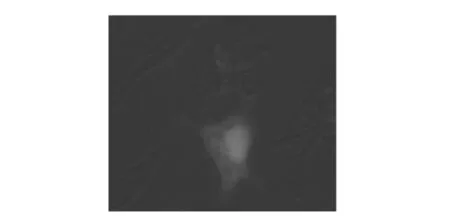
图3 EGFP在转染pEGFP-C1-MCH的HEK293细胞中的表达Fig.3 EGFP expression in HEK293 cells transfected by pEGFP-C1-MCH
2.4 RT-PCR鉴定重组细胞中MCH的表达
RT-PCR检测重组细胞中MCH基因的表达水平,结果显示:pEGFP-C1-MCH转染HEK293细胞24 h后,MCH基因在重组细胞中稳定表达(见图4).
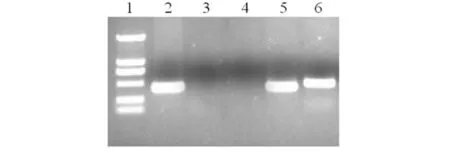
1)DL 2000 Marker; 2)pEGFP-C1的β-actin mRNA; 3) pEGFP-C1 的MCH mRNA;4)阴性对照; 5)pEGFP-C1-MCH的β-actin mRNA; 6)pEGFP-C1-MCH 的MCH mRNA.图4 重组细胞中MCH mRNA的表达水平Fig.4 mRNA expression level of MCH gene in recombinant cells
3 讨论
生物的物质和能量代谢是维持机体生命活动的重要基础,能量代谢是人体代谢的最基本形式,下丘脑在维持机体能量稳态中发挥着重要作用.在下丘脑中有许多刺激或抑制进食的下丘脑肽,如Leptin,Kisspeptin等.最近研究发现,下丘脑肽MCH在调节能量代谢的过程中扮演着重要角色.
人类中的神经肽MCH由19个氨基酸组成,在脊椎动物的进化中高度保守,从大马哈鱼(Oncorhynchustschawytscha)[9]、银鲑(O.kisutsh)[10]、罗非鱼(Oreochromismossambicus)[11]、金鱼(Carassiusauratus)[12]等中分离得到的MCH由17个氨基酸组成,其中两个Cys位点间形成的分子内二硫键使MCH呈环状结构.MCH前体蛋白(proMCH)基因由3个外显子组成,编码生成165个氨基酸的多肽.proMCH在人和啮齿类中除经剪切生成MCH外,还生成另外两种生理功能不明的多肽:含有13个氨基酸NEI和含有19个氨基酸的NGE[13].MCH主要分布于下丘脑侧面和未定带区域,发挥着许多生理功能:包括调节硬骨鱼类皮肤的颜色;调节下丘脑-垂体-肾上腺轴;刺激大鼠神经垂体分泌催产素等.最近研究发现MCH在调节体重方面发挥着重要的作用:转基因小鼠中过表达MCH将抵抗胰岛素且患有肥胖症;在脑室内注射MCH的大鼠进食过多,最终引发肥胖;基因工程肥胖鼠(ob/ob)以及禁食小鼠下丘脑中的MCH表达水平增高;MCH水平降低的小鼠食量减少,代谢率增高,最终导致体重减轻和脂肪含量下降[14].为了研究整个MCH的功能,本研究克隆了MCH前体蛋白基因.
pEGFP-C1载体具有容易转染真核细胞,对目的蛋白的生物学功能和宿主细胞的生长无影响等特点,其中的报告基因绿色荧光蛋白有利于示踪和检测所克隆的目的基因,并且荧光蛋白稳定表达.该载体全长4.7 kb,其中含有的CMV启动子和SV 40 polyA加尾信号具有高效的转录调控作用,多克隆位点有利于外源基因的插入,抗性基因可用于克隆或真核表达时的筛选.本研究将MCH基因克隆入pEGFP-C1载体,经酶切和测序鉴定,克隆的MCH质粒序列和预期相符,真核表达载体pEGFP-C1-MCH克隆成功.
通过脂质体2000介导真核表达载体pEGFP-C1-MCH转染HEK293细胞,获得了高表达MCH的细胞株,该细胞株形态与生长速度与野生型HEK293细胞无差别,倒置荧光显微镜下观察以及RT-PCR结果显示,EGFP-MCH融合蛋白在细胞中稳定表达.该细胞模型的成功构建为后续研究MCH基因在能量代谢方面的功能创建了一个较好的细胞平台.
