自发光转录激活子样效应因子的功能分析
2018-10-08吴云华杨盼春
吴云华,杨盼春,李 勇
(中南民族大学 生命科学学院,生物技术国家民委重点实验室,武汉 430074)
转录激活子样效应因子(TALEs)最早发现于植物致病菌黄单胞杆菌中,它是一种能特异性识别并激活植物基因启动子的蛋白质[1,2]. 除N-端和C-端结构域外,TALE蛋白由一连串的重复单体结构域组成,并通过单体结构域的可变区(RVDs)实现对双链DNA碱基对的识别[3]. 由于通过改变单体结构域的排布顺序能实现TALE蛋白对任何一种DNA序列的特异性识别,因此,在基因编辑和人工基因调控等研究中[4-6],通过在能够识别特定DNA序列的TALE蛋白的C-端融合核酸酶或转录调控因子,可实现活细胞内目的基因的编辑或转录调控[4-6],并有望将该技术应用于肿瘤等重大疾病的治疗中[7, 8].
最近研究表明:虽然TALE蛋白对DNA的识别具有较高的特异性,但在实际的基因编辑过程中仍然存在着一定的“脱靶”概率[9]. 所谓“脱靶”主要是指在TALE蛋白在基因组的非特异位点上结合并发挥功能,对细胞产生不可预期的影响[10],这为基于TALE蛋白的基因编辑技术的安全性带来了严重的挑战,并极大地限制了该技术在生物医学中的应用.为克服“脱靶”问题,需要对TALE蛋白与DNA相互作用进行定性和定量的分析. 因此,对TALE蛋白进行特异性标记,将其与DNA的结合转变为高灵敏的可测量信号成为研究学者的共识[11].
本文将一种最新报道的新型萤光素酶报告基因融合在了TALE蛋白的C-端,实现了对TALE蛋白的特异性标记. 经表达、纯化得到的融合蛋白不仅可对靶标DNA进行特异性识别,同时也能产生萤光素酶的特征发光信号. 由于萤光素酶具有分子量小、稳定性和量子产率高等优点[12],基于其开发的TALE蛋白标记和检测技术有望为分析和阐明TALE蛋白与DNA相互作用机制提供有力的工具.
1 材料与方法
1.1 材料和仪器
大肠杆菌菌株DH5α、BL21(DE3)和原核表达载体pET-26b(+)为本实验保藏.内切酶NdeI、SalI、BsmBI、BsaI、聚合酶链式反应(PCR)所用Phusion超保真酶、T4和T7连接酶、蛋白质分子量Marker(Thermo),30%丙烯酰胺/甲叉双丙酰胺(摩尔比为29∶1)储液(上海生工),DNA分子量Marker、镍亲和纯化柱和微量BCA蛋白质定量试剂盒(康为世纪生物),萤光素酶底物(furimazine,Promega), 萤光素酶编码序列克隆自本实验室保存质粒,TALE蛋白质单体编码序列及其N端和C端编码序列由金唯智公司合成,引物合成及测序由上海生工完成.
琼脂糖及聚丙烯酰胺凝胶电泳仪(DYY-6D,北京六一),光谱仪(F-2500,HITACHI).
1.2 载体的构建
通过重叠PCR将TALE蛋白N端和C端编码序列(NI,NG,NN,HD 4种)分别与萤光素酶编码序列(简称Luc)相连后,用NdeI和SalI进行酶切,并连接到载体pET-26b(+)中,分别构建出pNI-Luc,pNG-Luc,pNN-Luc和pHD-Luc 4种重组载体.
完整的TALE蛋白编码序列通过Golden Gate技术进行连接和克隆[13]. 先根据待识别的靶标DNA序列,选择相应的TALE蛋白质单体编码序列,并通过Golden Gate反应将单体编码序列连接成为六聚体. 所得六聚体产物进一步通过PCR扩增后,用Golden Gate反应连接成为十八聚体,并克隆到相应的pNG-Luc载体中,通过酶切和测序验证最终载体的正确性,并命名为pTALE-TDRF-Luc.
1.3 蛋白质的表达与纯化
通过已报道的化学转化法[14, 15], 将构建好的pTALE-TDRF-Luc重组载体转化至大肠杆菌菌株BL21(DE3)中. 挑取转化所得的单菌落接种到5 mL含卡那霉素的LB液体培养基中(1%蛋白胨,0.5%酵母提取物,0.5% NaCl,30 μg/mL卡那霉素,pH 7.0),于28 ℃,150 r/min培养12 h. 按1∶100的体积比接种到50 mL含卡那霉素的LB液培养基中,于28 ℃,150 r/min培养2 h后,加入终浓度为0.5 mM的异丙基硫代半乳糖苷(IPTG)进行诱导,于28 ℃,150 r/min继续培养8 h.
离心收集经过诱导的菌体,并用6 mL细菌蛋白抽提液(20 mM Tris-Cl,500 mM NaCl,2 mM TCEP,10 mM 咪唑,pH 8.0)重悬,同时加入200 μL溶菌酶(10 mg/mL)和20 μL蛋白酶抑制剂. 上述菌悬液通过超声波破碎后,用30000 g离心15 min,收集上清后,用0.22 μm过滤器过滤到镍亲和纯化柱中进行蛋白质的纯化. 先用25倍柱体积的洗涤缓冲液(20 mM Tris-Cl,500 mM NaCl,40 mM 咪唑,pH 8.0)冲洗柱子,再用2倍柱体积的洗脱缓冲液(20 mM Tris-Cl,500 mM NaCl,500 mM 咪唑,pH 8.0)洗脱目的蛋白质. 所得蛋白质样品通过透析脱盐,并分装保存于-80 ℃冰箱中.
1.4 蛋白质浓度检测和SDS-PAGE
取分装好的蛋白质样品,用BCA法进行浓度测定,测定方法参见微量BCA蛋白定量试剂盒说明书.
为了验证蛋白质的分子量和完整性,对纯化的蛋白质进行了SDS-PAGE分析[16]. 向40 μL蛋白质样品中加入10 μL 5×上样缓冲液,混匀后于100 ℃加热15 min进行变性处理. 取10 μL经过处理的样品上样至SDS-PAGE凝胶中(5%浓缩胶,8%分离胶)进行电泳分离. 电泳条件为:浓缩胶电压35 V,分离胶电压80 V. 电泳结束后的凝胶经过染色和脱色,于凝胶成像系统上进行拍照分析.
1.5 凝胶迁移实验
经过纯化的TDRF-Luc蛋白与其可特异性识别的双链DNA在1×TALE 缓冲液(20 mM Tris-Cl,60 mM KCl,5 mM MgCl2,2 mM TCEP,5%甘油,pH 8.8)中,于室温下反应1.5 h,反应体系中双链DNA与TDRF-Luc蛋白摩尔比为1∶10. 反应结束后,反应产物通过4%的琼脂糖凝胶进行电泳检测,并拍照分析.
1.6 光谱检测
用1× TALE 缓冲液将TDRF-Luc蛋白质稀释成终浓度为50 nM的溶液,并按照体积比为1∶50的比例加入底物后,于光谱仪上进行检测,结果通过Origin软件进行分析和处理.
2 结果与分析
2.1 TALE蛋白N端和C端编码序列与萤光素酶编码序列的融合
由于TALE蛋白的C端序列决定了其所识别的靶标DNA序列中的最后1个碱基,为满足对所有DNA序列的识别需要,分别合成了4种TALE蛋白的C端序列. 通过重叠PCR技术,进一步分别将上述序列与TALE蛋白的N端编码序列和萤光素酶编码序列进行了融合(见图1),并克隆到pET-26b(+)载体中. 最终获得了4种重组载体,并分别命名为:pNI-Luc, pNG-Luc, pNN-Luc, pHD-Luc. 根据已报道的识别关系[3,13],pNI-Luc, pNG-Luc, pNN-Luc, pHD-Luc编码产生的蛋白识别的最后1个碱基分别为A, T, G, C.

图1 pNI-Luc, pNG-Luc, pNN-Luc, pHD-Luc重组载体示意图Fig.1 Schematic diagram of pNI-Luc, pNG-Luc, pNN-Luc, and pHD-Luc recombined carriers
上述构建得到的载体通过限制性内切酶NdeI和SalI进行了双酶切鉴定(见图2). 结果表明:4种重组载体通过酶切均产生了大小约为1200 bp的目的片段,其大小与预期相符. DNA测序的结果进一步验证了上述序列的正确性.

M) DL5000 Marker;1) pET-26 b(+); 2~5) pNI-Luc, pNG-Luc, pNN-Luc, pHD-Luc的Nde I和Sal I双酶切结果图2 pNI-Luc, pNG-Luc, pNN-Luc, pHD-Luc重组载体的鉴定Fig.2 Identification of recombined carriers pNI-Luc, pNG-Luc, pNN-Luc and pHD-Luc
2.2 TDRF-Luc蛋白编码序列的设计与载体构建
基于上述4种重组载体,进一步构建了能编码识别特定DNA序列的完整TALE蛋白表达载体. 后续实验中,待识别的靶标DNA片段为:5′- TTTATCCGCCTCCATCCAGT-3′,最后1个识别碱基为胸腺嘧啶(T). 由于对靶标DNA的最后1个碱基的识别是由TALE蛋白的C端序列决定,根据TALE蛋白与识别碱基的对应关系(NI识别A,NG识别T,NN识别G,HD识别C),选择pNG-Luc载体作为后续实验的出发载体.
对TALE蛋白的单体编码序列进行了选择和排序(见图3),通过Golden Gate技术将经过排序的单体编码序列克隆到pNG-Luc载体,所得载体通过NdeI和SalI进行双酶切鉴定(见图4). 构建所得载体可释放大小约为3000 bp的目的片段,与预期相符;进一步测序验证表明融合表达载体pTALE-TDRF-Luc构建成功.

图3 TDRF-Luc蛋白质单体排布及其识别DNA序列Fig.3 Monomer arrangements of TDRF-Luc and the target DNA sequences
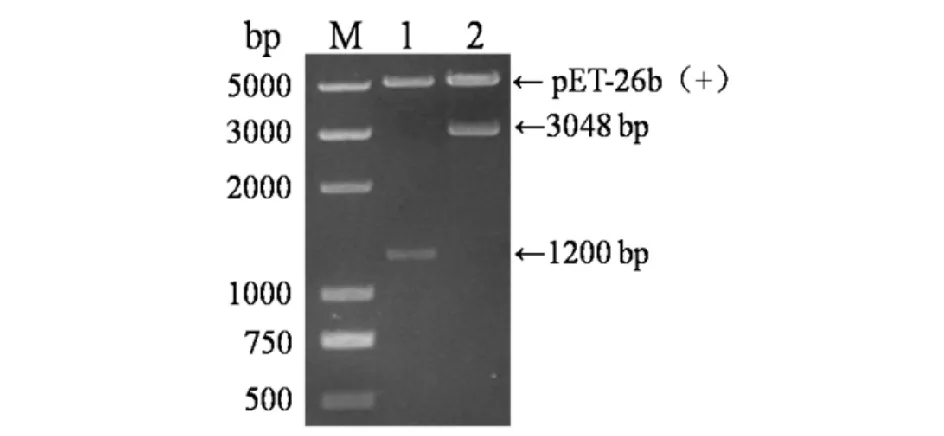
M) DL5000 Marker;1, 2) pNG-Luc和pTALE-TDRF-Luc的Nde I和Sal I双酶切结果图4 pTALE-TDRF-Luc载体的鉴定Fig.4 Identificatin of pTALE-TDRF-Luc carrier
2.3 TDRF-Luc蛋白质的表达与纯化
为获得TDRF-Luc蛋白进行后续研究,将构建成功的pTALE-TDRF-Luc重组载体转化至大肠杆菌菌株BL21(DE3)中,并对目的蛋白进行了诱导表达和分离纯化,最终通过SDS-PAGE,对TDRF-Luc蛋白的分子量和完整性进行了验证,结果见图5. 由图5可见:纯化所得蛋白质在凝胶中条带清晰且基本无杂带,其分子量约为100 kDa,与TDRF-Luc蛋白的理论分子量一致(106.49 kDa),表明TDRF-Luc重组蛋白成功获得了表达和纯化,且产物具有较高的纯度和完整性.
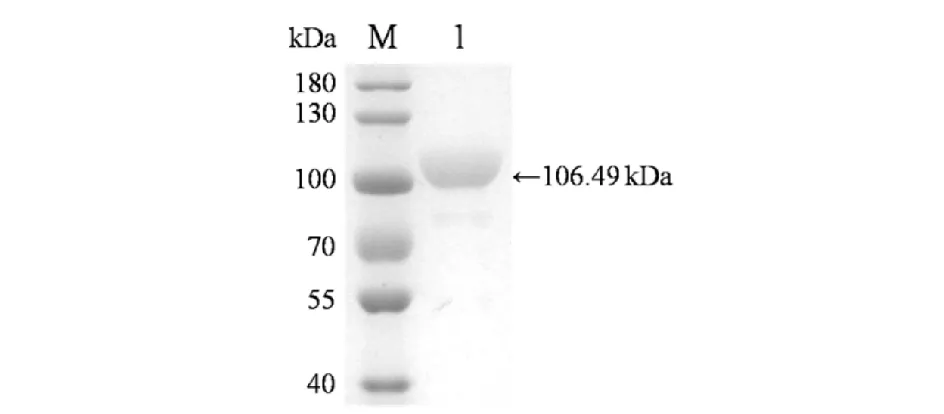
M)蛋白质Marker;1) 纯化所得的TDRF-Luc蛋白样品图5 TDRF-Luc蛋白的SDS-PAGE分析Fig.5 Analysis of TDRF-Luc by SDS-PAGE
2.4 TDRF-Luc蛋白的功能分析
TDRF-Luc蛋白融合了能够识别靶标DNA序列的TALE结构域和具有生物发光效应的萤光素酶结构域. 为了进一步分析TDRF-Luc蛋白的功能,分别对该蛋白结合靶标DNA的能力及其发光特性进行了验证.先通过凝胶迁移实验分析了TDRF-Luc蛋白对靶标DNA的结合能力. 由于靶标DNA与TDRF-Luc蛋白相互作用后,分子量显著增大,负电荷减小,因此,在凝胶电泳时相对单独的DNA分子形成了一条滞后的条带(见图6),说明TDRF-Luc蛋白具有对特定DNA识别和结合的能力.
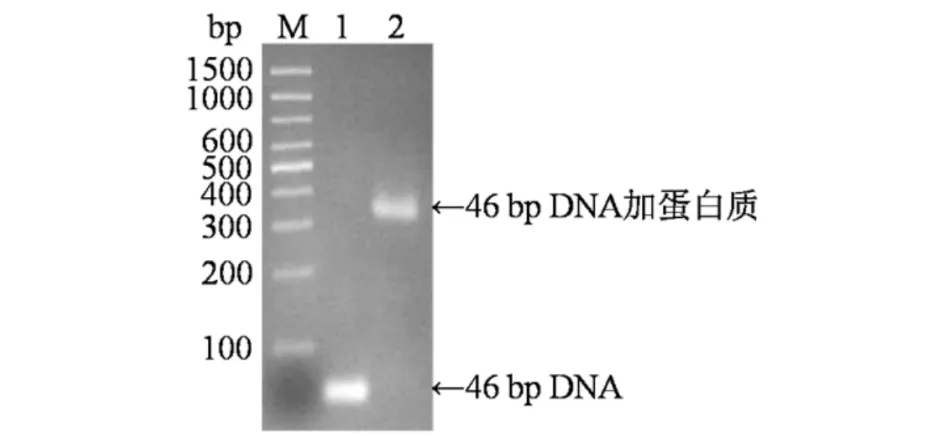
M) 100 bp DNA Marker;1) 靶标DNA;2) 结合了TDRF-Luc蛋白的靶标DNA图6 TDRF-Luc蛋白与靶标DNA相互作用的凝胶迁移分析Fig.6 Gel shift analysis of interaction between TDRF-Luc and target DNA
接着分析了TDRF-Luc蛋白的发光特性. 向TDRF-Luc蛋白样品中添加底物furimazine后,样品可产生明显的特征光谱(见图7). 该光谱的最大发射波长为450 nm,半峰宽为68 nm,与已报道的萤光素酶光谱性质一致[12];说明TDRF-Luc蛋白不仅能与靶标DNA进行特异性识别,还能产生可检测的生物发光光谱.
3 结语
本文将TALE蛋白的N-端、C-端和萤光素酶编码序列进行了融合,并分别构建了4种相应的重组载体:pNI-Luc, pNG-Luc, pNN-Luc, pHD-Luc;并通过Golden Gate技术实现了TALE蛋白重复单体结构域编码序列的组装,构建了重组载体pTALE-TDRF-Luc,对该载体编码的TDRF-Luc融合蛋白进行了表达与纯化. 纯化所得的TDRF-Luc融合蛋白不仅可对靶标DNA序列进行特异性识别,还能产生萤光素酶的特征性光谱(最大发射波长为450 nm,半峰宽为68 nm). 以上结果表明:通过萤光素酶成功地实现了对TALE蛋白的特异性标记,所得重组蛋白既有靶标DNA的识别功能,也可产生高灵敏的生物发光信号.上述双功能的实现为后续定性、定量分析TALE蛋白与DNA的相互作用奠定了基础.
