正中小切口根治性右半结肠切除术(附9例报告)
2018-09-28刘焕然郑永健张伟国
刘焕然,胡 祥,刘 革,梁 品,张 健,张 弛,郑永健,张伟国
(大连医科大学附属第一医院,辽宁 大连,116011)
直肠癌的根治切除往往伴随较大的手术创伤,自1991年腹腔镜直肠切除术开展以来[1-2],手术创伤得到显著改善,患者住院时间、肠道功能恢复、出血及治疗药物费用等均表现出明显优势[3-6],而且手术部位感染、术后肠梗阻发生率显著降低[7]。但腹腔镜手术难度较大,学习曲线较长,中转开腹情况较为常见,仍需小切口开腹取出标本。其间,也有一些学者施行了手助腹腔镜手术,通过手助器协助完成腹腔镜手术,但手助切口长5~8 cm,手术创伤及费用较高。为此,我们进行了正中小切口的右半结肠切除术,手术效果良好,根治度较高,手术时间短,患者的肠道功能恢复、住院时间达到了腹腔镜手术的水平。
1 资料与方法
1.1 临床资料 选取2009年至2013年因升结肠癌入院的9例患者,其中男6例,女3例,中位年龄65岁。BMI平均(23.5±1.9)kg/m2。肿瘤部位:升结肠癌6例,盲肠癌2例,肝曲结肠癌1例。
1.2 手术方法 术前结肠镜及钡灌肠提示环腔生长肿物(图1、图2),病理为结肠腺癌,术后病理分期为PT4N1M0。全身麻醉下患者取头低足高、右高左低截石位,双腿分开。术者立于患者左侧,第一助手立于右侧,第二助手立于患者两腿间(图3)。取右侧绕脐正中小切口,切口长度4.5 cm,逐层切开,放置切口保护扩张套(图4、图5),常规探查腹腔,无腹水、腹腔种植转移,肝脏无结节。(1)与常规开腹手术顺序不同,按图6所示游离系膜,按图7箭头所示方向游离升结肠。先提出横结肠,自横结肠中段沿结肠壁切开大网膜,游离横结肠系膜前叶至肝曲,肝曲游离完毕,向切口外提拉升结肠,边提拉边切开外侧腹膜,沿Toldt筋膜游离升结肠系膜,注意保护十二指肠。一直向下游离至回盲部(图8)。(2)将升结肠送回腹腔,提出回盲部,游离盲肠及末端回肠(图9、图10)。(3)右半结肠游离完毕后,将其提出切口外,游离升结肠系膜至根部,显露外科干,依次结扎断回结肠血管,结肠中动脉,行D3淋巴结廓清(图11)。(4)提出右半结肠,应用直线切割器(GIA)行常规回肠横结肠器械侧侧吻合(图12),切除升结肠,逐层缝合切口及关闭系膜,图13为愈合后切口,长约5 cm。(5)手术初期,因患者肥胖腹型,视线不佳,有盲区操作,手术具有一定风险;因此后期手术中,2例患者因术野显露不良,我们于预定放置引流管部位插入Trocar,放置腹腔镜,通过手助方式完成侧腹膜的剥离,避免盲区操作(图14)。
1.3 统计学处理 采用SPSS 24.0软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;不符合正态分布的计量资料用中位数和四分位数M(Q1,Q3)表示。

图1 术前灌肠图片
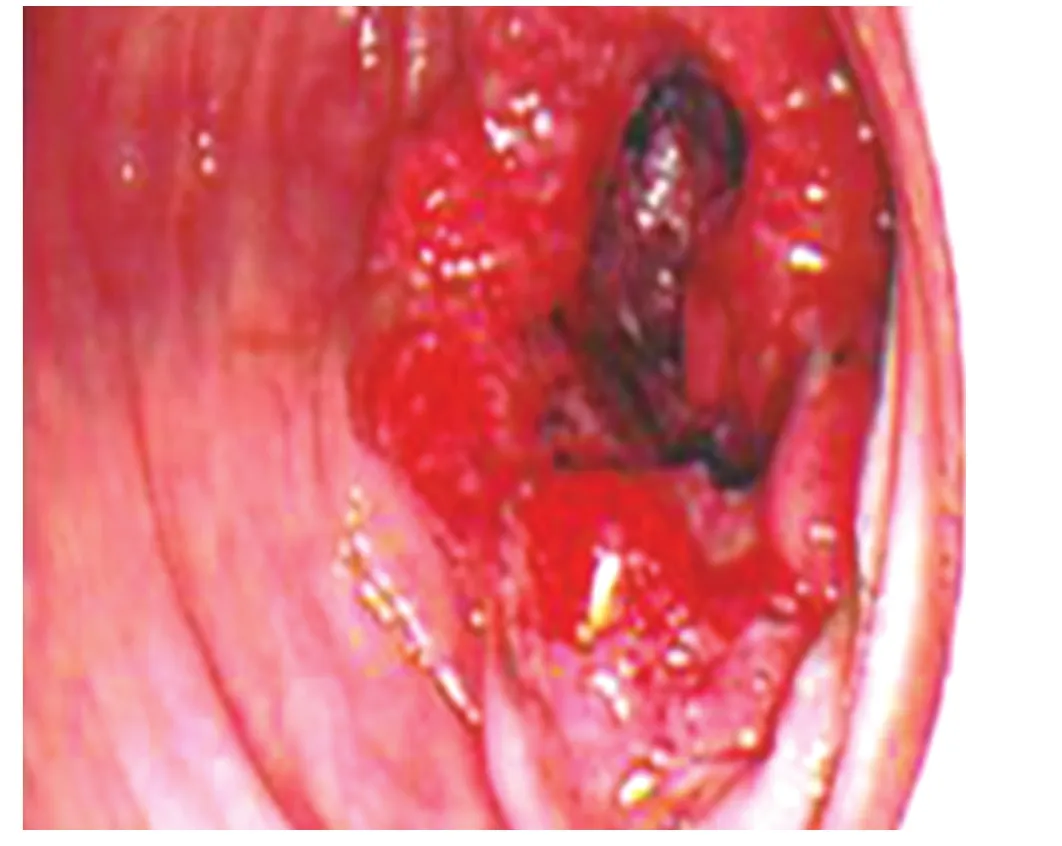
图2 术前结肠镜所见

图3 手术站位

图4 手术切口(红色竖线)
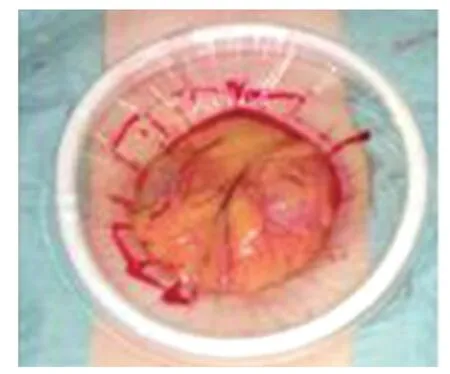
图5 放置切口保护套

图6 系膜的剥离顺序按红色箭头所示方向,与常规手术方向相反

图7 提出横结肠,游离横结肠系膜前叶至肝曲
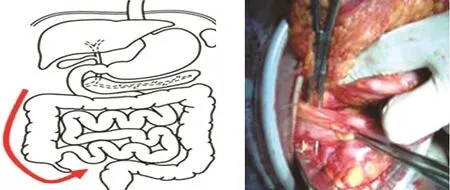
图8 切口外提拉升结肠,边提拉边切开外侧腹膜,沿Toldt筋膜游离升结肠系膜
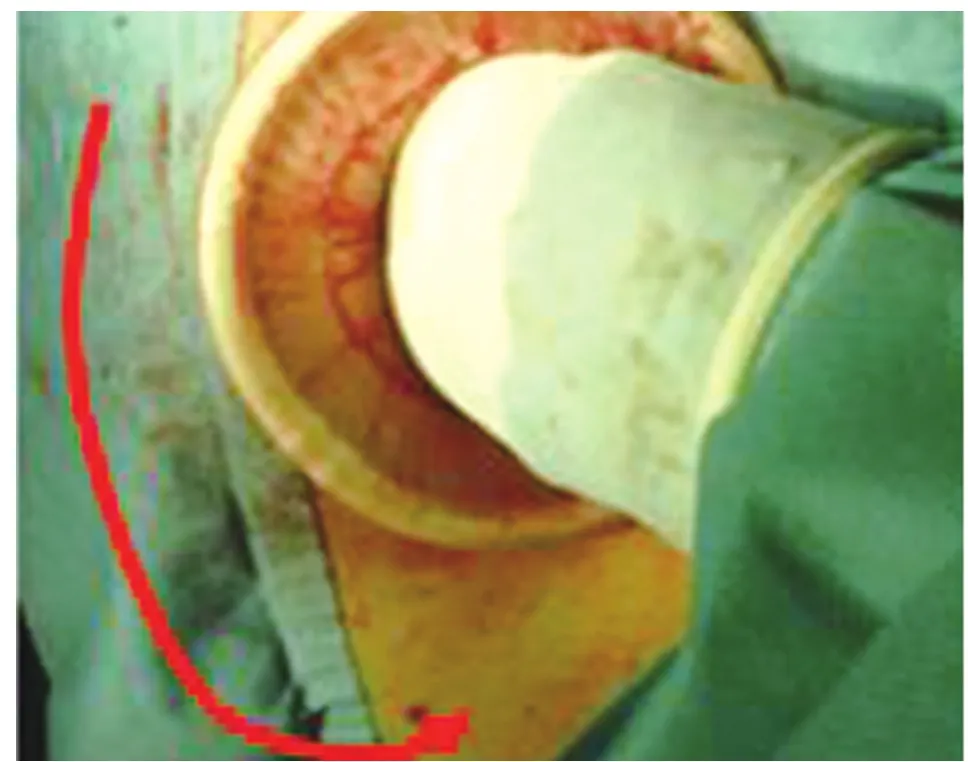
图9 升结肠游离完毕送回腹腔,提出回盲部,游离盲肠及末端回肠

图10 将升结肠提出切口外,行D3淋巴结廓清

图11 应用直线切割器(GIA)行器械侧侧吻合术

图12 应用直线切割器(GIA)行器械侧侧吻合术

图13 术后切口,长约4 cm

图14 预定放置引流管的部位插入Trocar,放置腹腔镜,通过手助方式完成侧腹膜的剥离,避免盲区操作(箭头为预定引流处)
2 结 果
本组9例均为进展期肿瘤;8例中分化腺癌,1例中低分化腺癌;7例完全经正中小切口完成手术,2例因肥胖,于预定放置引流处置入腹腔镜,通过手助腹腔镜完成升结肠的剥离(未额外使用Trocar);其中6例行D3廓清,3例行D2廓清,淋巴结清扫数量平均(13.8±1.6)枚,手术时间平均(132.0±39.0)min,切口长度平均(5.6±0.8)cm;出血量平均(77.0±48.0)mL。术后肠鸣音恢复时间平均(51.9±10.6)h;平均住院(8.6±1.3)d。
3 讨 论
目前微创手术在外科学界已达成共识,以腹腔镜治疗为核心的手术得到广泛开展,数据显示腹腔镜结直肠癌的治疗效果及预后不劣于开腹手术,并且相应的设备及器械得到广泛应用,由最初的手助腹腔镜,到目前的3D腹腔镜、机器人手术,但其学习曲线及手术费用也有了相应提高[8-11]。腹腔镜手术的优势包括:(1)手术创伤小;(2)术野清晰;(3)在高年资医生的带领下可保证手术的安全性。但其缺点也很明显:(1)手术时间长;(2)学习曲线长,对术者及助手要求均较高;(3)手术切口多;(4)设备要求高,为保证手术安全,需要高端昂贵的设备,如腹腔镜、腔内闭合器、吻合器、血管夹、超声刀、LigaSure等;(5)费用高;(6)基层医院受制于设备及当地患者的经济状况,难以开展。综合以上腔镜手术的优缺点,笔者认为在基层医院,尤其经济欠发达地区,开展腹腔镜手术甚至机器人手术还有相当的难度,主要集中在3个方面:(1)医院设备;(2)医护团队的技术要求;(3)患者的经济状况。尽管医生已在腹腔镜手术减轻负担及推广手术方面作出了很大努力,但上述问题收效甚微。
Hsu[12]于2004年报道应用<7 cm的切口行结直肠手术,且术中未使用超声刀、手助器等,其中完成右半结肠切除术81例。王荣等[13]报道247例结肠癌手术,根据手术方式分为小切口组(小切口右半结肠切除术,n=123)与腹腔镜组(腹腔镜辅助右半结肠切除术,n=124),对比两种术式的临床疗效及安全性,结果显示小切口与腹腔镜辅助右半结肠切除术在手术疗效、安全性方面差异无统计学意义,但小切口手术具有切口小、手术时间短、住院费用低的优点,值得临床推广应用。梁勇等[14]统计239例右半结肠癌手术,根据治疗方式分为小切口组(n=92)与腹腔镜组(n=147),比较两组手术安全性及5年累积生存率,同样得出小切口右半结肠手术治疗结肠癌在手术安全性、术后5年累积生存率方面与腹腔镜手术相比差异无统计学意义,但其手术时间短、住院费用较低,是值得临床选择的结肠癌治疗方式。但文献中采用的小切口多为经腹直肌切口,靠近肿瘤,不利于淋巴结清扫。
近年,我院胃肠外科开展了经腹部正中小切口右半结肠切除术,取得了一定疗效,优点为:(1)对设备要求低,基层单位可独立开展。(2)学习曲线短,术者具备一定的开腹手术经验即可开展。手术初期我们选择分期较早的患者,为保障手术安全,3例患者仅行D2廓清,术后病理检查未见淋巴结转移;此后手术中,淋巴结廓清范围完全达到D3水平。(3)手术疗效佳,安全性高。手术时间与我科同时期进行的单纯腹腔镜升结肠根治术[(214.0±51.0)min]相比,差异有统计学意义;术中出血量、术后肠道功能恢复时间、住院时间及手术相关并发症差异无统计学意义。(4)与同类手术相比,正中切口便于围绕外科干的淋巴结廓清,切口可延展性高。(5)对于显露不良的病例,可应用超声刀及LigaSure完成[15]。对于部分肥胖患者,于预定引流管部位置入腹腔镜,亦可通过手助器完成手术[16],无需增加Trocar,手术费用低于腹腔镜手术[17-1]。
小切口行右半结肠切除术是可行的[20-22],应先剥离横结肠,再剥离右半结肠,与目前的无瘤技术有所区别,但因样本量较少,暂不能统计此技术与肿瘤复发转移的相关性。此术式主要存在的问题为游离肝曲结肠时有手术盲区,因而一定程度上增加了手术风险[23-25]。随着手术经验的积累,虽可行盲区操作,但应尽量避免。在预定引流处放置腹腔镜是很好的改良方法[26-27],可直视下完成剥离,避免盲区操作,降低了手术风险。郑民华等[28]指出,小切口手术不适宜肥胖(BMI>25 kg/m2)、肿瘤过大(直径>7 cm)的患者;同时因小切口手术视野的暴露相对困难,容易增加手术时间及出血风险,因此过度肥胖、肿瘤过大是小切口手术的相对禁忌证[28]。
随着此术式的不断开展,以后会对手术价值有更准确、客观的评价,并对手术进行更好的改进,因其具有微创治疗的价值,而且可被医生更好、更快地掌握,同时减轻了患者的身体与经济负担,我们认为小切口右半结肠切除术是手术治疗右半结肠癌可行的术式。
