有机磷培养下水体浮游植物竞争与群落结构演替
2018-09-28苏玉萍张立香陈杨锋李赫龙佘晨兴
苏玉萍,张立香,陈杨锋,李赫龙,佘晨兴,邓 瑶
1 福建师范大学环境科学与工程学院,福州 350007 2 福建省污染控制与资源循环重点实验室(福建师范大学),福州 350007
磷是引起水体富营养化的重要营养元素之一,磷缺乏会阻断细胞生命周期,使浮游植物不能继续生长[1- 3]。浮游植物主要通过吸收利用外源输入的磷和沉积物释放的磷来满足自身生长所需[4]。水体中的磷主要以无机磷和有机磷两种形态存在,有机磷是构成水体和沉积物中总磷的重要组成部分,一般情况下,湖泊、水库中有机态磷占总磷的50%—90%,在沉积物中有机磷可高达12%—60%,在海域中也高达50%—70%[5- 6]。
生物容易利用的磷是溶解性的正磷酸盐[7- 8],溶解性有机磷(Dissolved organic phosphorus, DOP)也是浮游植物重要的磷源,通常情况下,浮游植物会优先利用无机磷,但是当外部磷源耗竭时,浮游植物能通过分泌胞外碱性磷酸酶,将水中溶解态的有机磷化合物水解成为溶解态的无机磷化合物,供自身生长所需[9- 11],因此在无机磷缺乏的水域同样能暴发水华[12]。藻类对DOP的利用具有选择性,不同种类的藻对DOP的利用能力不同[13- 14],有些藻类如米氏凯伦藻(Kareniamikimotoi)对有机磷酸酯的利用效果高于无机磷(NaH2PO4)[14]。Wang等人对浮游藻类在不同浓度草甘膦(GLYP)下的生长效应的研究结果显示,不同藻类对GLYP的生长响应不同,有的藻类可以利用有机磷作为磷源增殖,有的藻类却因有机磷的毒性而生长受到抑制[15- 16]。
限制浮游植物生长的营养物质的供应量以及比例的变化,特别是氮磷比值会对浮游植物群落结构造成影响[17- 18];Wang等人在分批培养条件下研究了五种导致水华的浮游植物对九种溶解性有机磷化合物的利用,结果表明对溶解性有机磷利用能力强的藻类能在群落结构中占据竞争优势,进而发展为水华优势种[19];Ou等人对不同形态有机磷条件下浮游植物的生长和竞争的研究表明,东海原甲藻(Prorocentrumdonghaiense)能利用溶解性有机磷使其在无机磷酸盐耗尽时能够在群落结构中占据优势地位[12];Hessen等人的研究表明,不同磷浓度以及温度高低会影响绿藻门莱茵衣藻(Chlamydomonasreinhardtii)的碱性磷酸酶活性和RNA表达水平以及其细胞的生物量[20];Lin等人分析了磷营养状况的时间和空间变化,对浮游植物对磷吸收的物理和化学限制以及分子机制进行探讨,说明了水华期间溶解性有机磷在浮游植物群落结构由硅藻门演替到甲藻门过程中起重要作用[21];Sunda等人对生态系统破坏性藻类水华的发展和持续性的研究结果表明,有机磷对浮游植物群落结构变化有重要影响[22]。有机磷源条件下,天然水体中浮游植物生长竞争情况及群落结构演替规律以及机理尚未完全明确。
前期本课题组已经完成了54种有机磷对纯种甲藻和绿藻的竞争增殖影响研究,选择对纯种甲藻和绿藻的增殖培养均有较好促进作用有机磷AMP进行本研究,探讨在AMP条件下天然水体中浮游植物竞争和群落结构演替规律,为揭示甲藻水华形成机理和水体富营养化控制提供科学依据。
1 材料与方法
1.1 研究区域概况
九龙江(24°13′—25°51′N,116°47′—118°02′E)北溪发源于玳瑁山,属于丰水带河流。北溪流域是重要的饮用水源地,为流经之地近400万人提供了生活饮用水。九龙江流域上游浅水湖泊中湖流等水动力条件比下游大型浅水湖泊差,不利于磷酸盐释放,营养盐长期滞留于沉积物中,为富营养化暴发埋下隐患[23],另外加上有大量营养盐汇入库区,常有水华暴发[24]。水生态系统中的藻类主要有硅藻门、绿藻门、甲藻门、蓝藻门、隐藻门等[25]。本研究选择北溪流域十一个梯级水库之一的西陂水库。
山美水库(深水水库)(25°09′—25°13′N,118°23′—118°27′E)是一座集供水、灌溉、防洪和发电等功能为一体的综合性大型水利枢纽工程,是泉州下属晋江、惠安、丰泽8个市、县、区的主要供水水源地,担负着400多万人的生活及生产用水。水生态系统中的藻类主要有硅藻门、绿藻门、甲藻门、蓝藻门、隐藻门等,沉积物中的氮磷多以有机形式存在,总磷接近重度污染,整体呈富营养化趋势[26]。
三十六脚湖(海岛潜水水库)(25°27′—25°29′N,119°44′—119°46′E)位于中国福州市平潭县境内,是福建省最大的天然淡水水库,也是平潭县唯一的饮用水源地。课题组前期调研发现库区总磷、总氮平均输入负荷分别为2.390 t/a、46.040 t/a,呈富营养化趋势,水生态系统中的藻类主要有甲藻门、硅藻门、绿藻门、蓝藻门、隐藻门等。 3个水库的主要浮游植物种类见表1。
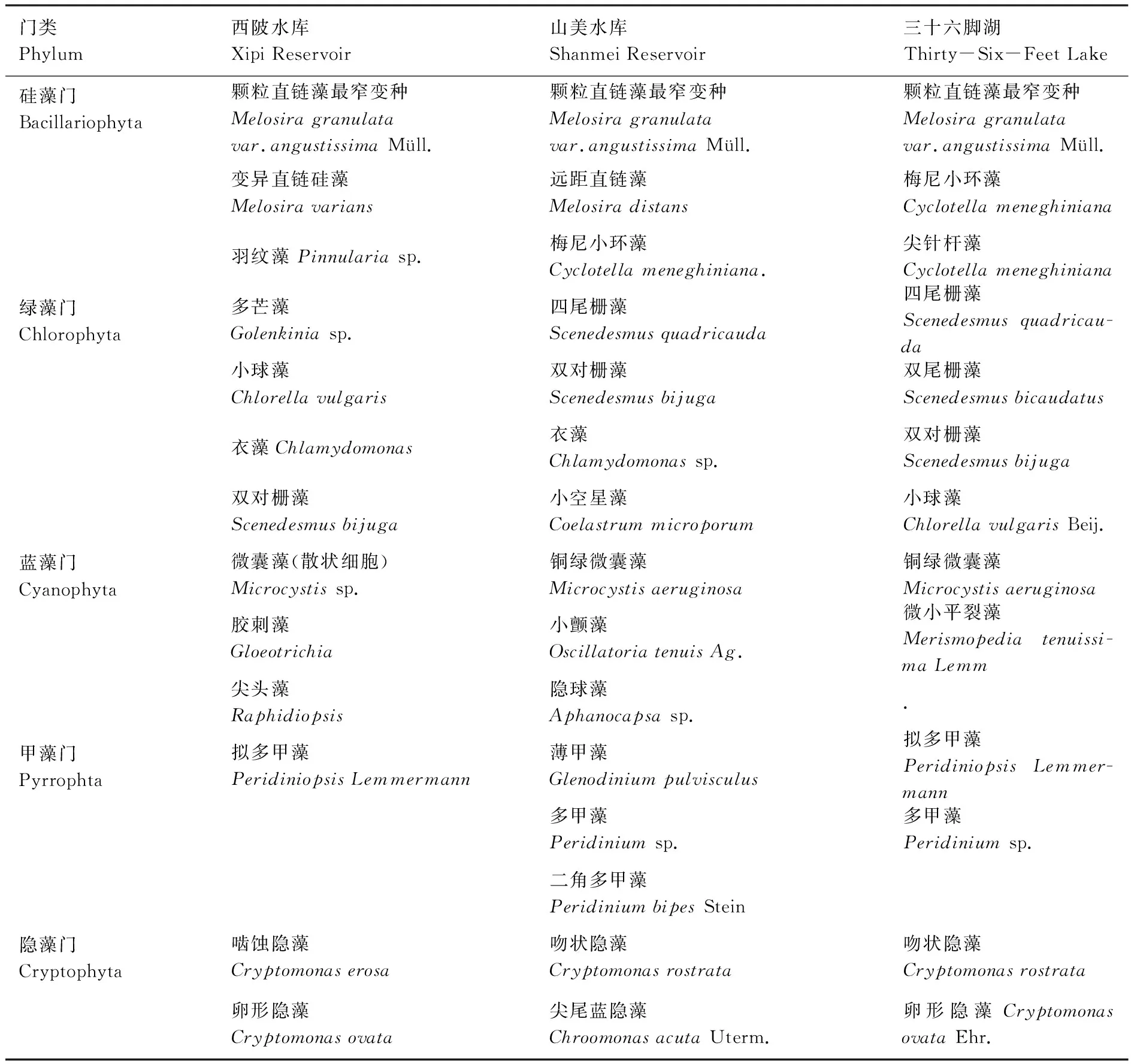
表1 三个水库主要浮游植物种类
1.2 样品采集与分析
2015年12月采集西陂水库表层水样,2016年3月采集山美水库表层水样,2016年6月采集三十六脚湖表层水样分别开展培养实验。用2.5 L的有机玻璃采水器采集水面下0.5 m处水样。采样期间用GPS和声纳仪以及目视两岸参照物定位[27]。采集1 L水样,按水样体积的1.5% 添加鲁格氏碘液进行固定,用于分析水体浮游植物群落结构与丰度,另采集水样带回实验室进行模拟实验。所有水样均装入放有冰块的保温箱中,带回实验室后,尽快处理。
浮游植物分析:1 L水样中加15 mL鲁格氏碘液固定,静置48 h,将样品浓缩至30 mL,加入40%甲醛溶液保存,甲醛用量为样品体积的4%,完成预处理。后期用移液枪移取预处理的样品0.1 mL置于0.1 mL(20 mm×20 mm)的计数框内,在生物显微镜(Leica BM-E光学显微镜)下,以10×40倍进行观察计数,按照章宗涉等人[28]的图谱对视野中的藻类进行判定。采用视野法,按照公式(1)计算水体中浮游植物的细胞丰度,按照章宗涉等人的方法将其换算成生物量(mg/L)[28- 29]。
(1)
式中,N为细胞丰度(个/L);S为计数框面积(mm2);S0为计数视野面积(mm2);V0为浓缩后体积(mL);V为计数体积(mL);n为计数所得藻类个数(个)。
1.3 实验设计
对浮游植物进行为期5 d的磷饥饿处理。3个水库原位水样的磷浓度见表2。实验设置原位水样对照组和实验培养组,培养组培养基设置及样品添加量见表3,培养液为无磷f/2去硅培养液。选择AMP是由于其是水中常见的有机磷成分,相对分子量较低,容易被生物利用,且已有研究表明AMP可以被一些水华常见藻种有效利用[19]。
取200 mL已处理实验样品置于250 mL锥形瓶内,放入生化培养箱中培养20 d,每个培养组设置2组平行样。f/2去硅培养液中m(NaH2PO4·2H2O)=6 mg;6 mg NaH2PO4·2H2O中含磷的质量mP=6×(31/156)=1.2 mg;则200 mL培养液中含磷的质量mP=6×(31/156)×(200/1000)=0.238 mg。单磷酸腺苷AMP的相对分子质量为331,故需要含同浓度的磷的单磷酸腺苷的质量mAMP=1.2×(331/31)×(200/1000)=2.563 mg。培养基中不同磷源的磷浓度相同,均为6 mg/L。培养基添加频率:实验开始时一次性添加。对照组不添加磷。实验温度设置为25℃,光暗周期为L∶D=12 h∶12 h,光照强度为2000 Lux。培养液每日定时振荡10 min(排除CO2影响)后放回生化培养箱。每隔5 d镜检一次,即在第0、5、10、15、20天同步测定浮游植物群落结构及丰度。

表2 三个水库原位水样磷浓度
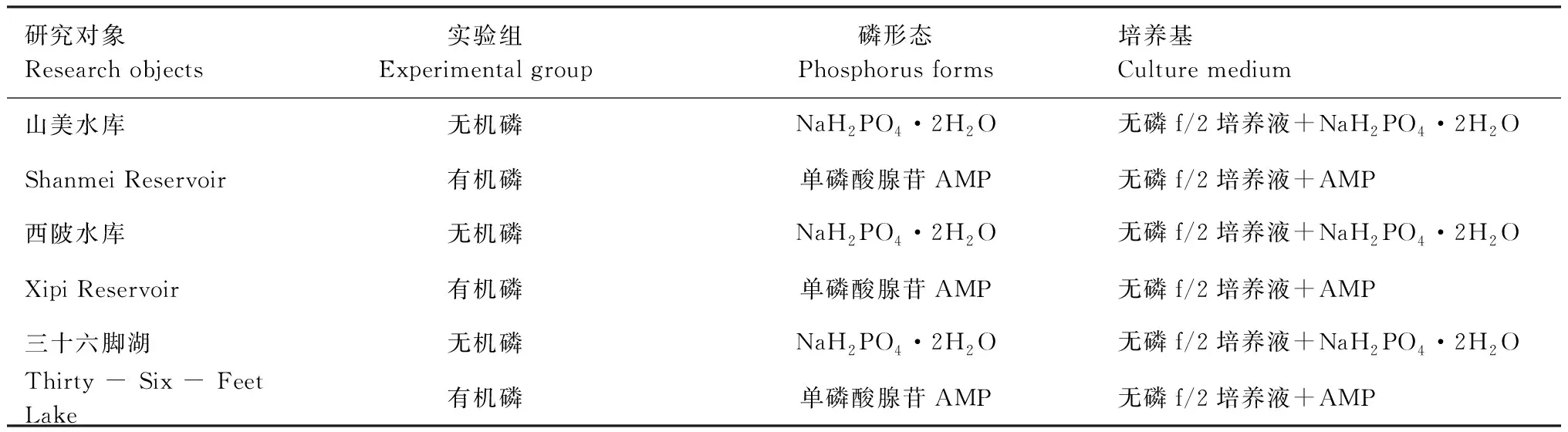
表3 培养组的处理条件设置
1.4 实验组浮游植物分析
取5 mL上层培养液,离心浓缩至1 mL。加入适量鲁格氏碘液固定,完成预处理。分析方法与原位水样浮游植物分析方法相同。
2 结果
2.1 原位表层水样浮游植物群落结构及丰度
通过显微镜观察并计数得到浮游植物群落结构和丰度,见图1,各水库的浮游植物主要门类及藻种见表1。
西陂水库表层浮游植物生物量为0.51 mg/L,浮游植物主要以硅藻、甲藻为主,分别占总生物量的70.3%、19.1%,优势种主要有针杆藻(Synedra)、拟多甲藻(PeridiniopisLemmermann)。
山美水库表层浮游植物生物量为5.24 mg/L,浮游植物主要以甲藻、硅藻为主,分别占总生物量的59.2%、31.3%,优势种为多甲藻(Peridiniales)、针杆藻(Synedra)等。
三十六脚湖水样中浮游植物生物量为5.39 mg/L,浮游植物群落结构中甲藻和硅藻占有明显的优势,二者的生物量之和占总浮游植物生物量的93.6%,其中,甲藻和硅藻分别占50.5%和43.1%,优势种主要为多甲藻(Peridiniales)、针杆藻(Synedra),而绿藻仅占5.0%。

图1 三个水库浮游植物群落结构特征
2.2 有机磷培养对浮游植物竞争与群落结构演替的影响
添加无机磷和有机磷进行实验室模拟,西陂水库、山美水库、三十六脚湖实验组浮游植物群落结构和生物量情况分别见图2、图3和图4。
从图2可看出,西陂水库培养组实验中,以无机磷作为磷源培养时,随培养时间增加,藻类的生物量迅速增加。在培养后的第20天,总生物量从0.51 mg/L增至8.92 mg/L。群落结构变化明显,从以硅藻、甲藻为主演替为以绿藻、蓝藻和硅藻为主,分别占浮游植物生物量的37.7%、31.0%、27.1%。以有机磷为磷源的培养组中,浮游植物生物量也有一定增长,在培养后的第20天达到3.81 mg/L。浮游植物群落结构演替为以甲藻和绿藻为主,甲藻占据绝对优势,其生物量占总生物量的81.8%。硅藻生物量的相对下降可能是因为硅藻对有机磷AMP的利用能力不如甲藻和绿藻,进而影响细胞生长,说明有机磷AMP的添加会影响浮游植物群落结构的演替。
从两个培养组的结果差异上看,在无机磷培养下甲藻生物量无明显变化,而在有机磷AMP培养下,甲藻在浮游植物群落结构中具有绝对的竞争优势。尽管绿藻的初始生物量不高,但在无机磷和有机磷的培养条件下均能演替为优势种,说明绿藻能有效利用的磷源形态更为广泛,25℃温度环境有利于其生长。
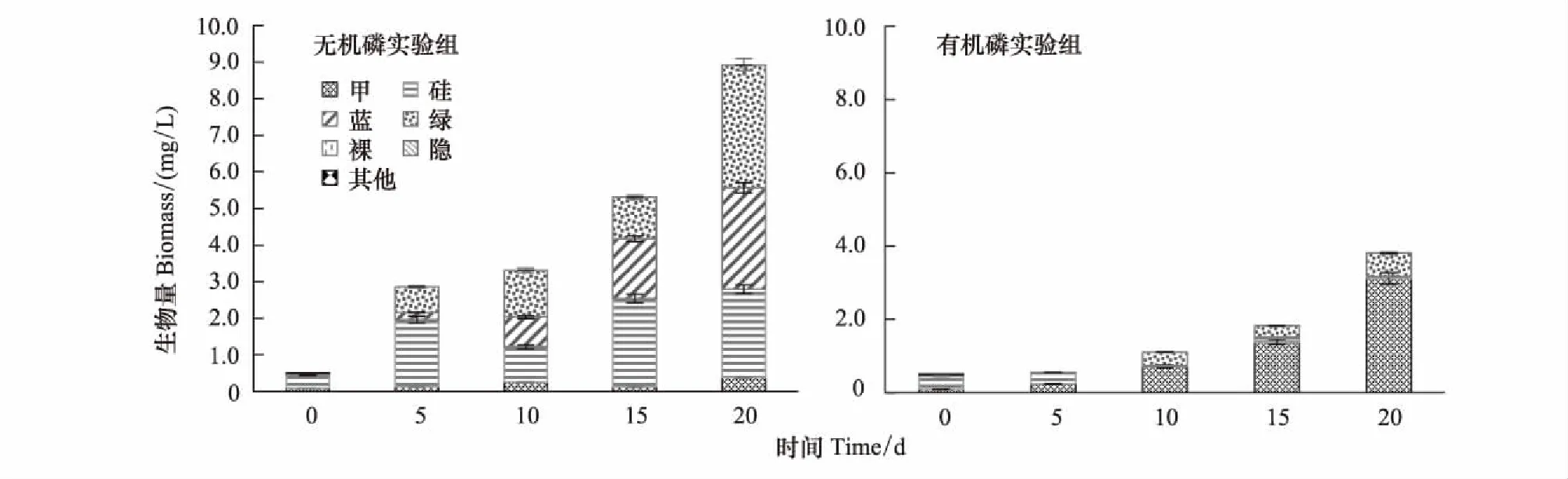
图2 西陂水库培养组藻类生物量及群落结构变化
从图3可以看出,山美水库培养组实验中,无机磷培养组中浮游植物生物量在培养的前10 d呈缓慢下降趋势,之后迅速上升。浮游植物生物量在培养20 d后由5.24 mg/L增长到11.77 mg/L,增加了近1倍,藻群落结构从以甲藻和硅藻为主演替为以蓝藻、硅藻和绿藻为主,分别占总生物量的41.4%、26.6%、21.6%,甲藻的长势较慢,且比重不断降低,在培养后的第20天仅占总量的9.7%。而有机磷培养组中甲藻门的总生物量呈明显增长的趋势。在培养后的第20天,浮游植物生物量从5.24 mg/L增长到16.38 mg/L,增加了近2倍。说明多甲藻对有机磷AMP的利用能力强。在培养初期浮游植物生物量降低可能是由于其对培养环境的不适应,适应后呈快速增长的趋势。浮游植物群落结构由开始时以甲藻、硅藻为主演替为以甲藻和绿藻为主,分别占总丰度的55.2%、33.5%。
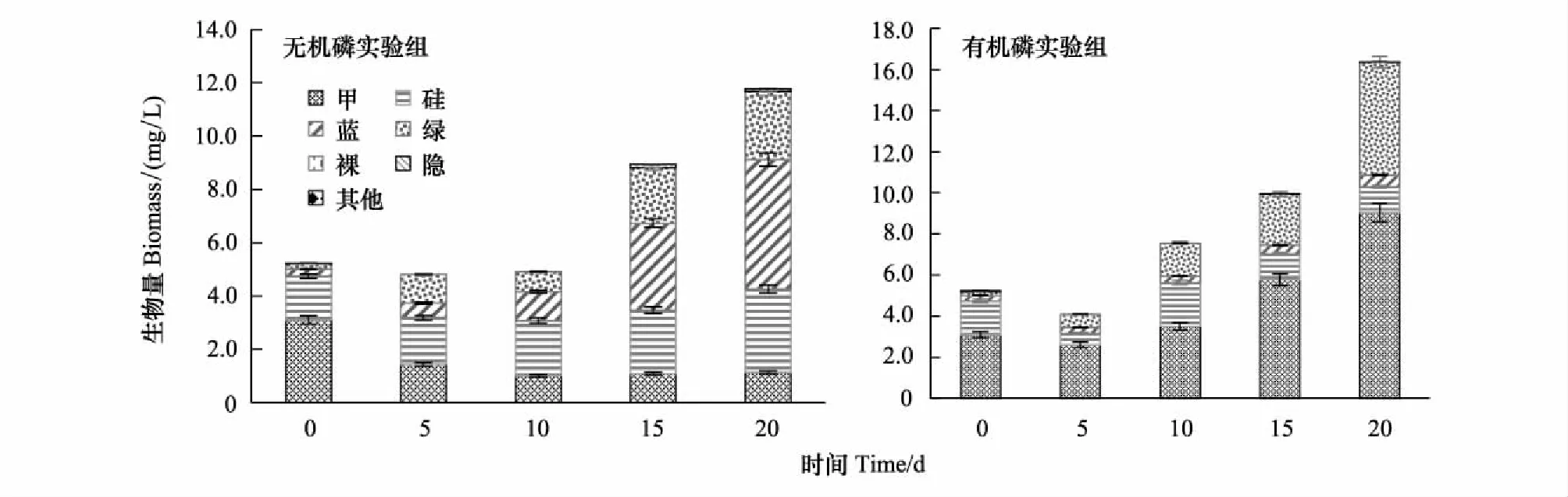
图3 山美水库培养组藻类生物量及群落结构变化
从图4可以看出,三十六脚湖培养组实验中,随培养时间增加,无机磷培养组中浮游植物群落结构明显改变,甲藻日渐衰落,硅藻门竞争优势日趋明显。在培养的第15天到第20天,裸藻门也有一定增长。在培养的第20天,浮游植物总生物量达到11.12 mg/L,群落结构变化明显,从以甲藻门和硅藻门为主演替为以硅藻、绿藻和蓝藻为主,其生物量分别占总生物量的45.6%、18.9%、14.2%,裸藻的比例也有所增大,而甲藻的比例不断减少,由实验初期的占比50.6%降低至10.9%。有机磷培养组中浮游植物总生物量也明显增长,在培养后的第20天达到15.70 mg/L,藻群落结构由以甲藻和硅藻为主演替为以绿藻和甲藻为主,分别占总生物量的24.3%和73.2%,甲藻竞争优势明显。

图4 三十六脚湖培养组藻类生物量及群落结构变化
3 讨论(Discussion)
三组培养实验中表现出的共同规律是,多甲藻能有效利用有机磷AMP,多甲藻在无机磷培养组中逐渐失去竞争能力,而在有机磷培养组中增殖竞争优势明显,进而在藻群落结构中占据优势。
在无机磷和有机磷培养组中,3个水库的浮游植物生物量均有增长,但在培养20 d后,西坡水库有机磷实验组生物量显著低于无机磷实验组,而山美水库和三十六脚湖正好相反,这可能是因为3个水库的初始浮游植物生物量及藻种类结构不同,西陂水库表层浮游植物主要以硅藻门针杆藻(Synedra)为主,占总生物量的70.3%左右;山美水库表层浮游植物主要以甲藻门多甲藻(Peridiniales)为主,占总生物量的59.2%;三十六脚湖水样中浮游植物群落结构中甲藻门多甲藻(Peridiniales)占50.5%,不同藻类对不同形态磷的利用能力不同。
浮游植物能利用有机磷增殖,这与已有的相关研究结果一致[30],不同藻类对溶解性有机磷的选择性利用以及对其利用能力的强弱不同。Yamaguchi等人研究发现,在15种有机磷中,卵圆褐胞藻(Chattonellaovata)只能利用二磷酸腺苷(Adenosine diphosphate,ADP)和三磷酸腺苷(Adenosine triphosphate,ATP)维持自身生长[30]。Richardson等人利用29种有机磷对短凯伦藻(Kareniabrevis)和米氏凯伦藻(Kareniamikimotoi)进行实验室培养发现,两种藻均能较好的利用磷酸酯,但是对磷酸二酯和膦酸酯中的大部分有机磷利用效果较差[14]。Wang等人的研究也说明不同藻类对溶解性有机磷的利用能力不同[19]。
不同形态的磷对不同藻类增殖的影响存在明显差异,这种差异性会导致水体中浮游植物群落结构的变化[31- 32]。在本研究中,无机磷培养组中蓝藻门和硅藻门的藻种增殖速度比其他藻类快,说明蓝藻和硅藻能够更有效地利用无机磷,这与沉积物中无机磷所占比例较高的湖泊更容易爆发蓝藻水华的结果相一致[33]。在有机磷培养组中,甲藻门和绿藻门的藻种能够快速摄取AMP用于自身生长,其种群数量不断增大,逐渐演替为群落的优势种,在群落结构中占据主导地位,而蓝藻却未表现出这种特性。说明在无机磷缺失的环境下,甲藻门和绿藻门利用有机磷AMP的能力更强。这与Ren等人的研究一致[11]。另有报道指出,蓝藻门中的拟柱孢藻在无机磷缺失的情况下能够吸收利用有机磷β- 甘油磷酸酯、D- 葡萄糖- 6- 磷酸和(2- 氨基乙基)- 次膦酸增殖[34],但本实验中在有机磷AMP培养下蓝藻并没有成长为群落的优势种。可能的原因,一方面是本研究中所选用的有机磷AMP可能不是能被蓝藻有效利用的有机磷;另一方面,本研究采用生物量“mg/L”而非细胞密度“个/L” 作为计算单位进行生物量结果的分析,对生物量的表达方式的差异导致了结果的不同。
从群落结构演替来看,尽管本实验所采集的3个水库的原位水样中浮游植物的群落结构起点各不相同,但随着培养实验的进行,3个水库的浮游植物群落结构演替方向日趋明显并具有一致性:无机磷培养组中硅藻门和蓝藻门逐渐演替为群落的优势种,有机磷培养组中甲藻门和绿藻门逐渐演替为群落的优势种,甲藻门占据绝对优势。这与已有报道中的情况类似。Ou等人研究发现,以卵磷脂为有机磷源时甲藻的增殖速率远大于硅藻,并占据绝对优势;在无机磷缺乏的条件下,东海原甲藻的碱性磷酸酶活性比中肋骨条藻更大[12]。Wang等人对5种水华常见藻类的研究发现,相对于硅藻等其他藻类,甲藻能更有效的利用大多数核苷酸并保持良好的增长,甲藻对溶解性有机磷的利用能力和对营养限制的耐受能力为其提供了竞争优势[19]。对磷营养利用机制的差异性可能是许多浮游植物群落中物种演替的重要原因[21]。赵桂英等人的研究表明甲藻门和绿藻门在无机磷缺失的环境下能够通过分泌碱性磷酸酶分解利用有机磷,或者与水体中的细菌等微生物协同利用有机磷来满足自身生长的磷需求[35]。
4 结论
本研究以无机磷(NaH2PO4·2H2O)和有机磷(AMP)分别作为磷源进行培养,探索西陂水库、山美水库、三十六脚湖三个富营养化程度不同的水体浮游植物竞争和群落结构演替的情况,结果表明:
(1)西陂水库、山美水库、三十六脚湖3个水库的初始浮游植物总生物量分别为0.51、5.25、5.39 mg/L,培养20 d后,有机磷实验组中,培养后的3个水库浮游植物总生物量分别达到3.81、16.38、15.70 mg/L,浮游植物生物量分别增加了6.5、2.1和1.9倍,表明有机磷和无机磷一样,能被浮游植物利用,但不同藻类利用效果存在差异。
(2)以无机磷作为磷源时,3个水库浮游植物群落结构组成起点不同,但都演替以硅藻门和蓝藻门为主;而在有机磷培养组中,3个水库浮游植物群落结构演替为以甲藻门和绿藻门藻种为主,且甲藻门的竞争优势明显,其中,西陂水库浮游植物群落结构由硅藻门(70.3%)、甲藻门(19.1%)演替为以甲藻门(81.8%)和绿藻门(16.7%)为主;山美水库由甲藻门(59.2%)和硅藻门(31.3%)演替为甲藻门(55.2%)和绿藻门(33.5%)为主;三十六脚湖由甲藻门(50.5%)和硅藻门(43.1%)为主演替为甲藻门(73.2%)和绿藻门(24.3%)为主。
(3)本研究结果表明,有机磷AMP能有效促进甲藻门拟多甲藻属的增殖,特别是西陂水库甲藻门拟多甲藻对有机磷AMP的利用能力强,实验结束时,甲藻门拟多甲藻所占藻生物量比例达到81.8%,这是否是2009年西陂水库发生甲藻门拟多甲藻水华的原因,有待进一步结合野外观测进行研究。
