母源性PM2.5暴露致子代鼠大脑皮层神经炎症与星形胶质细胞和小胶质细胞激活
2018-09-27王婷婷郑昕蕊李文燕张红霞李锋杰于丽
王婷婷,郑昕蕊,李文燕,张红霞,李锋杰,于丽
(潍坊医学院临床医学院组织学与胚胎学教研室,山东省神经疾病与再生修复重点实验室,潍坊261053)
近几年,随着雾霾现象加重,人们越来越担心空气污染对健康造成的负面影响。美国环境保护局于2015年发布的《氮氧化物的综合科学评估 - 健康标准》(第二次外部评估草案)显示空气污染物主要包括氮氧化物、二氧化硫、臭氧、PM2.5( fine particulate matter with diameter of ≤ 2.5μm)和 PM10(fine particulate matter with diameter of ≤ 10μm),其中PM2.5成分复杂,引起的危害尤为关注。研究表明,母源性PM2.5暴露可引起孕妇的慢性炎症进而影响胎儿的发育[1]。因PM2.5颗粒物极小,直径小于2.5μm,可以吸入肺通过气血屏障、胎盘屏障及血脑屏障,妊娠期暴露于空气污染可对胎儿及儿童的神经发育造成潜在危害[2-4]。Umezawa等[5]发现超微大气颗粒物可能直接造成胎儿大脑的神经炎症,但其确切机制尚不清楚。
课题组前期已观察到妊娠期PM2.5暴露可导致子代鼠出现脑损伤[6]。本实验采用改良快速气管滴注法建立妊娠小鼠PM2.5染毒模型,研究子代鼠出生后生长发育期大脑皮层TNF-α、IL-1β和IFN-γ等炎症因子的表达变化,并检测PM2.5对子代鼠大脑皮层神经元、星形胶质细胞和小胶质细胞细胞的影响,从而探讨母源性PM2.5暴露导致子代发育期大脑皮层出现持续神经炎症发生的机制。
材料与方法
1 实验动物
SPF级昆明小鼠,7~8周龄,小鼠体重34±4g,购自山东青岛市动物实验中心。饲养条件:室温22℃左右,自由饮水、进食。
2 PM2.5 标本的采样和处理
使用大气颗粒物采样器,收集 2015 年 12 月至2016 年 1 月采暖季某地级市城区大气PM2.5。制备样品的方法参考课题组前期的研究[6]。
3 动物分组和造模
受试小鼠按雌雄2∶1合笼,次日查出阴栓者记为妊娠第1天。将孕鼠随机分为空白组、PBS对照组、PM2.5模型组(分为低、中、高剂量组),每组 6只。空白组不做任何处理,对照组气管内滴注PBS 30µl,PM2.5低、中、高剂量组参照课题前期方法[7]分别注入浓度为 0.2592µg/µl、1.56695µg/µl和3.456µg/µl的 PM2.5混悬液 30µl,从妊娠第 1 天开始每3天采用快速小鼠气管滴注改良法滴注 1 次,整个孕期共 7 次。
4 ELISA检测炎症因子的变化
子代鼠分别在出生后第1d、7d、14d、21d、30d处死,分离大脑皮层。组织匀浆提取总蛋白,严格按照操作说明,采用ELISA试剂盒检测妊娠期PM2.5子代鼠大脑皮层TNF-α、IL-1β和IFN-γ的含量。首先配制标准品,根据标准品的浓度求出相应 OD值,并计算出直线回归方程画出标准曲线,再根据各样品的 OD 值计算出相应TNF-α、IL-1β和IFN-γ的浓度。
5 免疫荧光/TUNEL双标染色检测
子代鼠出生后第14d,5%水合氯醛腹腔注射麻醉,0.9%生理盐水和4%多聚甲醛全身灌注,完整剖取鼠脑;将鼠脑依次放入4℃,30%、25%、20%蔗糖梯度脱水;冰冻切片,切片厚度20µm,-20℃保存;37℃烤箱烤片30min,PBS洗5min×3次,微波抗原修复冷却至室温,PBS清洗后滴加10%羊血清37℃烤箱50min,甩去羊血清,滴加小鼠抗NeuN单克隆抗体(1∶300)或小鼠抗GFAP单克隆抗体(1∶200)或兔抗Iba1多克隆抗体(1∶50),阴性对照滴加等体积的PBS,37℃烤箱孵育1h,室温1h,4℃过夜;37℃ 1h,PBS清洗,根据一抗种属滴加Cy3标记的羊抗兔IgG(1∶200)或Alexa Fluor-594标记的羊抗小鼠IgG(1∶200)的二抗,37℃避光孵育1h;PBS清洗后,采用原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)凋亡检测试剂盒检,配制反应液(50µl TdT+450µl 荧光素标记的dUTP液)滴加到组织上,阴性对照组仅滴加20µl 荧光素标记的dUTP液,37℃避光孵育1h,滴加Hoechst33258(1∶1000)37℃避光孵育25min,PBS清洗,封片,激光共聚焦显微镜下观察。随机从每个样品的皮层组织选取5张高倍数图像,用Image-Pro Plus软件对每张图片的荧光强度和脑细胞数量进行半定量分析。
6 统计学分析
结 果
1 PM2.5暴露导致子代鼠发育期大脑皮层炎症因子升高
ELISA测定显示,与对照组相比,PM2.5暴露后子代鼠出生后生长发育期大脑皮层中TNF-α、IL-1β和IFN-γ表达均呈增多趋势。出生第7d,与对照组相比,PM2.5模型组子代鼠大脑皮层IL-1β增加不明显,TNF-α和IFN-γ的表达逐渐增多,并与PM2.5剂量呈正比,且PM2.5高剂量组差异明显(图1A-C)。出生第14d,与对照组相比,PM2.5模型组子代鼠大脑皮层TNF-α、IL-1β和IFN-γ的表达均增多,PM2.5中剂量组IFN-γ表达差异明显,PM2.5高剂量组TNF-α和IL-1β的表达差异显著(图1A-C)。出生第21d,与对照组相比,PM2.5模型组子代鼠大脑皮层TNF-α、IL-1β和IFN-γ的表达均增多,PM2.5中、高剂量组TNF-α和IFN-γ表达差异均有统计学意义,PM2.5高剂量组IL-1β则有明显差异(图1A-C)。出生第1d和第30d的子代鼠大脑皮层上述炎症因子变化不明显。
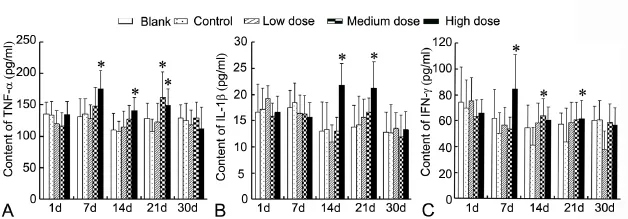
图1 孕期PM2.5暴露后子代鼠大脑皮层中TNF-α、IL-1β和IFN-γ水平ELISA检测。A,TNF-α;B,IL-1β;C,IFN-γ;*,与对照组相比,0.01<P<0.05(n=5)Fig. 1 ELISA assay to determine the levels of TNF-α, IL-1β and IFN-γ in the frontal cortex of mouse offspring after maternal exposure to PM2.5 during pregnancy. A, TNF-α. B, IL-1β. C, IFN-γ. *0.01<P<0.05, compared with control (n=5)
2 PM2.5暴露对子代鼠大脑皮层神经元和神经胶质细胞发育的影响
出生后14d,免疫荧光双标染色显示,PM2.5模型组子代鼠大脑皮层额叶区NeuN阳性细胞分布稀疏;荧光强度定量分析显示,与对照组相比,PM2.5中、高剂量组NeuN免疫反应性明显降低(图2A、2B)。相反,PM2.5模型组子代鼠大脑皮层额叶区GFAP阳性细胞表达逐渐增多,细胞胞体肥大,突起增多延长,PM2.5高剂量组GFAP免疫反应性明显增强(图3A、3B);PM2.5模型组子代鼠大脑皮层额叶区Iba1阳性细胞同样呈逐渐增多趋势,Iba1阳性细胞的胞体变大,突起缩短,PM2.5高剂量组Iba1免疫反应性也明显增强(图4A、4B)。
与对照组相比,PM2.5中、高剂量组子代鼠大脑皮层额叶区可见NeuN/TUNEL双阳性细胞数增多,尤以PM2.5高剂量组明显(图2A、2B);PM2.5高剂量组子代鼠大脑皮层额叶区GFAP/TUNEL双阳性细胞数明显增多(图3A、3B),中、高剂量组Iba1/TUNEL双阳性细胞数均显著增多(图4A、4B)。
讨 论
大量的流行病学调查表明,PM2.5已成为心血管疾病、呼吸系统疾病以及中枢神经系统疾病发生发展的重要危险因素。研究证实,PM2.5能够引起全身炎症反应[8]。本课题前期通过动物实验研究发现,随着PM2.5吸入剂量的增加,孕鼠及子代鼠心、肝、脾、肺、肾等主要脏器均出现炎症等病理变化[7,9]。炎症反应在PM2.5诱导的损伤中发挥重要作用。空气污染物对中枢神经系统的潜在不利影响已引起关注,但妊娠期持续暴露于PM2.5可否引起后代发生长期神经炎症,目前尚不清楚。
当空气污染物进入体内时,会产生先天性免疫应答。通过评估脑细胞炎症因子(如IL-1β、TNF-α和IFN-γ)的水平可以观察到这种反应,这些细胞炎症因子是突出的炎症信号传导介质,可将促炎信号传导至免疫细胞释放新的炎症因子[10]。为了探讨妊娠期PM2.5暴露致胎儿和儿童期神经炎症发生的机制,本研究通过ELISA检测了妊娠期暴露于PM2.5对子代鼠大脑皮层TNF-α、IL-1β和IFN-γ等炎症因子水平的影响,结果显示,妊娠期暴露于PM2.5环境后,子代鼠大脑皮层TNF-α、IL-1β和IFN-γ等炎症因子水平升高,由此进一步证实妊娠期PM2.5暴露可致子代鼠大脑炎症反应。本实验还发现,出生后14d和21d的PM2.5模型组子代鼠的TNF-α、IL-1β和IFN-γ等炎症因子持续增高。14d和21d龄的小鼠相当于人的青春期间段,处于生长发育的重要阶段,母体炎症致子代的炎症反应一般不会持续太久,说明PM2.5可能直接作用于子代鼠引起神经炎症,从而造成子代神经发育障碍。
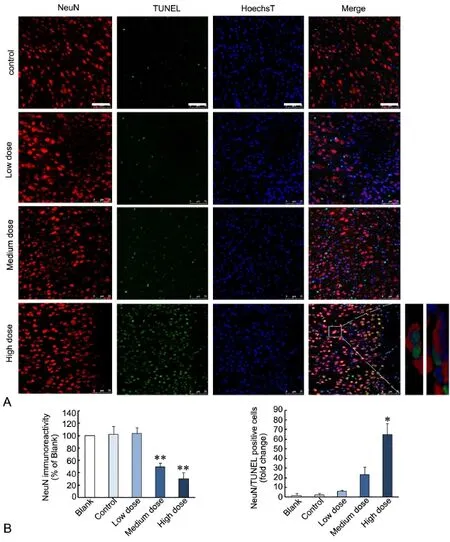
图2 孕期PM2.5暴露后子代鼠大脑皮层额叶区NeuN免疫反应性与NeuN/TUNEL双标细胞数变化。A,NeuN免疫荧光与NeuN/TUNEL双标染色, Hoechst复染细胞核;比例尺,75µm;B,大脑皮层额叶区NeuN免疫荧光强度(左)和NeuN/TUNEL双标细胞数(右)统计学分;*,与对照组相比,0.01<P<0.05;**,与对照组比较,P<0.01(n=5)Fig. 2 Changes of NeuN immunoreactivity and NeuN/TUNEL double positive cell number in the frontal cortex of mouse offspring after maternal exposure to PM2.5 during pregnancy. A, NeuN/TUNEL double staining with Hoechst counter stain of nuclei. Scale bar, 75µm; B, Quantitative analysis of NeuN fluorescence intensity (left) and number of NeuN/TUNEL double positive cells (right). *, 0.01<P<0.05, **, P<0.01, compared with control (n=5)
PM2.5具有潜在的神经毒性,其超微颗粒可以吸入肺,穿过气血屏障进入循环系统,穿过胎盘屏障和血脑屏障,从而引起神经炎症。我们推测,PM2.5可以通过两条途径引起胎儿的神经炎症。间接途径为PM2.5直接诱导母体的炎症反应释放炎症因子,炎症因子通过胎盘屏障,进而穿过胎儿的血脑屏障引起神经炎症;直接途径为PM2.5进入孕鼠体循环,直接穿过胎盘屏障,损伤胎儿的血脑屏障,导致子代鼠的神经炎症。Schaafsma等[11]发现,妊娠期母体炎症,胎儿小胶质细胞中促炎性细胞因子IL-1β和TNF-α的表达增加,表明母源炎症反应是胎儿脑小胶质细胞促炎细胞因子的来源,进而证明PM2.5可通过间接途径引起胎儿的神经炎症。
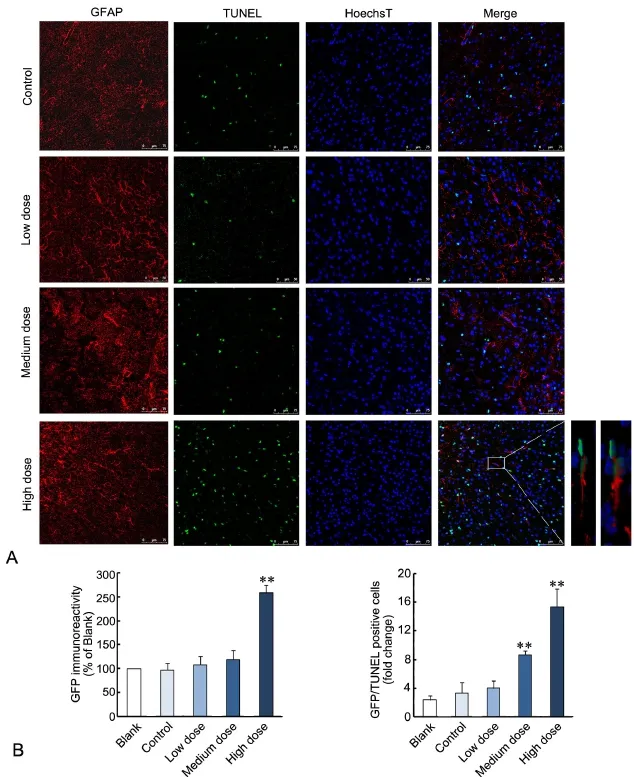
图3 孕期PM2.5暴露后子代鼠大脑皮层额叶区GFAP免疫反应性与GFAP/TUNEL双标细胞数变化。A,GFAP免疫荧光与GFAP/TUNEL双标染色, Hoechst复染细胞核;比例尺,75µm;B,大脑皮层额叶区GFAP免疫荧光强度(左)和GFAP/TUNEL双标细胞数(右)统计学分;**,与对照组比较,P<0.01(n=5)Fig. 3 Changes of GFAP immunoreactivity and GFAP/TUNEL double positive cell number in the frontal cortex of mouse offspring after maternal exposure to PM2.5 during pregnancy. A, GFAP/TUNEL double staining with Hoechst counter staining for nuclei. Scale bar, 75µm. B, Quantitative analysis of GFAP fluorescence intensity (left) and number of GFAP/TUNEL double positive cells (right). **, P<0.01, compared with control (n=5)
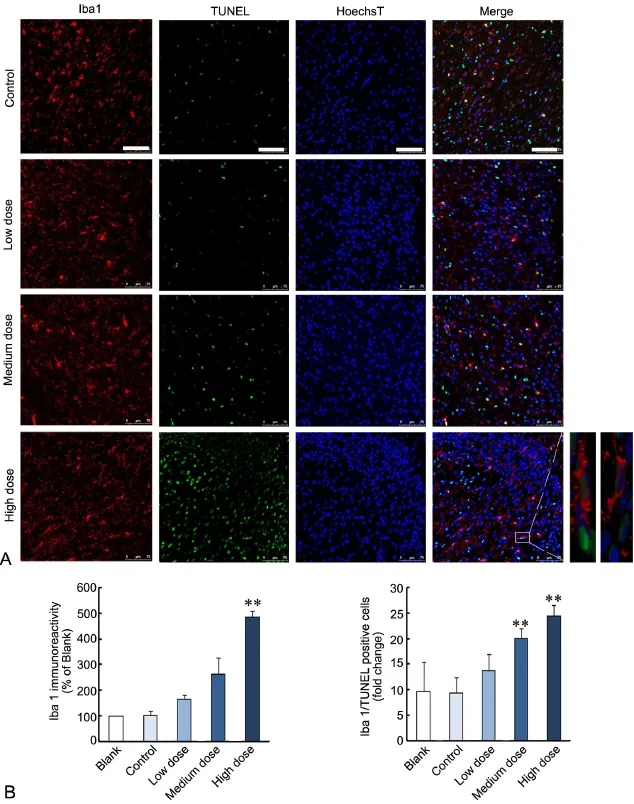
图4 孕期PM2.5暴露后子代鼠大脑皮层额叶区Iba 1免疫反应性与Iba 1/TUNEL双标细胞数变化。A,Iba 1免疫荧光与Iba 1/TUNEL双标染色, Hoechst复染细胞核;比例尺,75µm;B,大脑皮层额叶区Iba 1免疫荧光强度(左)和Iba 1/TUNEL双标细胞数(右)统计学分;**,与对照组比较,P<0.01(n=5)Fig. 4 Changes of Iba 1 immunoreactivity and Iba 1/TUNEL double positive cell number in the frontal cortex of mouse offspring after maternal exposure to PM2.5 during pregnancy. A, Iba 1/TUNEL double staining with Hoechst counter staining for nuclei. Sscale bar, 75µm. B, Quantitative analysis of Iba 1 fluorescence intensity (left) and number of Iba 1/TUNEL double positive cells (right). **, P<0.01, compared with control (n=5)
许多神经疾病的共同特征是血脑屏障完整性的破坏和中枢神经系统中免疫细胞的浸润。星形胶质细胞和小神经胶质细胞是中枢神经系统主要的免疫细胞[12]。为明确IL-1β、TNF-α和IFN-γ与星形胶质细胞和小神经胶质细胞关系,本研究先通过ELISA检测发现出生后14d、21d的子代鼠炎症因子表达较明显,进一步采用免疫荧光染色和激光共聚焦显微镜技术检测出生14d子代鼠神经细胞GFAP和Iba1,发现在大脑皮层额叶区,随着PM2.5吸入剂量的增加,GFAP和Iba1荧光强度增加,说明妊娠期暴露于PM2.5环境中子代鼠星形胶质细胞和小胶质细胞被激活。IFN-γ可诱导的小鼠脑星形胶质细胞和小神经胶质细胞的激活,释放高水平的IL-1β和TNF-α等炎症因子及细胞毒性物质,从而造成神经元失能及细胞死亡[13,14],并且活化的神经炎症小胶质细胞可诱发具有神经毒性的反应性星形胶质细胞[15]。活化的星形胶质细胞分泌VEGF和FGF等因子。FGF通过阻断触发VE-钙粘蛋白内化( Vascular endothelial cadherin),VEGF则通过调节连接分子的表达来破坏BBB完整性,进而促进PM2.5侵袭中枢神经系统。活化的小胶质细胞分泌IL-1β也可以促进星形胶质细胞释放VEGF和胸苷磷酸化酶(TYMP)。VEGF与TYMP破坏紧密连接蛋白,增加血脑屏障通透性[16]。胎儿大脑的血脑屏障尚未完全发育成熟,来自于母鼠的PM2.5则更容易穿过血脑屏障致子代鼠中枢神经系统星形胶质细胞和小胶质细胞激活。激活的星形胶质细胞和小胶质细胞可产生炎症因子损伤局部组织,并与释放的损伤相关模式(DAMP)分子一起,进一步增加炎症和胶质细胞激活,导致恶性的炎症循环。这种长期的炎症可能在中枢神经系统造成灾难性的后果,从突触的丧失到认知功能受损以及明显的神经变性[17]。由此说明PM2.5可通过直接途径作用于子代鼠CNS从而导致炎症。
神经炎症、细胞凋亡是空气污染可能对大脑产生不利影响的公认的生物机制。本课题前期发现PM2.5剂量组神经元逐渐减少,caspase-3阳性表达细胞增多,推测神经细胞发生凋亡[6]。本实验进一步检测发现,NeuN/TUNEL、GFAP/TUNEL和Iba1/TUNEL双阳性细胞率均随着PM2.5暴露剂量的增加而增加。虽然妊娠期暴露于PM2.5子代鼠脑细胞凋亡增多,但最终的结果星形胶质细胞和小神经胶质细胞仍成激活状态,炎症因子呈高水平表达。已知PM2.5可通过增加活化的NF-κB和促炎细胞因子的水平,特别是TNF-α和IL-1β,来诱导神经炎症和小胶质细胞活化[18]。这与我们的研究结果妊娠期暴露于PM2.5子代鼠大脑皮层星形胶质细胞和小神经胶质细胞激活和TNF-α、IL-1β和IFN-γ表达增多相一致。因此,我们推测妊娠期PM2.5暴露直接导致子代大脑皮层星形胶质细胞和小胶质细胞的激活可能是导致神经炎症的主要途径。
综上所述,妊娠期暴露于PM2.5可在子代鼠大脑皮层引起以神经细胞凋亡,胶质细胞活化和炎症因子过多表达为特征的改变。因此,妊娠期暴露于PM2.5对胎儿神经毒性应引起人们的高度重视,针对妊娠期女性应给予防护,不易长时间暴露于PM2.5环境中。
