肝刺激因子促进过氧化氢诱导的肝星形细胞凋亡
2018-09-27艾伟伦董凌月安威
艾伟伦,董凌月,安威
(首都医科大学细胞生物学系肝脏保护与再生北京重点实验室,北京 100069)
肝纤维化(liver fibrosis)是肝脏受损后,胶原等细胞外基质过度堆积的病理过程[1]。肝星形细胞(hepatic stellate cell,HSC)是肝脏内的非实质细胞,其活化是肝纤维化进程中细胞外基质最主要的来源。HSC活化并进而转分化为肌成纤维样细胞[2]的特征包括细胞的增殖、趋化、凋亡抑制和细胞外基质的分泌[3]。研究显示促进活化型HSC凋亡能够减少活化型HSC的数量,从而最终减轻肝脏纤维化[2]。因此认识其活化特征并探寻参与其中的关键分子是研究肝纤维化细胞学机制的关键。肝刺激因子(hepatic stimulator substance,HSS)是从肝部分切除术后初断乳的大鼠再生肝中提取的一种生物活性蛋白[4],能够刺激肝脏再生,并保护肝脏免受毒物损伤[5]。HSS与细胞凋亡关系密切,例如,在非酒精性脂肪肝病(nonalcoholic steatohepatitis,NASH)模型中,肝细胞的凋亡伴随着HSS表达的降低,这提示HSS与肝细胞凋亡存在密切的关系[6]。此外,HSS能够减少肝细胞内质网应激引起的损伤,抑制肝细胞凋亡[7]。除肝细胞外,HSS还在HSC中表达[8]。然而,HSS与HSC的凋亡之间的相关性仍然不明。因此本实验建立HSS过表达HSC细胞模型后,利用过氧化氢(hydrogen peroxide,H2O2)构建活化型HSC的凋亡模型[9],以此探究HSS对活化型HSC凋亡的影响。
材料和方法
1 实验细胞和主要试剂
人肝星形细胞LX-2细胞系,其表型为活化型HSC(本实验室保存)。DMEM(Dulbecco’s modifi ed Eagle medium)、Opti-MEM培养基和胎牛血清(fetal bovine serum,FBS)(美国Gibco公司)。胰蛋白酶和蛋白酶抑制剂(美国sigma公司)。细胞裂解液(北京索莱宝科技有限公司)。pcDNA3.0质粒(InvitrogenTM)(美国Thermo Fisher 公司)。pcDNA3.0-HSS质粒系本实验室前期构建[7]。转染试剂(FuGENE® HD)(美国Promega公司)。兔抗HSS/ALR多克隆抗体、兔抗GAPDH多克隆抗体和山羊抗兔IgG抗体(美国proteintech公司)。Caspase-Glo® 3/7 Assay试剂盒(美国Promega公司)。Hoechst 33342荧光染料、DAPI(4’,6-diamidino-2-phenylindole)荧光染料、Annexin V-FITC细胞凋亡检测试剂盒和一步法TUNEL细胞凋亡检测试剂盒(红色荧光)(上海碧云天生物技术公司)。
2 细胞培养和瞬时转染
LX-2细胞系培养于37℃,5% CO2培养箱中,使用含有10%FBS的DMEM。培养过程中,3d换液一次,待融合至80%~90%进行传代。将生长状态良好的LX-2细胞按2×105个/孔接种于六孔塑料细胞培养板中。培养22h至融合达90%,进行瞬时转染。取4支无菌Eppendorf管,分别加入Opti-MEM培养基100µl。然后向其中2支分别加入2µg pcDNA3.0-HSS和pcDNA3.0质粒,涡旋混匀,室温静置5min;剩余两只分别加入6µl转染试剂,涡旋混匀,室温静置5min。分别将各组质粒与转染试剂混匀,室温静置20min。吸弃培养板中细胞培养液,并用PBS轻柔洗去剩余培养基。将上述转染试剂和质粒混合液加入培养板中,并添加含有10% FBS的DMEM至每孔液体终体积2ml。转染18h,弃去含有转染试剂的培养基,加入含有10% FBS的DMEM培养3d。转染后的两组细胞,分别命名为HSS-Tr组(HSS过表达组)和Vector-Tr(质粒对照组)。转染完毕后,PBS轻柔洗去培养板中培养基2次,随后每孔加入含有2.5μmol/L H2O2和10% FBS的DMEM 1ml,培养细胞20min厚,收集细胞,进行凋亡检测。
3 Western blot鉴定转染效率
细胞转染完成后,弃去培养基,用PBS轻柔清洗培养板中剩余培养基2次。每孔加入4℃预冷的新鲜加入蛋白酶抑制剂的细胞裂解液100µl。使用细胞刮刀将细胞收集至Eppendorf管中,冰上裂解30min,每隔10min涡旋30s,共3次。4℃、12000r/min离心10min后收集上清液,用BCA法测定蛋白质浓度,制备样本,99℃变性5min,立即置于冰上,进行SDS-聚丙烯酰氨凝胶电泳(SDS-PAGE)。电泳后利用电转印的方法将蛋白质转移至0.22µm PVDF膜上,步骤详见本实验室已发表文章[10]。将膜放入15ml含有5%脱脂奶粉的1×TBST中,室温摇床封闭1h。按照1∶2500的稀释比例将兔抗HSS/ALR多克隆抗体或兔抗GAPDH多克隆抗体加入到0.5%脱脂奶粉中,配制第一抗体工作液。PVDF膜浸于第一抗体工作液中4℃摇床过夜。1×TBST漂洗10min,重复3次。按照1∶4000的稀释比例将山羊抗兔IgG抗体加入到0.5%脱脂奶粉中,配制第二抗体工作液。PVDF膜浸于第二抗体工作液中,室温摇床孵育1h,1×TBST漂洗10min,重复4次,使用化学发光仪(C-DiGit® Blot Scanner, 美国Li-Cor公司)显影。显影后的数字化图片,通过软件Image J进行强度分析,从而获得HSS和GAPDH(内参)表达量的数据。最终通过比较二者表达量,从而获得定量结果。
4 Hoechst 33342染色
按照文献所述进行操作[11],具体步骤如下:充分弃去H2O2处理后细胞的培养基,使用PBS轻柔洗去培养基2次,充分弃去后每孔加入10μg/ml Hoechst 33342,37℃培养箱中染色30min。用PBS轻柔洗去染色液2次,充分弃去后每孔加入1ml PBS。应用荧光显微镜(FW4000,德国Leica公司)观察和拍摄图片,每个样本随机拍摄6个视野。注意拍摄图片时,应保证曝光度和对比度保持一致。随后使用Image J软件计算每张图片(相同放大倍数下)总细胞数和Hoechst阳性细胞数。
5 TUNEL细胞凋亡实验
按1×104个细胞的比例将细胞接种于96孔细胞培养板中常规培养24h。H2O2处理细胞后,充分弃去培养基,4%多聚甲醛固定30min,随后0.5%Triton X-100室温孵育5min;PBS洗涤3次,每次5min。按1∶9的比例避光混合TdT酶和荧光标记液,配制TUNEL检测液。充分弃去各孔PBS,每孔加入TUNEL检测液50μl,37℃孵育60min后加入DAPI复染5min。PBS洗涤细胞3次。荧光显微镜观察和拍摄图片每个样本随机拍摄6个视野。拍摄图片时,保证曝光度和对比度保持一致。随后使用Image J软件计算每张图片(相同放大倍数下)TUNEL细胞阳性细胞数。
6 Annexin V-FITC/PI染色流式细胞术
将H2O2处理后的细胞用PBS洗涤3次后,收集细胞于Eppendorf管中。室温,800r/min离心5min,收集细胞。用1ml 4℃预冷的PBS重悬细胞,室温800r/min离心5min,充分弃去上清后加入195μl 的Binding Buffer 悬浮细胞沉淀。加入5μl Annexin VFITC和5μl PI避光染色25min。流式细胞分析仪(D3130,ACEA Biosciences公司)分析检测。
7 Caspase 3/7活性检测
按照试剂盒说明书进行操作,步骤如下:按1×104个细胞的比例将细胞接种于96孔细胞培养板中常规培养24h。H2O2处理细胞后,充分弃去培养基,使用PBS轻柔洗去培养基2次,每孔加入100μl caspase 3/7活性检测液和100μl DMEM,振荡混匀,37℃反应30min后,800r/min离心5min,收集上清液至不透光塑料检测板中,使用96孔板荧光检查仪(Glo-MaxTM,Promega公司)测定荧光素酶活性。
8 统计学分析
所有实验数据以平均值±标准差表示。采用SPSS 16.0.2统计软件对实验结果进行分析,两组间比较采用Student’t检验;多组间比较采用单因素方差分析(ANOVA),P<0.05被认为有显著性差异。各个实验至少重复3次。
结 果
Western blot检测显示,转染pcDNA-HSS的LX-2细胞(HSS-Tr组)内HSS水平显著高于转染空载体的LX-2细胞(Vector-Tr组)(图1),说明瞬时转染后,过表达HSS的LX-2细胞模型构建成功,可用于下一步的实验。
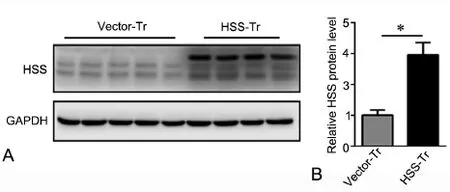
图1 Western blot实验检测转染效率。A,代表性Western blot结果;B,Western blot检测结果统计学分析; *P<0.05(n=3)Fig. 1 Transfection efficiency was conf i rmed by Western blotting. A, representative results of Western blot.; B, statistical analysis of Western blot results.*P<0.05 (n=3)
为明确HSS对H2O2诱导HSC凋亡的作用,应用Hoechst 33342染色检测了过表达HSS对H2O2诱导HSC凋亡的影响。将细胞分成4组,实验组的Vector-Tr和HSS-Tr细胞分别给予2.5μmol/L H2O2刺激20min;对照组为Vector-Tr和HSS-Tr细胞分别添加等体积双蒸水处理20min。加入Hoechst 33342染液对活细胞进行染色后荧光显微镜下观察发现,HSS-Tr组(过表达HSS)的H2O2处理细胞中Hoechst 33342染色阳性细胞百分比(38.13%±4.15%)显著高于Vector-Tr组(转染空载体)的H2O2处理细胞中Hoechst 33342染色阳性细胞百分比(28.35%±1.83%)(图2)。

图2 HSS对H2O2诱导的细胞凋亡影响的Hoechst 33342染色检测。A, Hoechst 33342染色,箭头示Hoechst 33342阳性细胞;比例尺,50μm;B, Hoechst 33342染色阳性细胞百分比的统计学分析;共进行3次独立实验,每组细胞随机拍照6个视野;*P<0.05Fig. 2 Hoechst 33342 stain to evaluate the effect of HSS on cell apoptosis induced by hydrogen peroxide. A, representative images of Hoechst 33342 stain. White arrows pointed at Hoechst 33342-positive cells; scale bar, 50μm;. B, statistical analysis of Hoechst 33342 positive cells. Graph represented the average of 3 independent repeats. Each group had 6 randomly selected fields; *P<0.05
为进一步验证Hoechst染色实验结果,应用红色荧光标记的TUNEL染色液检测了H2O2刺激后各组细胞的凋亡情况。荧光显微镜观察TUNEL染色和DAPI复染的细胞显示,与Vector-Tr组H2O2处理细胞相比,HSS-Tr组H2O2处理细胞TUNEL阳性细胞显著性增多(图3)。

图3 HSS对H2O2诱导的细胞凋亡影响的TUNEL染色检测。A,TUNEL染色,DAPI复染,箭头示TUNEL染色阳性细胞;比例尺,50μm;B,TUNEL染色阳性细胞百分比的统计学分析;共进行3次独立实验,每组细胞随机拍照6个视野;*P<0.05Fig. 3 TUNEL staining to show the effect of HSS on cell apoptosis induced by hydrogen peroxide. A, representative images of TUNEL staining. White arrows pointed at TUNEL-positive cells; scale bar, 50μm;. B, statistical analysis of TUNEL positive cells. Graph represented the average of 3 independent repeats. Each group had 6 randomly selected fields; *P<0.05
进一步应用Annexin V-FITC/PI流式细胞术检测显示, H2O2刺激后,与Vector-Tr组细胞相比,过表达HSS的LX-2细胞晚期凋亡(Annexin V和PI双阳性)数目显著性增加;与此对应,正常细胞(Annexin V阴性PI阳性)数目则显著性减少,而早期凋亡细胞(Annexin V阳性PI阴性)无明显差异(图4)。

图4 HSS对H2O2诱导的细胞凋亡影响的Annexin V-FITC/PI流式细胞术检测。A,细胞凋亡的Annexin V-FITC/PI流式细胞术分析代表性结果;B,凋亡细胞数的统计学分析;*P<0.05(n=3)Fig. 4 Annexin V-FITC/PI stain measured by flow cytometry exhibited the influence of HSS on cell apoptosis induced by hydrogen peroxide. A,representative images of Annexin V-FITC/PI stain detected by flow cytometry; B, statistical analysis of apoptosis. Graph represented the average of 3 independent repeats; *P<0.05 (n=3)
为了明确HSS是否通过影响调控细胞凋亡的关键分子caspase3/7而促进H2O2诱导的细胞凋亡,利用Caspase-Glo® 3/7 Assay试剂盒分析了细胞内caspase 3和caspase 7活性。在H2O2刺激后,Vector-Tr组和HSS-Tr组细胞中caspase 3/7活性均显著性升高,HSS-Tr组细胞升高更为显著(图5)。
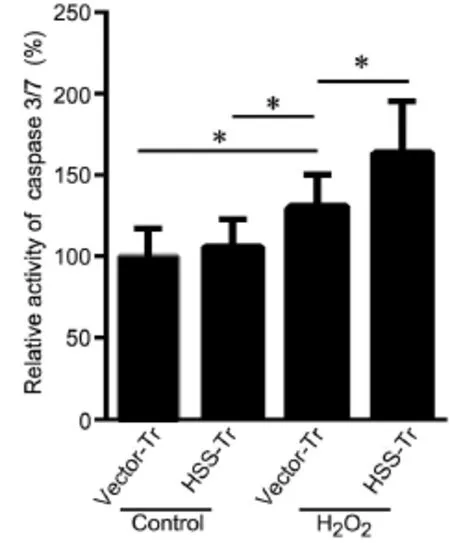
图5 HSS对caspase3/7活性影响的统计学分析。*P<0.05(n=3)Fig. 5 Statistical analysis for the effect of HSS on cell caspase3/7 activity.*P<0.05 (n=3)
讨 论
活化型HSC数目的减少是改善肝纤维化最具特点的特征之一[3]。减少活化型HSC的数目,可减少胶原等细胞外基质的分泌[3,12]。活化型HSC的减少可以通过促进细胞的凋亡实现。文献报道,活化的HSC能够表达一系列与细胞凋亡相关的受体,例如TNF receptor 1(TNFR1),p75NTR和 TRAIL受体[13]。此外,静脉注射聚乙二醇化TRAIL能够促进活化型HSC的凋亡,减少四氯化碳所致的肝纤维化[14]。这均说明,活化型HSC的凋亡在改善肝纤维化的过程中具有重要的意义。
然而,对于HSC的凋亡的研究还十分有限。我们有必要找寻其他的活性蛋白促进活化型HSC的凋亡,为治疗肝纤维化提供实验依据。已证实HSS在HSC中表达,而且23 kD形式主要表达在线粒体的膜间隙[15]。在肝细胞中,HSS扮演者守护者的角色。但是,其在肝非实质细胞中的作用和功能仍不明了。在大鼠HSC细胞系HSC-T6中, HSS能够减少α-SMA在mRNA水平的表达,减少胶原的分泌[8],但目前尚缺少对HSS效应的机制研究。由于LX-2细胞具有较高的转染效率[16],因此,我们在本实验中,采取了相同的研究方法,向LX-2细胞中瞬时转染pcDNA3.0-HSS,pcDNA3.0-vector质粒。Western blot实验验证了本实验中过表达HSS的LX-2细胞模型的建立成功。
细胞程序性死亡过程中的氧化应激反应能导致活性氧簇(reactive oxygen species,ROS)的累积。H2O2诱导HSC凋亡的模型,已经广泛运用在细胞凋亡的机制研究之中[9]。我们利用这一模型,证实在活化型HSC中,H2O2能够上调caspase 3和caspase 7的活性,增加活化型HSC的凋亡。Caspase 3和caspase 7是细胞凋亡的执行者,能够抑制DNA的修复作用,同时启动DNA的降解[17]。我们的实验结果进一步证实,在H2O2诱导LX-2细胞凋亡的模型中,HSS能够增加caspase 3/7活性,促进LX-2细胞的凋亡。此外,利用Annexin V-FITC和PI共染实验,通过流式细胞仪分析,可以区分早期细胞凋亡和晚期细胞凋亡。实验证实,HSS能够增加晚期细胞凋亡的数量,即Annexin V(+)PI(+)数目显著性增多。此外,Hoechst 33342细胞凋亡检测和TUNEL染色均证实了相同的结果。然而,HSS通过何种途径增加LX-2细胞的凋亡,仍然不明。值得一提的是,线粒体通透性转变孔的持续开放,促使线粒体膜电位的下降,导致氧化磷酸化解偶联,最终导致细胞的凋亡[18,19]。由于23 kD的HSS定位在线粒体的膜间隙,因此,HSS可能通过影响线粒体的膜通透性或者影响线粒体膜电位,从而激活细胞程序性死亡。
